正常家兔左心室三层心肌Cx43表达的异质性研究
钟江华,陈小盼,陆士娟,黄珊,黄康,张伟,刘正旺
(1.中南大学湘雅医学院附属海口医院 海口市人民医院心血管内科,海南 海口 570208;2.海南医学院附属医院,海南 海口 570102)
·论 著·
正常家兔左心室三层心肌Cx43表达的异质性研究
钟江华1,2,陈小盼2,陆士娟1,黄珊2,黄康1,张伟1,刘正旺2
(1.中南大学湘雅医学院附属海口医院 海口市人民医院心血管内科,海南 海口 570208;2.海南医学院附属医院,海南 海口 570102)
目的 观察正常家兔三层心肌间跨室壁缝隙连接蛋白43(Cx43)分布的差异,探讨恶性室性心律失常(MVA)的发生机制。方法检测并对比正常家兔左心室三层心肌间的单相动作电位复极90%时程(APD90)以及Cx43蛋白(Cx43-pro)和mRNA(Cx43-Cq)的表达差异。结果(1)正常家兔三层心肌间APD90存在差别,中层心肌(233.80±19.37)组织APD90均长于心内膜(201.20±18.72)和心外膜下(202.70±19.91)心肌组织(P<0.05),说明家兔三层心肌间存在跨室壁复极的离散;(2)正常家兔三层心肌间的Cx43-pro[(0.58±0.08)vs(0.47±0.04)vs(0.57±0.07)]与Cx43-Cq[(24.61±2.82)vs(22.18±2.62)vs(24.43±3.31)]差异均有统计学意义(P<0.05),中层心肌较心内膜与心外膜下心肌组织表达减少,表明家兔三层心肌间存在跨室壁Cx43表达的异质性。结论正常家兔中层心肌与心内外膜下心肌间存在Cx43蛋白表达不均一,这是左心室存在心肌横断面上复极离散的蛋白基础。
家兔;恶性室性心律失常;缝隙连接蛋白43;复极离散;中层心肌
恶性室性心律失常(MVA)是临床常见的急危重症,患者常常发生心脏骤停而致心源性猝死(SCD)。在低血钾、心肌梗死、心力衰竭等病理条件下,MVA发生率明显增加,故此探讨MVA的发生机制有重要的临床意义。近年来,有研究认为MVA的发生与跨室壁复极离散相关[1],中层心肌的单相动作电位时程(APD)尤其是复极时程明显较心内外膜下延长,使心肌存在跨室壁的复极离散,有诱发早期后除极(EAD)、延迟后除极(DAD)和触发活动并在室壁横断面内折返形成MVA如尖端扭转型室性心动过速、心室颤动等。但跨室壁复极离散的蛋白机制并不清楚。
缝隙连接蛋白Cx43是介导左心室肌细胞间电流传导的主要导体[2-3],本研究通过观察家兔离体心脏左心室心肌单相动作电位时程(APD)和Cx43的跨室壁异质性,探讨MVA的蛋白分子机制。
1 材料与方法
1.1 动物分组及模型制作 选择健康家兔20只,体重2.0~3.0 kg,雌雄不限。
1.2 实验中相关的溶液制备 用改良的台氏液进行心脏离体灌流,其成分主要包:HEPES 5 mmol/L,NaH2PO41 mmol/L,葡萄糖10 mmol/L,KCl 5.4 mmol/L,NaCl 115 mmol/L,MgCl21 mmol/L,CaCl21.8 mmol/L,并用NaOH将制备溶液的pH值调配为7.4[4]。准备好eppendorf管,将1 mmol/L EGTA,5 mmol/L EDTA,1 mmol/L NaHCO3,1 mmol/L苄脒,1 μmol/L胃酶抑素,1 μmol/L亮肽素,1 mmol/L碘乙酰胺,100 nmol/L抑肽酶,1 mmol/L PMSF,以及pH8.0的缓冲液分别加入试管[5]。
1.3 离体心脏电生理实验 参照既往实验方法[4]进行电生理实验。
1.3.1 电生理实验前准备 将离体后的心脏放入4℃台氏液中修剪,称量重量后立即插管给予进行Langendorff灌流(恒压8.52~8.78 kPa,恒温36.5℃~37.5℃,纯氧饱和)。
1.3.2 电生理实验 起搏电极由两支针形电极组成,两针相距0.5 cm,在心脏搏动最强处刺入。参比电极固定于主动脉根部,将三个自制的简易电极通过注射针头插入左室心肌层,调整电极位置,使之分别位于心内外膜下0.5 mm处及距心外膜面距离3.0 mm处。将简易电极全部与生物信号采集与处理系统连接,以500~1000 Hz为滤波参数。用心电生理刺激仪以1 000 ms的起搏周长固定起搏。稳定20 min后同步记录三层心肌组织的单相动作电位。
1.4 左心室三层心肌组织提取 电生理实验结束后剪取家兔的左心室心肌游离壁,通过快速冰冻切片的方法分别采集心内外膜下心肌和中层心肌组织(连续切片10次,每片20 μm,共200 μm)[5]。将切取的三层心肌组织放入预先准备的Eppendorf管内并液氮冷冻保存。
1.5 Western-blot检测Cx43蛋白表达 分别将采集的家兔各层心肌组织匀浆、提取组织蛋白后根据逐个上样,凝胶电泳后转PVDF膜,将PVDF膜放入5% TBST脱脂牛奶中封闭2 h,滴加Cx43单克隆抗体(Zymed 35-5000)后4℃过夜,加入辣根过氧化物酶标记二抗(Novogene公司)后继续室温孵育2 h,增强化学发光法显色后显影于X线胶片上。获取蛋白质信号图像后,分别测定目的蛋白Cx43和内参蛋白GAPDH的光密度(OD)值,以两者的比值作为Cx43蛋白的表达水平[4]。
1.6 RT-qPCR检测Cx43 mRNA表达 将eppendorf管中各组左心室冷冻组织样本研成粉末状,提取心肌组织总RNA,用RevertAid First Strand反转录酶试剂盒合成cDNA,再行qPCR扩增,以GAPDH作为内参对比。上游引物:5′-GAGGTGGCCTTCTTGCTGAT-3′,下游引物:5′-GTTTTCTCAGTGGGGCGAGA-3′,预计扩增片段长度122 bp。GAPDH上游引物:5′-AGAGCACCAGAGGAGGACGA-3′,下游引物:5′-TGGGATGGAAACTGTGAAGAGG-3′,预计扩增片段长度104 bp。反转录反应参数:42℃60 min,70℃5 min。qPCR反应参数:50℃3 min,95℃15 min,95℃10 s,60℃20 s,72℃30 s,重复40个循环。qPCR扩增过程中收集荧光,反应结束后,分析、计算qPCR过程各检测样本荧光信号能被检测到的循环阈值(CT值),并通过2-ΔΔCT法计算样本的Cx43 mRNA表达差别倍数(Cq值)以代表Cx43 mRNA相对表达水平。
1.7 检测指标 (1)APD复极90%时程(APD90):单相动作电位从0期复极至振幅下降90%的时间距离。(2)Cx43-pro:左心室各层心肌组织Cx43蛋白表达水平。(3)Cx43-Cq:左心室各层心肌组织Cx43 mRNA表达水平。
1.8 统计学方法 本实验的数据资料为完全随机设计资料,所有数据均使用SPSS13.0统计软件进行统计分析。采用单因素方差分析(one-way ANOVA)进行组间差异的显著性比较。如果方差齐同,组间两两比较采用SNK检验,方差不齐则用Tamhane检验。均以P<0.05为差异有统计学意义。
2 结 果
2.1 左心室三层心肌APD参数 正常家兔三层心肌间APD90存在差别,中层心肌组织APD90要长于心内膜和心外膜下心肌组织,说明家兔三层心肌间存在跨室壁复极的离散,见表1。
表1 左心室三层心肌间电生理参数和Cx43表达比较(±s,n=20)
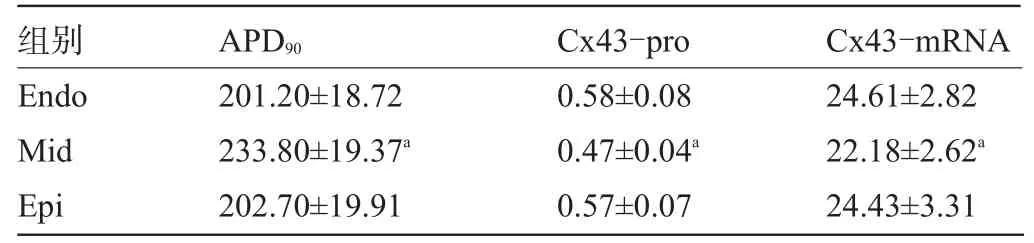
表1 左心室三层心肌间电生理参数和Cx43表达比较(±s,n=20)
注:与心内外膜下比较,aP<0.05;Endo:心内膜下心肌,Mid:中层心肌,Epi:心外膜下心肌。
组别Cx43-mRNA APD90Cx43-pro Endo Mid Epi 24.61±2.82 22.18±2.62a24.43±3.31 201.20±18.72 233.80±19.37a202.70±19.91 0.58±0.08 0.47±0.04a0.57±0.07
2.2 左心室三层心肌Cx43蛋白和mRNA表达比较 正常家兔左心室中层心肌的Cx43-pro与Cx43-Cq均较心内膜和心外膜下心肌组织减少(P<0.05),而心内膜和心外膜下心肌间无明显差别,表明Cx43蛋白和mRNA在正常家兔左心室心肌横断面上的分布存在异质性,这种异质性主要是由于中层心肌Cx43表达的明显减少所导致,见表1和图1。
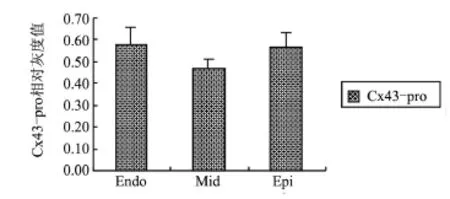
图1 左心室三层心肌间Cx43-pro表达比较
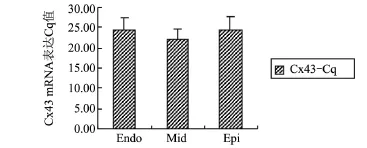
图2 左心室三层心肌间Cx43-Cq表达比较
3 讨 论
MVA通常指持续性室性心动过速、心室扑动、心室颤动等,常常在各种器质性心脏病如心力衰竭、心肌梗死等时发生,是导致心源性猝死(SCD)的急危重心律失常。在中国每年约有数十万人死于SCD,由于MVA的发生较为急剧,预测和治疗存在很大的困难,因此深入探讨其电生理和蛋白分子机制,具有重要的治疗及应用价值。
先前的基础心电生理研究已经证实,心肌不同部位的复极不均一性是MVA发生的重要机制。犬的缺血模型实验结果已经显示,缺血区域心肌的APD较周边的正常心肌明显缩短,导致心肌存在空间上的复极时程差异,这种时程长短的差别可以形成一个闭合的环形折返环[6]。病理条件下,当心肌受到损害刺激而发生电的触发时,电信号将可以通过这个折返环在正常心肌和缺血心肌间不断往返而发生MVA。Wu等[7]的研究进一步证实这种环形的折返途径也可以发生于左心室壁的横断面上,即心内外膜下和中层心肌间。动物研究已经表明,家兔及人的中层心肌APD明显较心内外膜下心肌延长,特别是复极2相和3相延长为主,使其容易发生早期后除极,而且APD长短的不均一必然形成心肌层横断面上的电流梯度,从而可以不断折返而形成MVA。我们的结果也表明,正常家兔左心室三层心肌的APD长短并不一致,存在心室肌内的复极时程离散。
导致中层心肌跨室壁复极离散的蛋白分子机制尚未完全阐明。但是既往的实验结果已证实,Cx43是参与MVA发生的主要蛋白分子,当左心室心肌Cx43蛋白表达减少时,心电的传导速度也明显变慢,表现为心电图的QRS波增宽[8]。另外,Cx43在心肌组织的空间与数量分布上还存在差异,从而增加电生理的不稳定性[9]。因此,Cx43的表达变化是许多病理条件下心电异常的解剖基础。我们的结果还表明,与心内外膜下心肌比较,正常家兔左心室中层心肌的Cx43表达明显减弱(P<0.05),导致左心室心肌存在横断面上的跨室壁Cx43表达不均一,这可能是左心室心电存在跨室壁复极离散的解剖基础。我们推测,在某些病理条件及药物作用下,这种Cx43蛋白的表达不均一性将进一步扩大,继而促使心电的不稳定性增加,尤其是各层心肌间复极时程的差异程度变大,进而容易诱发后除极及壁内折返而发生MVA。
[1]Abi-Gerges N,Valentin JP,Pollard CE.Dog left ventricular midmyocardial myocytes for assessment of drug-induced delayed repolarization:short-term variability and proarrhythmic potential[J].Br J Pharmacol,2010,159(1):77-92.
[2]Wen H,Jiang H,Lu Z,et al.Carvedilol ameliorates the decreases in connexin 43 and ventricular fibrillation threshold in rats with myocardial infarction[J].Tohoku J Exp Med,2009,218(2):121-127.
[3]Strom M,Wan X,Poelzing S,et al.Gap junction heterogeneity as mechanism for electrophysiologically distinct properties across the ventricular wall[J].Am J Physiol Heart Circ Physiol,2010,298(3): H787-794.
[4]Zhong JH,Lu SJ,Chen MS,et al.Effects of hypokalemia on transmural dispersion of ventricular repolarization in left ventricular myocardium[J].Asian Pac J Trop Med,2013,6(6):485-488.
[5]Yamada KA,Kanter EM,Green KG,et al.Transmural distribution of connexins in rodent hearts[J].J Cardiovascu Electrophysiol,2004,15 (6):710-714.
[6]Antzeleritch C.Basic mechanisms of reentrant arrhythmias[J].Curropin Cardiol,2001,16(1):1-7.
[7]Wu J,Zipes DP.Transmural reentry during acute global ischemia and reperfustion in canine ventricular muscle[J].Am J Physiol Heart Circ Physiol,2001,280(6):H2717-2725.
[8]Thomas SA,Schuessler RB,Berul Cl,et al.Disparate effects of deficient expression of comiexin43 on atrial and ventricular conduction: evidence for chamber-specific molecular determinants of conduction [J].Circulation,1998,97(7):686-691.
[9]Boulaksil M,WinckelsSK,Engelen MA,et al.Heterogeneous Connexin43 distribution in heart failure is associated with dispersed conduction and enhanced susceptibility to ventricular arrhythmias[J]. Eur J Heart Fail,2010,12(9):913-921.
Transmural heterogeneity of Cx43 expression in three myocardial layers of rabbit.
ZHONG Jiang-hua1,2,CHEN Xiao-pan2,LU Shi-juan1,HUANG Shan2,HUANG Kang1,ZHANG Wei1,LIU Zheng-wang2.1.Department of Cardiology, the Affiliated Haikou Hospital of Central South University Xiangya School of Medicine,Haikou People's Hospital,Haikou 570208,Hainan,CHINA;2.The Affiliated Hospital of Hainan Medical College,Haikou 570102,Hainan,CHINA
ObjectiveTo observe the change of transmural heterogeneity of connexin 43(Cx43)protein among three myocardial layers and explore physiological mechanisms of malignant ventricular arrhythmia(MVA) in normal rabbit.Methods90%monophasic action potential repolarization duration(APD90),transmural dispersion of repolarization(TDR)and Cx43 protein(Cx43-pro)and mRNA(Cx43-Cq)expression among three myocardial layers were measured in normal rabbit.Results(1)APD90was different among three myocardial layers in normal rabbit,and APD90in the midmyocardium(233.80±19.37)was significantly prolonged than those in the subendocardium(201.20±18.72)and subepicardium(202.70±19.91)(P<0.05),which showed that transmural dispersion of repolarization was existed among three myocardial layers.(2)Compared to those in the subendocardium and subepicardium, Cx43-pro[(0.58±0.08)vs(0.47±0.04)vs(0.57±0.07)]and Cx43-cq[(24.61±2.82)vs(22.18±2.62)vs(24.43±3.31)]expression in the midmyocardium was significantly decreased(P<0.05),which indicated that there was transmural expression heterogeneity of Cx43 protein among three myocardial layers.ConclusionTransmural heterogeneity of Cx43 expression exists among three myocardial layers in rabbit,which may cause dispersion of repolarization.
Rabbit;Malignant ventricular arrhythmia(MVA);Cx43;Dispersion of repolarization;Midmyocardium
R-332
A
1003—6350(2016)04—0517—03
10.3969/j.issn.1003-6350.2016.04.001
2015-10-15)
国家自然科学基金(编号:81160024);海南省自然科学基金(编号:814371)
陆士娟。E-mail:zhong3882@163.com

