XRCC1基因单核苷酸多态性对胃癌卡培他滨联合奥沙利铂化疗敏感性研究
孙慧,陈锦飞,方岳雨,檀心广,崔婷允,吉莲花
(1.南京市浦口区中心医院肿瘤科,江苏 南京 211800;2.南京市第一医院肿瘤科,江苏 南京 211800)
XRCC1基因单核苷酸多态性对胃癌卡培他滨联合奥沙利铂化疗敏感性研究
孙慧1,陈锦飞2,方岳雨1,檀心广1,崔婷允1,吉莲花1
(1.南京市浦口区中心医院肿瘤科,江苏 南京 211800;2.南京市第一医院肿瘤科,江苏 南京 211800)
目的 探讨XRCC1Arg194Trp、Arg399Gln基因单核苷酸多态性对胃癌患者卡培他滨联合奥沙利铂化疗敏感性有无影响。方法选取我院2013年1月至2014年6月经病理确诊晚期胃癌患者86例,采用卡培他滨联合奥沙利铂化疗3个周期后进行临床疗效评价。收集临床资料和外周血标本,利用TaqMan-MGB探针等位基因分型技术对XRCC1Arg194Trp、Arg399Gln进行基因分型,比较不同基因型患者的联合化疗效果。结果86例患者中52例化疗敏感(60.5%);XRCC1Arg194Trp位点,携带Trp(Arg/Trp+Trp/Trp)基因型化疗敏感率为70.8%,Arg/Arg基因型化疗敏感率为47.4%(P=0.027);Trp基因型患者中位TTP为9.48个月,Arg/Arg基因型患者中位TTP为7.36个月(P=0.024);Arg/Arg基因耐药风险显著高于Trp基因(OR:2.84,95%CI:0.772~4.313,P=0.031);XRCC1Arg399/ Arg位点,携带Arg/Arg基因化疗敏感率为72.5%,Gln(Arg/Gln+Gln/Gln)基因型化疗敏感率为42.9%(P=0.007);Arg/Arg基因中位TTP为10.26个月,Gln基因型中位TTP为8.03个月(P=0.012);Gln基因耐药风险显著高于Arg/ Arg基因(OR:4.62,95%CI:1.637~7.201,P=0.012)。结论XRCC1Arg194Trp、Arg 399Gln基因单核苷酸多态性可能与卡培他滨联合奥沙利铂化疗敏感性有关。
XRCC1基因;单核苷酸多态性;卡培他滨;奥沙利铂;化疗;敏感性
胃癌是我国最常见的消化道肿瘤之一,其发病率占全球40%以上。胃癌发现时多数已是中晚期,虽然可以进行手术干预,但是术后复发率高、易转移,所以化疗仍然是中晚期胃癌最重要的治疗手段。卡培他滨联合奥沙利铂的化疗方案已经被广泛运用于胃癌治疗,在临床取得较好疗效。但是部分患者出现耐药现象,为最佳化疗方案的选择带来困惑。有学者提出肿瘤患者对化疗药物耐受可能与自身个体差异有关,寻找到这种差异并以此进行个体化治疗可能对提高患者疗效有帮助[1]。目前已经发现了多种与肿瘤耐药反应相关的多态性基因[2],在药物运转、代谢、肿瘤细胞反应等方面发挥作用。X线修复交叉基因1(XRCC1)是DNA修复基因家族的重要成员,在体内单链断裂修复和碱基切除修复过程中扮演核心角色,其多态性表现可以导致不同个体对DNA修复能力不同,从而影响化疗药物尤其是铂类药物的耐药性[3]。因此本研究选择XRCC1基因Arg194Trp、Arg399Gln位点,以TaqMan-MGB探针法进行基因分型,探讨其单核苷酸多态性(SNPs)与卡培他滨联合奥沙利铂化疗敏感性的关系,以期能够为胃癌患者提供有针对性和可预见性的化疗方案找到依据。
1 资料与方法
1.1 一般资料 收集我院2013年1月至2014年6月收治晚期胃癌患者86例,男性51例,女性35例,年龄29~64岁,中位年龄53岁。所有患者均经过电子胃镜或者手术病理证实,有可以测量病灶,体力状况根据美国东部肿瘤协助组评分标准≤2分,预计生存时间>3个月。患者无心、肝、肾、肺等全身性疾病,心电图、肝肾功、血常规等检查均符合化疗要求,患者及家属知晓本研究的目的、过程、意义,并同意参与。
1.2 化疗方案及疗效评定 采用卡培他滨联合奥沙利铂化疗方案:奥沙利铂:130 mg/m2,静脉滴注2 h,第1天;卡培他滨:1 000 mg/m2,每日早晚各一次,1~14 d;3周为一个周期。化疗期间所有患者均给予5-羟色胺受体拮抗剂类止吐药,不常规预防使用人重组粒细胞集落因子。每周复查血常规两次,每化疗周期前复查肝肾功能、心电图,保证患者每一周期均符合化疗要求。
1.3 疗效评定 3个周期后进行疗效评定。采用国际抗癌联盟实体肿瘤客观疗效标准[4]:完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),CR+PR为敏感。
1.4 方法
1.4.1 基因组DNA提取 患者化疗前收集2 ml EDTA抗凝血备用。使用全血基因组DNA抽提试剂盒(北京艾德莱生物)提取基因组DNA。分光光度仪测定260/280吸光度值,1.6~2.0之间为样本合格,-80℃保存备用。
1.4.2 基因分型 采用TaqMan-MGB SNP基因分型试剂盒(ABI,美国)以及TaqMan-MGB Universal PCR试剂盒(ABI,美国),探针和引物均由美国ABI公司设计合成。PCR反应体系:PCR Master Mix 5µl,40×TaqMan SNPs Genotyping Assay Mix 1µl,基因组DNA(10 ng/µl)1µl,余用dd水补足至10µl。PCR扩增仪(ABI,美国)进行PCR扩增:95℃10 min激活体系内酶,95℃变性15 s,60℃延伸1 min,设定40个循环。使用ABI 7900实时荧光PCR等位基因辨别系统对DNA样本进行分型,不同等位基因根据各自VIC、FAM不同荧光强度被区分。
1.5 统计学方法 采用SPSS13.0软件统计包进行数据分析,采用χ2检验分析不同基因型与化疗效果的关系;采用非条件Logistic回归分析不同基因型耐药风险;采用Kaplan-Meier法分析生存曲线;采用COX比例风险模型分析不同基因型与预后关系。所有检验均以P<0.05为差异有统计学意义。
2 结 果
2.1 基因型分布 86例胃癌患者中,携带XRCC1Arg194Trp基因型患者44例(51.2%),Arg194Arg38例(44.2%),Trp194Trp 4例(4.6%);携带XRCC1Arg 399Gln基因型患者28例(32.6%),Arg399Arg 51例(59.3%),Gln399Gln 7例(8.1%)。分布符合Hardy-Weinberg遗传平衡规律,差异无统计学意义(P>0.05)。表明研究对象具有群体代表性。XRCC1基因表型与患者临床病理参数关系见表1。

表1 XRCC1基因表型与患者临床病理参数关系(例)
2.2 XRCC1Arg194Trp基因型与化疗敏感性关系 86例患者中对卡培他滨联合奥沙利铂化疗敏感患者52例(60.5%)。由于Trp194Trp较少,将Arg194Trp+ Trp194Trp合并分析。结果显示携带Trp(Arg/Trp+Trp/ Trp)基因型患者化疗敏感率为70.8%,携带Arg/Arg基因型患者化疗敏感率为47.4%,而在携带Arg/Arg基因型患者中化疗不敏感率高于Trp基因型,差异有统计学意义(χ2=4.885,P=0.027)。Logistic回归分析发现,Arg/Arg基因型耐药风险明显高于Trp基因型,OR:2.84,95%CI:0.772~4.313,差异有统计学意义(P= 0.031)。194Trp基因可能是胃癌患者卡培他滨联合奥沙利铂化疗的获益基因,见表2。

表2 XRCC1Arg194Trp与化疗敏感性
2.3 XRCC1Arg399Gln基因型与化疗敏感性关系 因为Gln399Gln所占比例少,故将Arg399Gln+ Gln399Gln合并分析。结果显示51例携带Arg/Arg基因型患者中,化疗敏感率可达到72.5%,携带Gln(Arg/ Gln+Gln/Gln)基因型患者化疗敏感率为42.9%,携带Gln基因型患者化疗不敏感率要高于Arg/Arg基因,差异有统计学意义(χ2=7.655,P=0.007)。Logistic回归分析发现,Gln(Arg/Gln+Gln/Gln)基因型耐药风险明显高于Arg/Arg基因型,OR:4.62,95%CI:1.637~7.201,差异有统计学意义(P=0.012)。399Arg/Arg基因可能是卡培他滨联合奥沙利铂化疗的获益基因,见表3。
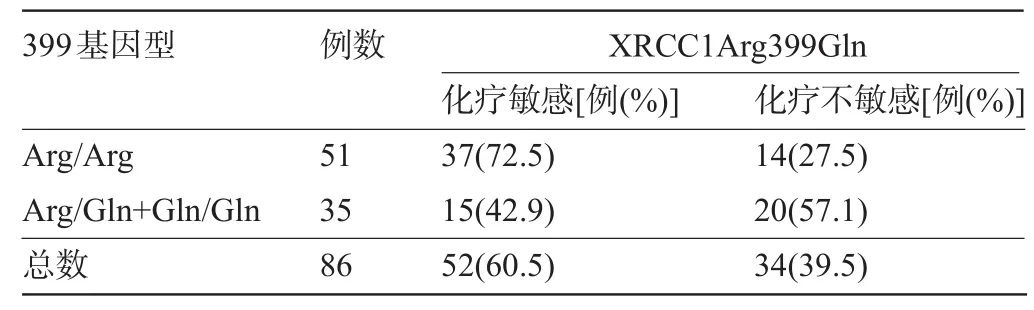
表3 XRCC1Arg399Gln与化疗敏感性
2.4 XRCC1多态性与中位疾病进展时间(TTP)的关系 TTP为治疗开始到肿瘤进展的时间。XRCC1Arg194Trp携带Trp基因型患者中位TTP为9.48个月(95%CI:6.022~10.514),携带Arg/Arg基因型患者中位TTP为7.36个月(95%CI:5.275~8.436),差异有统计学意义(χ2=4.096,P=0.024)。同时COX比例风险模型分析显示XRCC1Arg194Trp基因多态性与TTP显著相关,RR:3.261,95%CI:0.799~5.382,P=0.021。生存曲线见图1。XRCC1Arg399Gln携带Arg/Arg基因型患者中位TTP为10.26个月(95%CI:6.148~11.502),携带Gln基因型患者中位TTP为8.03个月(95%CI:4.657~9.483),χ2=4.925,P=0.012。同时COX比例风险模型分析显示XRCC1Arg194Trp基因多态性与TTP显著相关,RR:4.597,95%CI:0.834~5.971,P= 0.009,生存曲线见图1。
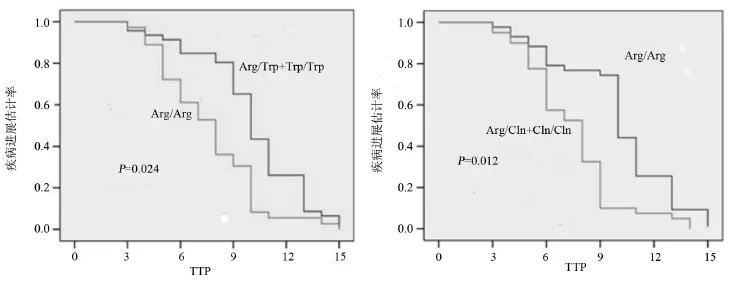
图1 XRCC1基因表型与TTP关系
3 讨 论
随着分子生物学技术取得长足进步,我们可以对胃癌病因、发病机制、治疗效果及预后影响因素进行分子层面的研究。人体细胞中某些基因结构和功能异常可能与胃癌发生、发展、转归有密切关系。DNA修复能力维系基因组的稳定,因此维持高效稳定的DNA修复系统对基因准确表达、细胞功能稳态有非常重要的意义。在人体内,主要包括错配修复、碱基切除修复、核苷酸切除修复等DNA修复系统[4-5]。XRCC1是最早被分离出来的影响细胞对辐射敏感性的哺乳动物基因,在单链断裂修复和碱基切除修复过程中发挥重要作用。XRCC1位于19q13.2~13.3,可以编码633个氨基酸组成的蛋白质作为脚手架蛋白与DNA连接酶Ⅲ、聚合酶β、多聚ADP核糖聚合酶形成复合物,参与到DNA的修复。其遗传突变尤其是单核苷酸多态性与肿瘤发生有密切关系[6]。目前对XRCC1基因多态性的研究主要集中在3个位点:第6外显因子C26304T (Arg194Trp)、第9外显因子G27466A(Arg280His)和第10外显子G28152A(Arg399Gln),这些编码区的多态性表现可能会干扰蛋白质合成,改变基因修复能力,影响肿瘤的易感性和肿瘤细胞生物学行为[7]。XRCC1 SNPs被认为与多种肿瘤的含铂类化疗方案疗效及预后相关[8]。Miao等[9]研究证实XRCC1Arg194Trp基因多态性表现可能会导致患者化疗耐药发生和增加死亡风险。Han等[10]研究发现XRCC1Arg399Gln基因多态性可能会影响非小细胞肺癌对顺铂化疗的敏感性,其含有Arg/Gln和Arg/Arg基因型患者的中位生存时间明显延长。本研究通过基因分型技术对86例晚期胃癌患者XRCC1第194、399位点基因表型进行分析,发现基因多态性可能会影响卡培他滨联合奥沙利铂化疗敏感性。
卡培他滨(Capecitabine)是一种新型口服氟尿嘧啶前体药物,在肿瘤组织中经肿瘤相关性血管因子—胸腺磷酸化酶催化转化为5-氟尿嘧啶(5-FU);奥沙利铂(Oxaliplatin,L-OHP)是第3代铂类抗肿瘤药,主要是通过与肿瘤细胞DNA结合形成铂-DNA加合物,导致链内或链间交联而引起DNA损伤,以达到杀死肿瘤细胞的目的。卡培他滨联合奥沙利铂的化疗方案已经被广泛运用于胃癌治疗,并且在临床取得较好疗效,在一些国家和地区已经成为针对胃癌的一线化疗用药[11-12]。但是在治疗过程中仍然有部分患者出现耐药现象,这可能与XRCC1基因SNPs有关。本研究选取XRCC1第194、399位点为研究对象,对基因SNPs与化疗敏感性关系进行探讨。在XRCC1Arg194Trp基因表型分析中发现,携带Trp(Arg/Trp+Trp/Trp)基因型患者对卡培他滨联合奥沙利铂化疗敏感率为70.8%,显著高于携带Arg/Arg纯合子基因型患者的47.4%,P=0.027,Trp基因型耐药风险也更低(OR:2.84,95%CI:0.772~4.313,P=0.031)。194Trp基因表型可能是胃癌患者应对此化疗方案的受益基因。在预后的分析中,携带Trp基因型患者中位TTP为9.48个月,而携带Arg/Arg纯合子基因型患者为7.36个月,P=0.024,与化疗敏感性结果相符合。本研究结果表明XRCC1Arg194Trp基因SNPs对胃癌患者采取卡培他滨联合奥沙利铂化疗方案敏感性有影响,Trp基因型患者具有较好疗效和预后。
XRCC1Arg399Gln基因多态性被证实与非小细胞肺癌[13]、急性淋巴细胞白血病[14]等恶性肿瘤对以顺铂为基础的化疗方案耐药相关。Xu等[15]对大样本量胃癌患者XRCC1基因多态性与顺铂化疗效果进行Meta分析,发现Arg399Gln基因多态性是肿瘤无进展生存期和存活率的预见性标志物,但是不同基因型对化疗敏感性存在什么样的影响还争议较大,结果得不到统一。本研究结果显示,XRCC1Arg399Gln携带Arg/Arg基因型患者化疗敏感率可达到72.5%,而携带Gln (Arg/Gln+Gln/Gln)基因型患者化疗敏感率为42.9%,P=0.007,Arg/Arg基因型耐药风险更低(OR:4.62,95% CI:1.637~7.201,P=0.012)。399Arg/Arg基因型可能是胃癌患者对卡培他滨联合奥沙利铂化疗的受益基因。在以TTP为指标的预后分析中,携带Arg/Arg纯合子基因型患者中位TTP显著高于Gln基因型患者的中位TTP。与Liu等[16]的报道类似,其研究结果显示携带Arg/Arg或者Arg/Gln基因型的胃癌患者可能会对以奥沙利铂为基础的化疗方案获益。
Wang等[17]对105例以铂类为基础化疗的进展期肺癌患者进行基因SNPs检测,发现XRCC1 194Trp (Arg/Trp+Trp/Trp)基因型化疗敏感性显著高于Arg/ Arg基因型;XRCC1 399Arg/Arg基因型患者化疗效果好于Gln(Arg/Gln+Gln/Gln)基因型,后者的化疗失败风险是前者的3.7倍。本研究在对胃癌患者XRCC1 194、399位点SNPs与卡培他滨联合奥沙利铂化疗敏感性的分析中得到了相同的结果,XRCC1 194Trp、399Arg/Arg基因型可能是该化疗方案的获益基因,有较好的预后。
综上所述,胃癌患者XRCC1Arg194Trp、Arg399Gln基因多态性可能与卡培他滨联合奥沙利铂化疗敏感性有关,对患者化疗用药前进行基因分析,根据基因表型预测个体对药物的敏感性,并以此为依据来选择和优化个体化疗方案,可能会提高临床治疗的针对性和可预见性,使得患者从化疗中获益。
[1]张万林.多靶点靶向治疗的原则及相关进展[J].海南医学,2013,24 (24):3665-3667.
[2]雷俊华,洪涛,曾江正,等.吉西他滨联合顺铂或卡培他滨治疗耐药的晚期乳腺癌的临床价值[J].海南医学,2013,24(15):2197-2199.
[3]Tian Z,Li YL,Liu JG.XRCC1 Arg399Gln polymorphism contributes to increased risk of colorectal cancer in Chinese population[J]. Mol Biol Rep,2013,40(7):4147-4151.
[4]郑磊贞,顾建春,龚继芳,等.候选基因单核苷酸多态性与胃癌患者卡培他滨联合紫杉醇化疗后生存期的关系[J].上海交通大学学报(医学版),2011,31(5):598-603.
[5]Jacobson MD,Burne JF,King MP,et al.Bcl-2 blocks apoptosis in cells lacking mitochondrial DNA[J].Nature,1993,361(6410): 365-369.
[6]Putthanachote N,Promthet S,Suwanrungruan K,et al.XRCC1 gene polymorphism,clinicopathological characteristics and stomach cancer survival in Thailand[J].Asian Pac J Cancer Prev,2015,16(14): 6111-6116.
[7]Kirby TW,Gassman NR,Smith CE,et al.Nuclear localization of the DNA repair scaffold XRCC1:uncovering the functional role of a Bipartite NLS[J].Sci Rep,2015,5:13405.
[8]Ott K,Rachakonda PS,Panzram B,et al.DNA repair gene and MTHFR gene polymorphisms as prognostic markers in locally advanced adenocarcinoma of the esophagus or stomach treated with cisplatin and 5-fluorouracil-based neoadjuvant chemotherapy[J].Ann Surg Oncol,2011,18(9):2688-2698.
[9]Miao J,Zhang X,Tang QL,et al.Prediction value of XRCC 1 gene polymorphism on the survival of ovarian cancer treated by adjuvant chemotherapy[J].Asian Pac J Cancer Prev,2012,13(10):5007-5010.
[10]Han B,Guo Z,Ma Y,et al.Association of GSTP1 and XRCC1 gene polymorphisms with clinical outcome of advanced non-small cell lung cancer patients with cisplatin-based chemotherapy[J].Int J Clin Exp Pathol,2015,8(4):4113-4119.
[11]Mangia A,Caldarola L,Dell′Endice S,et al.The potential predictive role of nuclear NHERF1 expression in advanced gastric cancer patients treated with epirubicin/oxaliplatin/capecitabine first line chemotherapy[J].Cancer Biol Ther,2015,16(8):1140-1147.
[12]Kuo YC,Liu HT,Lin YL,et al.Modified biweekly oxaliplatin and capecitabine for advanced gastric cancer:a retrospective analysis from a medical center[J].Biomed J,2014,37(3):141-146.
[13]Tiseo M,Bordi P,Bortesi B,et al.ERCC1/BRCA1 expression and gene polymorphisms as prognostic and predictive factors in advanced NSCLC treated with or without cisplatin[J].Br J Cancer, 2013,108(8):1695-1703.
[14]Dincer Y,Yüksel S,Batar B,et al.DNA Repair gene polymorphisms and their relation with DNA damage,DNA repair,and total antioxidant capacity in childhood acute lymphoblastic leukemia survivors [J].J Pediatr Hematol Oncol,2015,37(5):344-350.
[15]Xu J,Ma J,Zong HT,et al.Pharmacogenetic role of XRCC1 polymorphisms on the clinical outcome of gastric cancer patients with platinum-based chemotherapy:a systematic review and meta-analysis[J].Genet Mol Res,2014,13(1):1438-1446.
[16]Liu YP,Ling Y,Qi QF,et al.Genetic polymorphisms of ERCC1-118, XRCC1-399 and GSTP1-105 are associated with the clinical outcome of gastric cancer patients receiving oxaliplatin-based adjuvant chemotherapy[J].Mol Med Rep,2013,7(6):1904-1911.
[17]Wang ZH,Miao XP,Tan W,et al.Single nucleotide polymorphisms in XRCC1 and clinical response to platin-based chemotherapy in advanced non-small cell lung cancer[J].Ai Zheng,2004,23(8): 865-868.
Effect of single nucleotide polymorphism of XRCC1 gene on the sensitivity of capecitabine combined with oxaliplatin as first line chemotherapy in gastric cancer patients.
SUN Hui1,CHEN Jin-fei2,FANG Yue-yu1,TAN Xin-guang1,CUI Ting-yun1,JI Lian-hua1.1.Department of Oncology,Nanjing Pukou Central Hospital,Nanjing 211800 Jiangsu,CHINA;2.Department of Oncology,Nanjing First People's Hospital,Nanjing 211800,Jiangsu,CHINA
ObjectiveTo investigate the effect of single nucleotide polymorphism of XRCC1Arg194Trp and Arg399Gln genes on the sensitivity of capecitabine combined with oxaliplatin as first line chemotherapy in patients with gastric cancer.MethodsEighty-six patients pathologically confirmed as advanced gastric cancer in our hospital from Jan.2013 to Jun.2014 were enrolled in the study,which were all treated with capecitabine combined with oxaliplatin chemotherapy.The clinical effects were evaluated after 3 cycles of treatment.The clinical data and peripheral blood samples were collected,and genotyping of XRCC1Arg194Trp and Arg399Gln were performed by using TaqMan-MGB probe.Then the effects of treatment were compared between different genotypes.ResultsAmong the 86 patients,52 (60.5%)were sensitive to chemotherapy.At XRCC1Arg194Trp locus,the patients carrying Trp(Arg/Trp+Trp/Trp)genotype had the sensitivity to chemotherapy of 70.8%,and the patients carrying Arg/Arg genotype had the sensitivity of 47.4%,P=0.027.The median time to progression(TTP)was 9.48 months for patients with Trp genotype and 7.36 months for those with Arg/Arg genotype,P=0.024.The risk of drug resistance for Arg/Arg genotype was significantly higher than that of Trp genotype(OR:2.84,95%CI:0.772~4.313,P=0.031).At XRCC1Arg399/Arg locus,the patients carrying Arg/Arg genotype had the sensitivity of 72.5%,and the patients carrying Gln(Arg/Gln+Gln/Gln)genotype had the sensitivity to chemotherapy of 42.9%,P=0.007.The median TTP was 10.26 months for patients with Arg/Arg genotype and 8.03 months for those with Gln genotype,P=0.012.The risk of drug resistance for Gln genotype was significantly higher than that of Arg/Arg genotype(OR:4.62,95%CI:1.637~7.201,P=0.012).ConclusionSingle nucleotide polymorphism of XRCC1Arg194Trp,Arg399Gln gene maybe associated with the sensitivity of capecitabine combined with oxaliplatin chemotherapy.
XRCC1 gene;Single nucleotide polymorphism;Capecitabine;Oxaliplatin;Chemotherapy;Sensitivity
R735.2
A
1003—6350(2016)04—0526—05
10.3969/j.issn.1003-6350.2016.04.004
2015-09-12)
江苏省南京市医学科技发展项目(编号:YKK14183)
孙慧。E-mail:sunhui20150909@sina.com

