通塞脉片4种入血成分的含量测定*
胡玉梅,杨 彪,房 卉,毕 森,孟兆青,黄文哲,王振中,萧 伟**
(1. 江苏康缘药业股份有限公司 连云港 222001;2. 中药制药过程新技术国家重点实验室 连云港 222001)
通塞脉片4种入血成分的含量测定*
胡玉梅1,2,杨 彪1,2,房 卉1,2,毕 森1,2,孟兆青1,2,黄文哲1,2,王振中1,2,萧 伟1,2**
(1. 江苏康缘药业股份有限公司 连云港 222001;2. 中药制药过程新技术国家重点实验室 连云港 222001)
目的:目的:建立同时测定通塞脉片中绿原酸、毛蕊异黄酮葡萄糖苷、甘草苷、哈巴俄苷4种入血成分的HPLC分析方法,为进一步控制通塞脉片的质量提供参考。方法:采用HPLC-Q-TOF分析大鼠口服通塞脉片后的血中移行成分;结合HPLC测定通塞脉片中主要入血成分的含量。结果:在大鼠含药血浆中,绿原酸、毛蕊异黄酮葡萄糖苷和甘草苷均以原型入血,哈巴俄苷脱去葡萄糖以苷元入血,以绿原酸、毛蕊异黄酮葡萄糖苷、甘草苷和哈巴俄4种成分为指标,建立的含量测定方法线性范围良好,平均加样回收率分别为100.9%、98.68%、98.88%、99.25%。结论:建立的含量测定方法简便可行,回收率和重复性良好,可为进一步控制通塞脉片质量提供参考。
通塞脉片 绿原酸 毛蕊异黄酮葡萄糖苷 哈巴俄苷 甘草苷 含量测定
通塞脉片为江苏康缘阳光药业有限公司的独家品种,由金银花、当归、黄芪、党参、牛膝、石斛、玄参、甘草等8味中药组成,具有培补气血,养阴清热,活血化瘀,通经活络的功效,用于血栓闭塞型脉管炎(脱疽)的毒热症的治疗,功效显著[1-4]。通塞脉片现有标准为国家药品监督管理局颁布的通塞脉片质量标准(试行)(YBZ08372004),其含量测定项只对金银花中的绿原酸进行了质量控制。现有文献仅对该制剂中黄芪甲苷[5,6]、阿魏酸[7]、甘草酸[6]进行了定量研究,未见同时测定多个成分的文献报道。目前,一般认为只有能被吸收入血的成分才有可能是中药及复方的体内直接作用物质[8,9]。但是,迄今为止未见对通塞脉片入血成分进行研究的文献。因此,本实验对通塞脉片的入血成分进行了充分研究,从而确定其质量控制指标,包括绿原酸、毛蕊异黄酮葡萄糖苷、甘草苷以及哈巴俄苷,并建立了同时测定这4种成分的HPLC含量测定方法,为通塞脉片质量控制指标的选择提供了一定的科学依据,并在此基础上提高了通塞脉片的质量标准水平,为保证药品质量的稳定、均一和可控奠定了基础。
1 仪器、试药与动物
1.1 仪器
Aglient 1100 高效液相色谱仪,配备二元泵、DAD 检测器及配套色谱工作站(美国 Aglient公司);Aglient 1290 安捷伦液质联用仪,配备DAD 检测器、Q-TOF 6538 质谱仪及配套色谱工作站(美国Aglient公司);KQ-500型超声波清洗器(昆山市超声仪仪器有限公司);AE240 十万分之一电子分析天平[梅特勒-托利多仪器(上海)有限公司];XW-80A 微型旋涡混合仪(上海沪西分析仪器厂有限公司);Centrifuge 5424高速离心机(德国艾本德公司);EYELA MG-2200 型氮气吹干仪(日本东京理化器械株式会社)。
1.2 试药与动物
绿原酸、甘草苷、哈巴俄苷对照品均购于中国食品药品检定研究院(批号分别为110753-201415、111610-201106、111730-201307),毛蕊异黄酮葡萄糖苷对照品购于成都普菲德生物技术有限公司(批号:140326)。通塞脉片(康缘阳光药业有限公司,批号分别为130613、130807、130808、131020、131111)。甲醇、磷酸(分析纯,南京化学试剂有限公司);甲酸(分析纯,天津市科密欧化学试剂有限公司);羧甲基纤维素钠(分析纯,国药集团化学试剂有限公司);乙腈(色谱纯,美国天地公司),超纯水(Milli-Q 制备)。
SD 雄性大鼠,SPF 级,体质量180-220 g,购于上海杰思捷实验动物有限公司,许可证号:SCXK(沪)2013-0006。
2 方法与结果
2.1 入血成分确认
2.1.1 给药及血浆样品处理方法
SD 大鼠(雌雄各4只),按雌雄随机分成2组,给药组按 6.6 g·kg-1剂量灌胃给药通塞脉片灌胃液,给药3天,每天2次;空白组灌胃等体积的蒸馏水,于最后一次给药(灌胃前禁食12 h)后15、30、60、120、180、240 min 采取大鼠眼内眦静脉丛血,肝素钠抗凝,将血样合并,4 000 r·min-1离心10 min,取上清液血浆1 mL加入4 mL甲醇涡旋30 s,12 000 r·min-1离心5 min,转移上清液,40 ℃氮气吹干,残渣加入100 μL 80%甲醇溶解,12 000 r·min-1离心5 min,取上清液待测。空白血浆处理方法同给药血浆。
2.1.2 灌胃液的制备
取通塞脉片(批号:131020)适量,研细,用0.5%羧甲基纤维素钠溶液配制成1 mL含制剂0.66 g的混悬液。
2.1.3 LC-MS分析条件
Agilent ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为0.1% 甲酸(A)-乙腈(B),梯度洗脱:0 -10 min,5% B;15 min,8% B ;25-32 min,14% B;35-45 min,15% B;75 min,32% B;90 min,60% B;95 min,60% B;105 min,100% B,后运行10 min;柱温30 ℃;流速1.0 mL.min-1,进样量2 μL。
电喷雾离子源(ESI),负离子模式检测;干燥气温度:350℃;干燥气流量:10 L·min-1;雾化气压力:10.0 psi;毛细管电压:(-)4 500 V;Fragmentor:135 V,skimmer:65 V;扫描范围:m/z 100-1 500 amu。
2.1.4 入血成分鉴定
将空白血样、给药血样按照 “2.1.3 ”项下条件进行测定,结果见图 1-2,根据对照品对照确定tR=22.775 色谱峰为绿原酸、tR=34.152 色谱峰为毛蕊异黄酮葡萄糖苷、tR=37.672 色谱峰为甘草苷,3个化合物均以原型成分的形式吸收入血,推测哈巴俄苷脱去葡萄糖以苷元(tR=73.754)吸收入血。
2.2 入血相关成分的含量测定
2.2.1 对照品溶液的配制
精密称取干燥至恒重的绿原酸、毛蕊异黄酮葡萄糖苷、甘草苷、哈巴俄苷对照品各10.49、3.25、12.02和4.05 mg置20 mL具塞三角瓶中,加入80%甲醇溶液少许,超声溶解,放冷后,用甲醇溶液定容至刻度,摇匀,得混合对照品贮备液,再精密移取1 mL贮备液置25 mL量瓶中,80%甲醇溶液定容至刻度,即得混合对照品溶液。
2.2.2 供试品的制备
取通塞脉片20片,除去薄膜衣,精密称取0.7 g,精密称定,置25 mL 量瓶中,加入80% 甲醇适量,超声1 h(工作频率40 kHz,功率500 W),放至室温,定容,摇匀,离心5 min(12 000 r·min-1),取上清液,即得。
2.2.3 液相色谱条件
Agilent Extend C18色谱柱(250 mm×4.6 mm,5 μm);流动相:0.2% 磷酸溶液(A)-乙腈(B);梯度洗脱:0-10 min,5% B;15 min,8% B ;25-32 min,14% B;35-45 min,15% B;75 min,32% B; 90 min ,60% B;95 min,60% B;100 min,100% B,后运行10 min;柱温为30 ℃;检测波长为327 nm(检测绿原酸)、260 nm(检测毛蕊异黄酮葡萄糖苷)、276 nm(检测哈巴俄苷)、237 nm(检测甘草苷)[10-13];柱温30 ℃;流速1.0 mL·min-1,进样量10 μL。
2.2.4 专属性试验
按处方比例制备不含金银花、黄芪、玄参、甘草的阴性制剂样品,按“2.2.2”项下的方法分别制备制剂供试品溶液和阴性制剂溶液,按“2.2.3”项下条件测定,得HPLC色谱图。结果表明,阴性制剂对所测成分无干扰,4个成分峰的理论塔板数不低于6 000,与相邻峰的分离度均大于1.5,见图3。
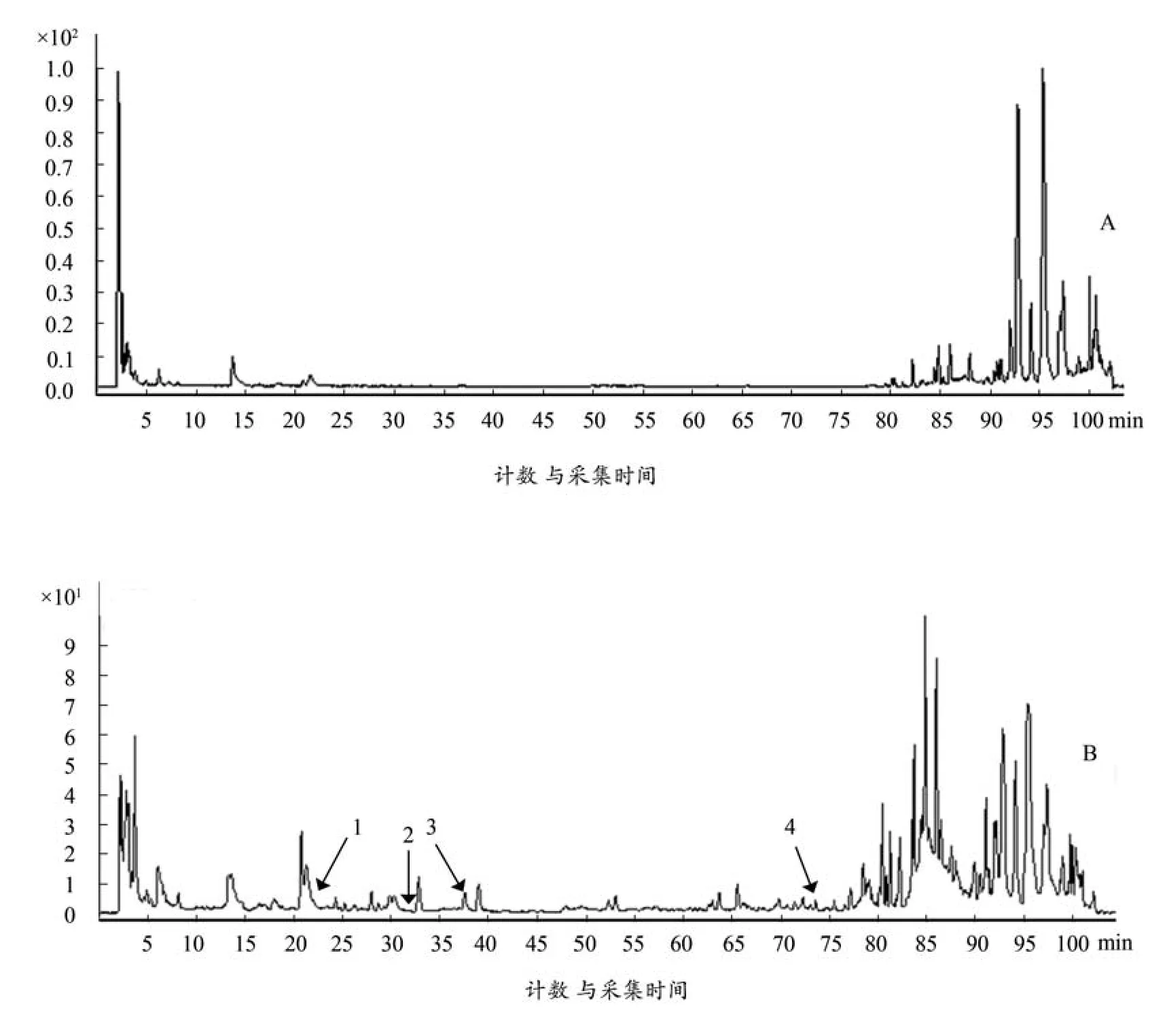
图1 空白血样(A)和给药血样(B)的总离子流图
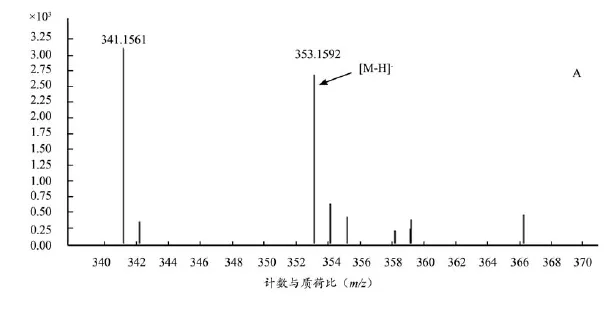
图2 4个入血相关成分质谱图
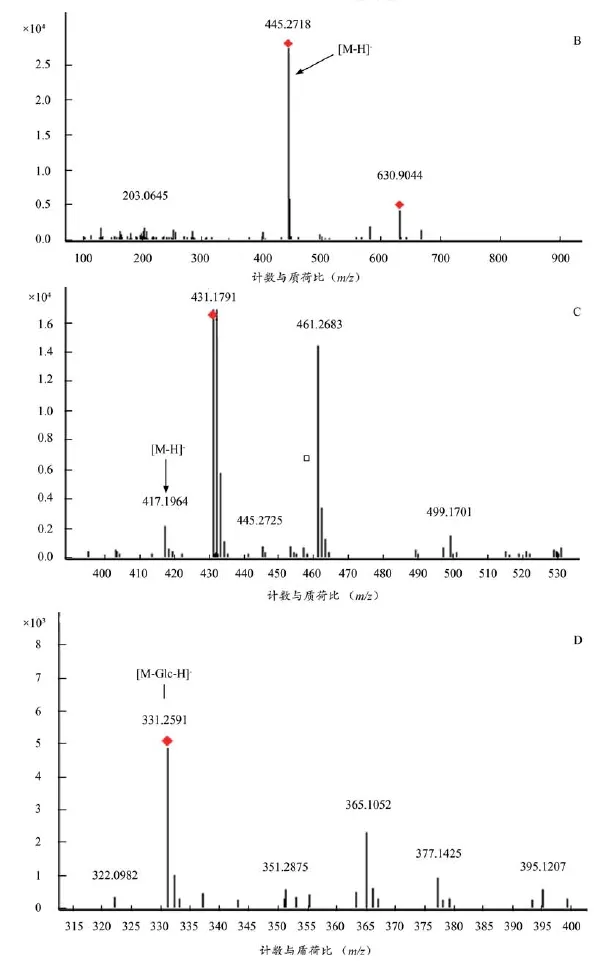
续图2 4个入血相关成分质谱图

图3 混合对照品(A)、阴性制剂(B)及通塞脉片(批号:130613)(C)的HPLC色谱图(260 nm)
2.2.5 线性关系考察
精密吸取混合对照品贮备溶液分别稀释5、10、12.5、25、50倍,得到一系列不同浓度的混合对照品溶液,分别吸取上述不同浓度的对照品溶液各10 μL,按“2.2.3”项下色谱条件测定,以峰面积(Y)与对照品进样量(μg)进行回归。结果表明,4个成分线性关系良好(r>0.999 5),回归方程、线性范围和相关系数见表 1。
2.2.6 精密度试验
精密吸取混合对照品溶液连续进样5次,记录峰面积并计算5 次峰面积的RSD。结果显示,绿原酸、毛蕊异黄酮葡萄糖苷、甘草苷、哈巴俄苷的峰面积的RSD分别为0.25%、0.35%、0.30%、0.28%,表明仪器精密度良好。
2.2.7 稳定性试验
取通塞脉片(批号:130613),按“2.2.2”项下方法制备供试品溶液,分别于0、4、8、12、24 h进样10 μL测定各成分的峰面积。结果显示,绿原酸、毛蕊异黄酮葡萄糖苷、甘草苷、哈巴俄苷的峰面积RSD分别为1.5%、2.7%、2.1%、1.9%,表明样品在24 h内稳定性良好。
2.2.8 重复性试验
取通塞脉片(批号:130613),平行6份,按“2.2.2”项下方法制备供试品溶液,精密吸取供试品10 μL进样,记录峰面积,计算含量。结果显示,绿原酸、毛蕊异黄酮葡萄糖苷、甘草苷、哈巴俄苷含量的RSD分别为2.0%、1.6%、1.3%、1.5%,表明该方法重复性良好。
2.2.9 加样回收率试验
精密称取已知含量的通塞脉片(批号130613),共9份,精密加入混合对照品贮备液1.2、1.2、1.2、1.0、1.0、1.0、0.8、0.8、0.8 mL,按“2.2.2”项下方法制备供试品溶液,进样10 μL,记录峰面积,计算回收率。结果显示,绿原酸、毛蕊异黄酮葡萄糖苷、甘草苷、哈巴俄苷的平均回收率分别为100.9%、98.68%、98.88%、99.25%,RSD分 别 为 1.1%、2.5%、2.0%、1.8% 。
2.2.10 含量测定
分别取5批通塞脉片,按“2.3.2”项下方法制备供试品溶液,每批平行3份,每份进样2次,按“2.3.3”项下的色谱条件对绿原酸、毛蕊异黄酮葡萄糖苷、甘草苷、哈巴俄苷进行含量测定,结果见表2。
3 结论
3.1 大鼠给药方式的选择
比较单次给药与多次给药(连续给药3天,每日2次)的血中移行成分,LC-MS分析结果表明,多次给药后样品出峰稳定,且峰的数目较多,故采用多次给药。
3.2 供试品提取方法的考察
分别采用回流法和超声2种提取方式进行提取,结果2种方法的提取率基本一致,由于超声波法简单省时,故本实验采用超声波法;同时考察了溶媒和超声时间以及超声次数的影响,选用100%甲醇、80% 甲醇、50% 甲醇、蒸馏水4个溶剂进行提取,在0.5、1、1.5 h分别提取1次、2次。结果显示:80% 甲醇提取1次超声1 h 时,4个组分即可完全溶出。
3.3 含测指标的选择
中药复方制剂的质量控制方法通常以其中所含的某一类成分来定量,或者选择其中1-2个指标成分来定量,近年来也有采用指纹图谱来控制产品的真实性、药材质量的一致性及稳定性[9]。本实验以入血成分为参考,建立HPLC 多波长同时测定通塞脉片中4个入血相关成分绿原酸、毛蕊异黄酮葡萄糖苷、甘草苷、哈巴俄苷的含量,4个化合物分别是其组成药材金银花、黄芪、甘草和玄参的主要活性成分。现代药理研究表明,绿原酸通过清除氧自由基及抗脂质过氧化,可保护血管内皮细胞,进而对心血管系统产生有效的保护作用[14];毛蕊异黄酮葡萄糖苷具有免疫调节、抗损伤、抑制动脉粥样硬化等活性[15];甘草苷对大鼠动脉粥样硬化具有治疗作用,其作用机制可能是通过抑制炎症和氧化应激反应[16],同时甘草苷可通过降低髓过氧化物酶(Myeloperoxidase,MPO)活性及细胞间黏附因子-1(Intercellular Adhesion Molecule-1,ICAM-1)表达减轻脑缺血再灌注后炎症反应,从而发挥其抗脑缺血再灌注损伤作用[17];哈巴俄苷具有抗慢性炎症、降压、镇痛及免疫促进作用[18]。该HPLC含量测定方法重复性好,准确简便,可以更有效地控制通塞脉片制剂的质量,同时也为中药复方制剂的质量控制提供新的研究方法。
3.4 后续研究思路
后续研究将进一步对入血成分进行药理活性验证,明确入血成分与药效的相关性,为功效相关质控标准的建立奠定基础。
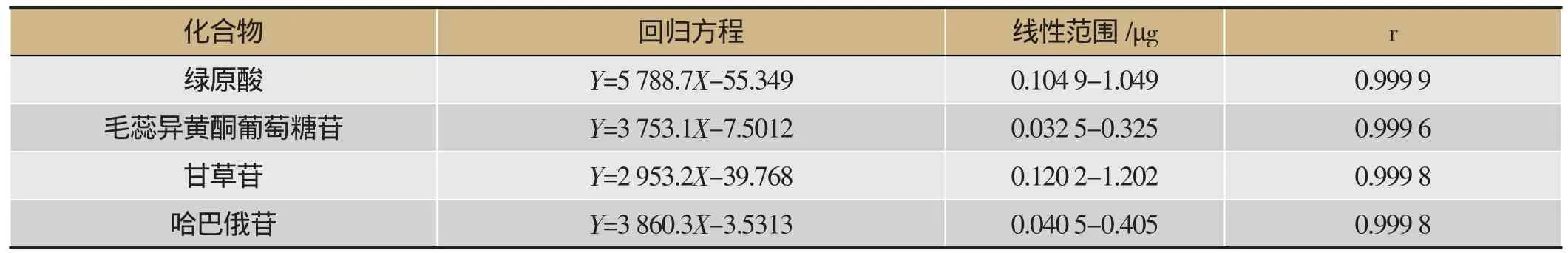
表1 4种对照品的回归方程、线性范围和相关系数
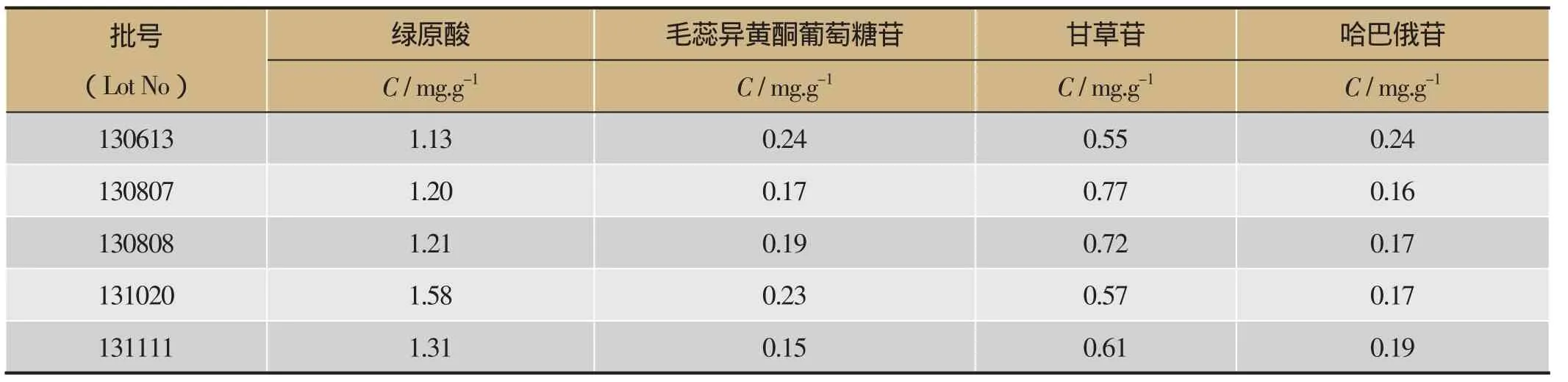
表2 通塞脉片中4中成分含量测定(n=3)
参考文献
1 顾锡镇. 通塞脉片治疗急性缺血性中风30例.南京中医药大学学报,2004,20(2): 83-84,117.
2 高学敏.通塞脉片临床应用概述.北京中医,2003,22(1): 64-65.
3 殷书梅,王丽英,牛金茹,等.通塞脉片治疗缺血性中风的药效学研究.新中医,2007,39(2): 104-107.
4 万继峰,程玉娟,徐云,等. 通塞脉片结合西医常规治疗脑梗死后并发下肢深静脉血栓形成疗效分析.上海中医药杂志,2012,46(2): 41-43.
5 张莉,狄留庆,赵晓莉,等. 高效液相色谱法测定通塞脉片中黄芪甲苷的含量. 南京中医药大学学报,2003,19(2): 94-95.
6 张妤琳,龚丽,郭青.通塞脉片质量标准研究.中成药,2013.35(7): 1568-1573.
7 陈锦容.通塞脉片中阿魏酸的含量测定. 海峡药学,2009,21(8) : 60-61.
8 王喜军.中药及中药复方的血清药物化学研究.世界科学技术-中药现代化,2002,4(4): 1-4.
9 马春涛,雷燕.中药复方效应物质基础的研究进展及展望.中国实验方剂学杂志,2003,9(3): 46-49.
10 李伟东,徐斌,狄留庆,等.RP-HPLC法测定通塞脉微片不同拆方浸膏中绿原酸的含量. 南京中医药大学学报,2003,19(1): 32-33.
11 石子仪,鲍忠,姜勇,等.不同来源黄芪药材中毛蕊异黄酮葡萄糖苷和芒柄花素的定量分析. 中国中药杂志,2007,32(9): 799-783.
12 陶金华,狄留庆,文红梅,等.RP-HPLC 双波长梯度洗脱法同时测定通塞脉微丸中阿魏酸、甘草素、肉桂酸、哈巴俄苷的含量.现代中药研究与实践,2010,34(2): 66-69.
13 刘向南,李明珠,尚晓娜,等.“一测多评”法测定甘草中6种有效成分含量.中国实验方剂学杂志,2013,19(24): 56-59 .
14 刘颖,郭明晔,白根本.绿原酸的研究进展.中药材,2012,35(7): 1180-1185.
15 张蔷,高文远;满淑丽.黄芪中有效成分药理活性的研究进展.中国中药杂志,2012,37(12): 3203-3207.
16 朱有胜,褚俊.甘草苷对大鼠动脉粥样硬化的作用及机制.广东医药,2015,36(3): 365-368.
17 孙雅煊,刘婷,戴雪伶.甘草苷抗脑缺血再灌注炎性损伤研究.食品科学, 2010,31(23): 353-355.
18 师怡,许晖,阙慧卿.玄参化学成分的药理作用和分析方法.海峡药学,2006,18(4): 58-61.
Study on the Quality Standard of Tongsaimai Tablet by Determining Four Representative Components Absorbed into Blood
Hu Yumei1,2,Yang Biao1,2,Fang Hui1,2,Bi Sen1,2,Meng Zhaoqing1,2,Huang Wenzhe1,2,
Wang Zhenzhong1,2,Xiao Wei1,2(1. Jiangsu Kanion Parmaceutical Co.,Ltd.,Lianyungang 222001,China; 2. State Key Laboratory of New-Tech for Chinese Medicine Pharmaceutical Process,Lianyungang 222001,China)
This study aimed to establish the HPLC analysis method for determining four representative components,chlorogenic acid,calycisin glyciside,liquiritin and harpagoside,simultaneously,which provided references for the quality control study of the Tongsaimai (TSM) tablet. HPLC-Q-TOF technique was applied to determine the components in the blood after the administration of TSM table extract. In this process,HPLC was used for detection of the ingredients' content of the blood sample. It was found that chlorogenic acid,calycisin glycoside and liquiritin migrated into the blood as prototype forms,while harpagoside into the blood by the form of aglycone. The linear range of the four compounds was favorable,and the average recoveries were 100.9%,98.68%,98.88% and 99.25%,respectively. It was concluded that the HPLC technique was simple and feasible with good reproducibility,which could be used for quality control of TSM tablet.
Tongsaimai tablet,chlorogenic acid,calycosin-7-O-β-D-glycoside,liquiritin, harpagoside,quantitative determination
10.11842/wst.2016.05.029
R285
A
(责任编辑:马雅静,责任译审:朱黎婷)
2015-07-02
修回日期:2015-12-18
* 科学技术部“重大新药创制”科技重大专项(2013ZX09402203):现代中药创新集群与数字制药技术平台,负责人:王振中。
** 通讯作者:萧 伟,本刊编委,研究员级高级工程师,博士,主要研究方向:中药新药的研究与开发。

