微波辅助萃取法提取玄参中哈巴苷和哈巴俄苷的工艺研究
傅 亚,范 佳,陈 芳,杨荣萍,张景勍,姚 波*
1 重庆科技学院,重庆 401331;2 重庆中药研究院,重庆 400065;3 重庆医科大学药学院,重庆 400016
中药玄参(Figwort Root,Radix Scrophulariae)为玄参科植物玄参(Scrophularia ningpoensis Hemsl)的干燥根,具有清热凉血,滋阴降火,解毒散结的功效[1]。天然药物化学研究发现,玄参主要含有环烯醚萜类、苯丙素苷、糖类、肉桂酸、皂苷等[2,3]。近年对其主要化学成分环烯醚萜类研究较多,哈巴苷与哈巴俄苷是环烯醚萜苷类中两个主要的成分[4,5],经研究发现,这两种成分具有抗慢性炎症、降压、镇痛以及免疫促进的作用,因此将哈巴苷与哈巴俄苷作为玄参的特征性成分[6,7]。
微波辅助萃取技术是近年来发展迅速的中药有效成分提取技术,与传统的中药活性成分提取技术相比,具有简便、快速高效、选择性强、能耗少和环境污染小等优点[8],已广泛应用于黄酮、多糖和生物碱等有效成分的提取[9]。
本研究设计单因素实验和正交实验,利用微波辅助萃取法提取玄参中的哈巴苷与哈巴俄苷,采用HPLC 测定哈巴苷和哈巴俄苷的含量,通过对乙醇浓度、料液比、微波温度、微波时间和微波功率因素的考察,筛选出微波提取玄参中哈巴苷与哈巴俄苷的最佳工艺条件。
1 材料与仪器
1.1 材料与试剂
玄参(采自重庆南川玄参GAP 基地);哈巴苷(四川,成都曼斯特生物科技有限公司,批号MUST-13121902,纯度≥98%)及哈巴俄苷(四川,成都曼斯特生物科技有限公司,批号MUST-11071801,纯度≥98%);乙腈、甲醇(HPLC Grade,Honeywell Burdick & Jackson);乙醇、磷酸(AR,Honeywell Burdick &Jackson)。
1.2 仪器
岛津LC-20AT 高效液相色谱仪(日本岛津公司);X101 型微波催化合成/萃取仪(北京详鹄科技有限公司);旋转蒸发仪RE-2000A(上海亚荣生化仪器厂);DZF-6020 真空干燥箱(上海齐欣科学仪器有限公司);BosChrom ODS 色谱柱(250 mm×4.6 mm,5 μm);KH-250 型超声波清洗器(昆山禾创超声仪器有限公司);DZF-6020 真空干燥箱(上海齐欣科学仪器有限公司);SHZ-95B 循环水真空泵(巩义市予华仪器有限责任公司);FA2104B 电子天平(上海越平科学仪器有限公司)。
2 实验方法
2.1 原料预处理
玄参根块50 ℃干燥后,粉碎,过70 目筛,备用。
2.2 哈巴苷和哈巴俄苷的测定
哈巴苷和哈巴俄苷的HPLC 测定方法参照中国药典2010 版[10],色谱柱:BosChrom ODS(250mm×4.6 mm,5 μm),流动相:乙腈(A)-0.03%磷酸(B),梯度洗脱:0~10 min,3%~10%(A);10~20 min,10%~33%(A);20~25 min,33%~50%(A);25~30 min,50%~80%(A);30~35 min,80%(A);35~37 min,80%~3%(A),流速:1.0 mL/min,检测波长:210 nm,进样量:20 μL,柱温为常温。
2.3 玄参哈巴苷和哈巴俄苷的微波提取工艺
将玄参药材清洗除杂,晾干,粉碎,取已粉碎玄参药材5.0 g,加入一定量的溶剂作为萃取剂,在控制设置条件下,微波萃取,抽滤,恒温干燥,温度控制在60 ℃左右,取干燥样品约0.5 g,精密加入50%甲醇50 mL 密封,备用。
2.4 单因素实验
2.4.1 乙醇浓度对玄参哈巴苷和哈巴俄苷提取率的影响
称取玄参粉末约5 g,微波辅助提取玄参中的哈巴苷和哈巴俄苷,在微波功率为600 W、提取时间为35 min、料液比为1∶20、微波温度为50 ℃的条件下,分别选择不同浓度的乙醇0、20%、40%、60%、80%进行单因素试验,得到哈巴苷、哈巴俄苷和总苷的提取率。
2.4.2 料液比对玄参哈巴苷和哈巴俄苷提取率的影响
称取玄参粉末约5 g,微波辅助提取玄参中的哈巴苷和哈巴俄苷,在微波功率为600 W、提取时间为35 min、乙醇浓度为40%、微波温度为50 ℃的条件下,分别选择不同的料液比1∶10、1∶15、1∶20、1∶25、1∶30 进行单因素试验,得到哈巴苷、哈巴俄苷和总苷的提取率。
2.4.3 微波温度对玄参哈巴苷与哈巴俄苷提取率的影响
称取玄参粉末约5 g,微波辅助提取玄参中的哈巴苷和哈巴俄苷,在微波功率为600 W、料液比为1∶20、乙醇浓度为40%、提取时间35 min 的条件下,分别选择不同的微波温度为30、40、50、60、70 ℃进行单因素试验,得到哈巴苷、哈巴俄苷和总苷的提取率。
2.4.4 微波时间对玄参哈巴苷与哈巴俄苷提取率的影响
称取玄参粉末约5 g,微波辅助提取玄参中的哈巴苷和哈巴俄苷,在微波温度为50 ℃、料液比为1∶20、乙醇浓度为40%、微波功率为600 W 的条件下,分别选择不同的微波时间20、25、30、35、40 min进行单因素试验,得到哈巴苷、哈巴俄苷和总苷的提取率。
2.4.5 微波功率对玄参哈巴苷与哈巴俄苷提取率的影响
称取玄参粉末约5 g,微波辅助提取玄参中的哈巴苷和哈巴俄苷,在微波温度为50 ℃、料液比为1∶20、乙醇浓度为40%、提取时间35 min 的条件下,分别选择不同的微波功率为500、600、700、800、900 W 进行单因素试验,得到哈巴苷、哈巴俄苷和总苷的提取率。
2.5 正交实验
在上述单因素实验基础上,采用L9(34)正交实验进一步分析乙醇浓度、微波温度、微波功率、微波时间对玄参哈巴苷和哈巴俄苷总提取率的影响,优化哈巴苷和哈巴俄苷的微波提取工艺。表1 为优化实验因素及因素所取水平。
2.6 玄参提取率的计算
根据标准工作曲线,按下式分别求出哈巴苷与哈巴俄苷浓度、提取率及总提取率:
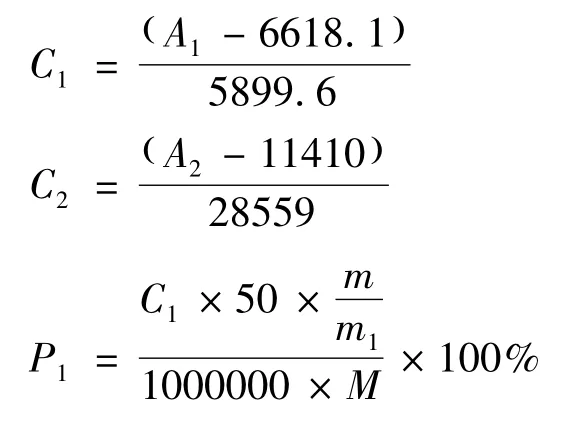

表1 优化实验因素及因素所取水平Table 1 Factors and levels of orthogonal experiment
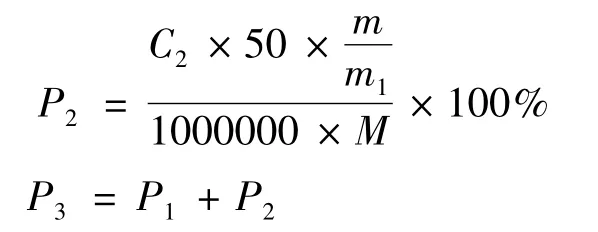
式中:C1-哈巴苷的浓度,μg/mL;C2-哈巴俄苷的浓度,μg/mL;A1-哈巴苷的峰面积,mv;A2-哈巴俄苷的峰面积,mv;P1-哈巴苷的提取率,%;P2-哈巴俄苷的提取率,%;P3-哈巴苷和哈巴俄苷的总提取率,%;m-玄参提取液的干燥物质量,g;m1-用于测定的干燥物质量,g;M-玄参药材的质量,g。
3 实验结果
3.1 样品中哈巴苷和哈巴俄苷的HPLC 测定
取不同浓度的哈巴苷与哈巴俄苷对照品进样,记录高效液相色谱图中哈巴苷与哈巴俄苷的峰面积(见图1A),建立哈巴苷和哈巴俄苷的标准曲线和回归方程:哈巴苷线性回归方程:Y=5899.6X+6618.1,R2=0.9998;哈巴俄苷线性回归方程:Y=28559X+11410,R2=0.9997。哈巴苷与哈巴俄苷分别在15~240 μg/mL 和5~80 μg/mL 范围内具有良好的线性关系。
取哈巴苷与哈巴俄苷对照品,分别连续进样5 次进行精密度测定,分别计算平均峰面积,算出相对标准偏差,结果哈巴苷的RSD 为1.07%,哈巴俄苷的RSD为0.94%,都低于2%,表明该仪器的精密度良好。
取5 份已知样品浓度的提取液0.5 mL,将已知浓度的哈巴苷与哈巴俄苷混合对照品分别按0.5、1.0、1.5、2.0、2.5 mL 分别加入到5 份样品中,定溶在10 mL 的容量瓶中进行回收率实验,得到峰面积,换算浓度,计算回收率,得到哈巴苷的平均回收率为99.10%,RSD 为1.80%;哈巴俄苷的平均回收率为98.20%,RSD 为1.70%。
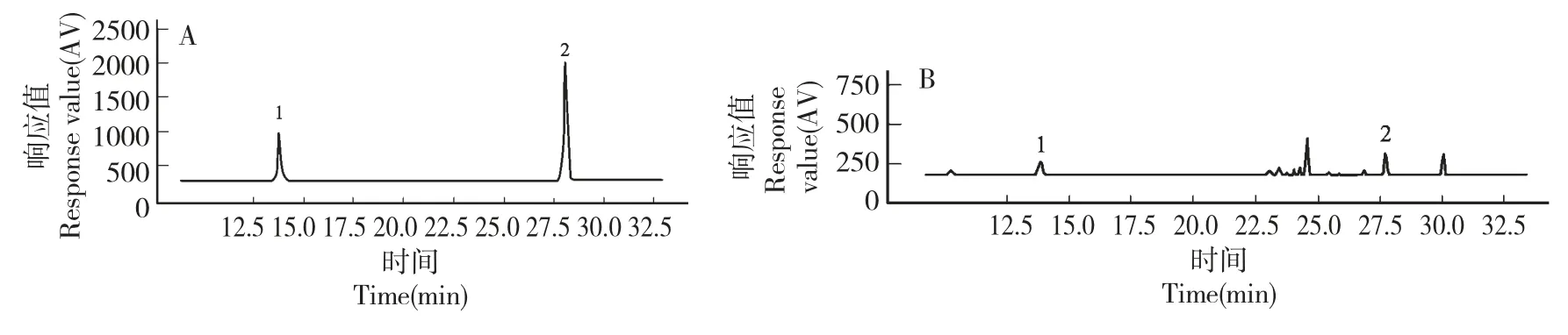
图1 混合标准品(A)、玄参样品(B)的HPLC 色谱图Fig.1 HPLC chromatograms of reference substance(A)and Radix Scrophulariae sample(B)
3.2 单因素实验
3.2.1 乙醇浓度对玄参哈巴苷和哈巴俄苷提取率的影响
实验结果显示(见图2A):当溶剂为纯水时玄参哈巴苷的提取率最高,哈巴俄苷的提取率最低,在其他实验条件不变的情况下,随着乙醇浓度的增大,哈巴苷的提取率降低,哈巴俄苷的提取率升高。因为,一方面乙醇浓度的变化会使溶剂的极性发生改变,使得哈巴苷和哈巴俄苷及玄参中其他成分的溶出率随之改变,之所以哈巴俄苷提取率仍然在升高,可能是哈巴俄苷的极性较小;另一方面可以直接观察到玄参提取液呈黑色,可能因为该色素在乙醇中的溶出很大,抑制了哈巴苷的溶出,但是哈巴俄苷未受影响。由于总苷的提取率是在溶剂为纯水时最高,所以选择纯水做溶剂较宜。
3.2.2 料液比对玄参哈巴苷和哈巴俄苷提取率的影响
实验结果表明(见图2B):在其他实验条件不变的情况下,随着料液比的增加,测得玄参哈巴苷及哈巴俄苷的提取率均升高,且均在料液比1∶20 后随料液比升高提取率无明显变化。这是因为刚开始料液比小时,随着料液比增大,两相浓度差增大,传质速度加快的较为明显,即玄参提取率增加幅度大。继续增大料液比,但传质动力增加不大,所以提取率增加不明显,考虑节约成本,所以选择相对较小的料液比1∶20 更合理。
3.2.3 微波温度对玄参哈巴苷与哈巴俄苷提取率的影响
实验结果可知(见图2C):在其他实验条件不变的情况下,随着温度的增大,测得玄参哈巴苷及哈巴俄苷的提取率均升高,当温度为50 ℃达到最高,继续增大温度总提取率反而降低。这是由于温度有助于传质过程,使分子扩散运动更激烈,加快溶质的扩散和溶剂的渗透,但随着温度升高,杂质溶解速度也显著加快,与哈巴苷和哈巴俄苷形成竞争,干扰其浸出速率,导致哈巴苷和哈巴俄苷的提取率降低。因此微波温度选择50 ℃为宜。
3.2.4 微波时间对玄参哈巴苷与哈巴俄苷提取率的影响
实验结果表明(见图2D):在其他实验条件不变的情况下,随着微波提取时间延长,测得玄参哈巴苷和哈巴俄苷的提取率升高,哈巴苷的提取率在30 min 时达到最高,哈巴俄苷的提取率在25 min 时达到最高,继续延长提取时间总提取率反而降低。这是由于微波时间越长,对细胞膜的破坏作用越大,溶出的哈巴苷和哈巴俄苷越多,但是过于延长微波提取时间,一方面,细胞膜的破坏程度过大,其他杂质的溶出也会增加,抑制哈巴苷及哈巴俄苷的溶出;另一方面,辐射时间过长可能导致有效成分被破坏,因而提取率降低。又由于总苷的提取率在30 min 时最高,因此微波时间选择30 min 为宜。
3.2.5 微波功率对玄参哈巴苷与哈巴俄苷提取率的影响
实验结果显示(见图2E):在其他实验条件不变的情况下,随着功率的增大,玄参哈巴苷及哈巴俄苷的提取率均升高,当在600 W 的时候达到最高,继续增大功率总提取率反而降低。分析原因,因为微波功率越大时,物料吸收的微波能越多,细胞破坏程度越大,哈巴苷及哈巴俄苷溶出越多。但微波功率过大,一方面更多的易于被溶剂吸附的物质溶出,降低了哈巴苷及哈巴俄溶出率;另一方面,功率过高易使溶剂暴沸,促使溶剂挥发,降低哈巴苷和哈巴俄苷的提取率。因此微波功率选择600 W 为宜。
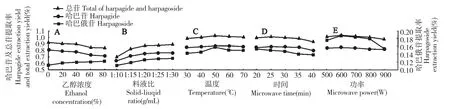
图2 乙醇浓度(A)、料液比(B)、温度(C)、时间(D)、功率(E)对提取率的影响Fig.2 Effect of ethanol concentration(A),solid-liquid ratio(B),temperature(C),microwave time(D)and microwave power(E)on extraction yield
3.3 玄参哈巴苷和哈巴俄苷提取优化实验研究
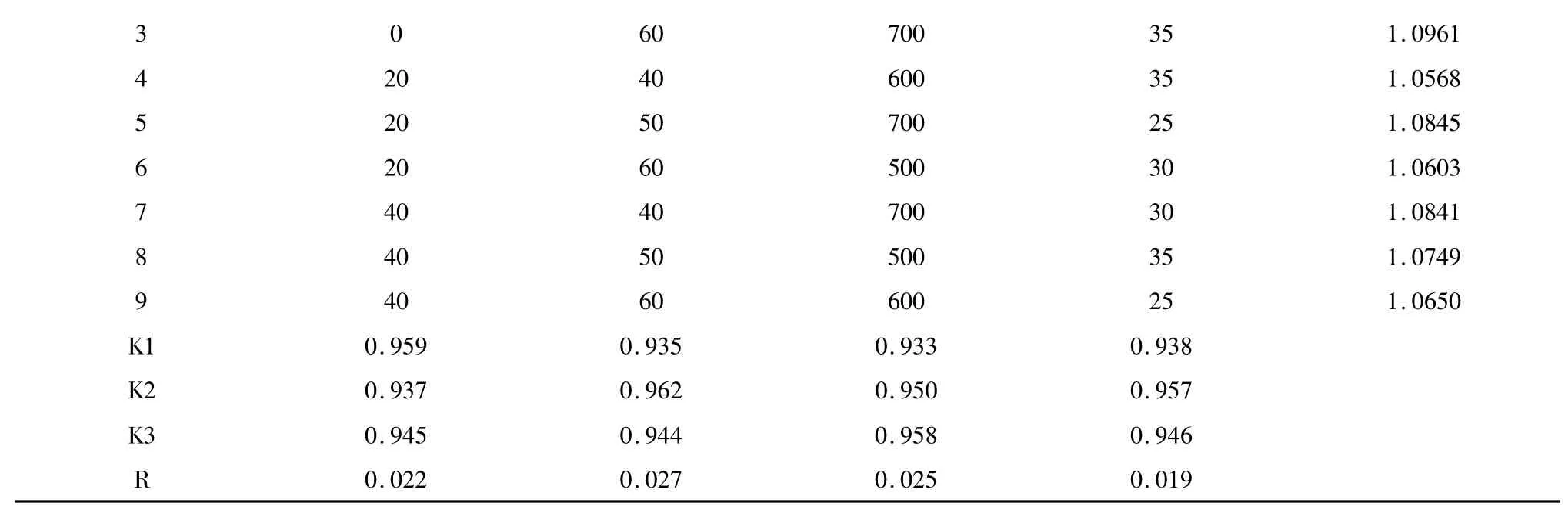
通过设计L9(34)正交实验发现,影响玄参哈巴苷和哈巴俄苷总提取率因素的主次顺序为微波温度>微波功率>乙醇浓度>微波时间,最佳水平为A1B2C2D2,即最优提取工艺参数为微波温度50℃,微波功率为600 W,乙醇浓度0%,微波时间30 min,料液比1∶20。在此最佳工艺条件下玄参哈巴苷和哈巴俄苷的总提取率为1.1172%。
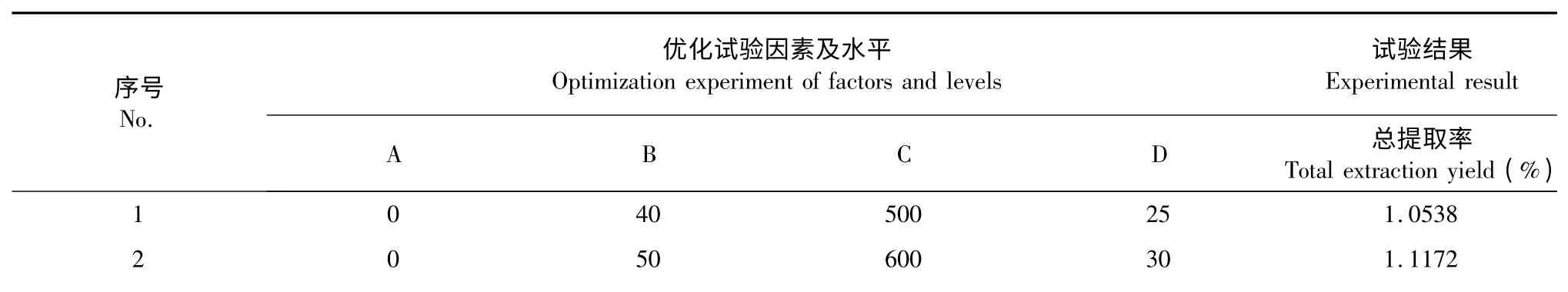
表2 正交方案设计及结果Table 2 Orthogonal experiment design and result
3.4 微波辅助提取法与直接加热水提法的比较
以微波辅助提取最佳条件与直接加热水提法进行比较,结果如表3。
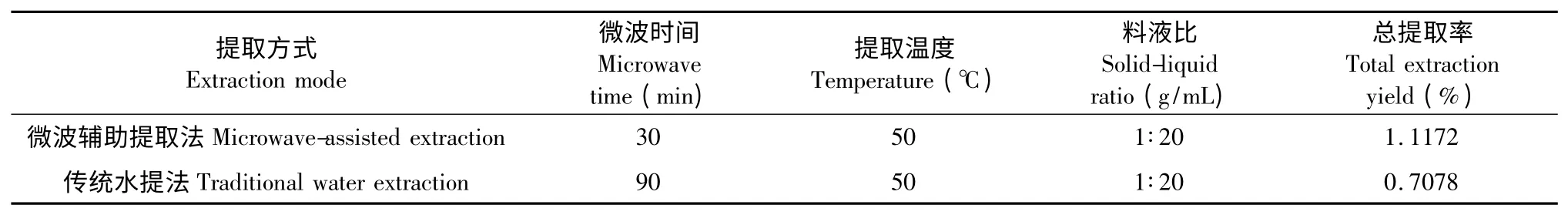
表3 微波辅助提取法与传统水提法结果对比Table 3 Comparison of microwave-assisted extraction method with traditional water extraction method
由上述结果可见,微波辅助提取法与直接水提法相比,具有缩短提取时间,提高哈巴苷和哈巴俄苷总提取效率的明显优势。
4 结论
由单因素及正交实验考察可知,微波提取玄参哈巴苷和哈巴俄苷的最佳提取工艺条件为:纯水提取、微波温度50 ℃,微波功率为600 W,微波时间30 min,料液比1∶20。此工艺条件下玄参哈巴苷和哈巴俄苷的总提取率为1.1172%。微波辅助提取法比直接水提法更加省时,提取率更高。
1 Huang MM(黄萌萌),Qiao JJ(乔娟娟),Qiu YL(邱亚玲),et al.Optimal extraction of main constituent from Radix Scrophulariae based on response surface methodology.Pharm Clin Res(药学与临床研究),2014,22:34-38.
2 Li Y(李媛),Song BA(宋宝安),Yang S(杨松),et al.Chemical constituents of Scrophularia ningpoensis Hemsl.Nat Prod Res Dev(天然产物研究与开发),2012,24:47-51.
3 Gao XM(高学敏).Traditional Chinese Medicine(中药学).Beijing:China Press of Traditional Chinese Medicine,2002.168-169.
4 Geu-Flores F,Sherden NH,Courdavault V,et al.An alterna-tive route to cyclic terpenes by reductive cyclization in iridoid biosynthesis.Nature,2012,492:138-142.
5 Gong YL(龚友兰),Yu SH(余三红),Yi ZX(易钊旭),et al.Bibliometric analysis of research of Scrophularia pharmaceutical 2002-2012.Chin J Lib Infor Sci Tradit Chin Med(中国中医药图书情报杂志),2014,38:21-23.
6 Zhang ZQ(张召强),Li M(李明).玄参的化学成分及药理作用的研究进展.Guide Chin Med(中国医药指南),2013,11(26):49-51.
7 Gong YL(龚友兰),Pan QH(潘琦虹),Xiang DX(向大雄).Advances in studies on iridoids in plants of Scrophularia L and their bioactivity.Nat Prod Res Dev(天然产物研究与开发),2012,24:406-413.
8 Li GK(李攻科),Du FY(杜甫佑),Xiao XH(肖小华).Application of microwave assisted extraction in the modernization of Chinese traditional medicine.Fine Chem(精细化工),2007,24:1184-1191.
9 Cao HB(曹洪斌),Shen JM(申金明),Chen HL(陈莲惠).Application of microwave extraction in Chinese traditional medicine.Guangzhou Chem(广州化学),2013,38:72-76.
10 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2010.108-109.
- 天然产物研究与开发的其它文章
- Endophytic Fungi from Nicotiana tabacum L.and Their Antibacterial Activity
- Optim ization of Supercritical CO2 Extraction of Tricholoma matsutake EssentialOil via a Response Surface M ethod and Its Chem ical Com position Analysis
- 衰老机制及延缓衰老活性物质研究进展
- 连花清瘟胶囊原料药的化学成分研究
- ‘糊烟’净油提取与精制工艺研究及成分分析
- 响应面法对青稞红曲中两种Monacolin K 的提取工艺优化

