胃癌手术后出院患者早期行肠内营养干预对其营养指标的影响
苍玉珍,曾青山,黄文静
(广州市第一人民医院营养科,广东 广州 510180)
胃癌手术后出院患者早期行肠内营养干预对其营养指标的影响
苍玉珍,曾青山,黄文静
(广州市第一人民医院营养科,广东 广州 510180)
目的 分析早期肠内营养支持对胃癌术后出院患者营养指标及其恢复的影响。方法随机抽取2011年5月至2015年4于我院择期行胃癌根治术治疗的74例患者作为研究对象,按住院顺序编号,以随机数字表法分为A、B两组,每组各37例。A组胃癌术后早期作家庭肠内营养干预,B组未给予家庭肠内营养支持,比较两组患者术后胃肠道指标的恢复情况,以及出院前后不同时间段患者血清前蛋白(PA)、白蛋白(ALB)、免疫球蛋白(IgG、IgA、IgM)、血红蛋白(Hb)及白细胞计数(WBC)等指标的变化,同时比较两组患者的体质量(BW)、并发症和出院后生活质量改善情况。结果出院3周后,A组患者的PA、ALB、HGB、BW分别上升至(0.25±0.06)g/L、(38.65±3.84)g/L、(93.21±10.41)g/L、(65.06±10.44)kg,IgG、IgA分别上升至为(13.01±1.81)g/L、(4.11±0.97)g/L,分别与B组比较,差异均有统计学意义(P<0.05);A组患者出院3周KPS评分为(86.86±5.94)分,明显高于B组的(80.36±2.78)分,差异均有统计学意义(P<0.05);A、B组患者术后并发症发生率分别为13.51%(5/37)、18.92%(7/37),差异无统计学意义(P>0.05)。结论采用早期家庭肠内营养支持干预胃癌术后出院患者,可改善患者出院后营养指标、免疫水平,改善其术后生活质量,且安全性高。
胃癌;肠内营养;干预;营养指标;恢复
胃癌为消化道常见恶性肿瘤,大部分患者营养状态差、免疫功能低下,加上手术刺激,其机体分解代谢增加,免疫抑制加重,对其术后恢复产生影响[1],而术后早期营养支持则为改善胃癌术后患者预后的关键途径。以往术后早期营养支持多采用肠外营养干预,但较多研究认为其对患者免疫功能及肝功能均可能造成不同程度的影响,多建议采用早期肠内营养支持配合术后家庭营养支持[2]。因此,为探讨胃癌术后出院患者家庭肠内营养支持的应用价值,我院对收治的74例患者展开了随机对照研究,现报道如下:
1 资料与方法
1.1 一般资料 选取2011年5月至2015年4月于我院择期行胃癌根治术治疗的74例患者作为研究对象。纳入标准:①病理组织确诊为胃癌,择期行胃癌根治术;②年龄≥18岁;③术前肠功能正常,有体质量下降表现;④知情且自愿参与研究。排除标准:①合并代谢性及内分泌疾病者;②术前接受肿瘤化疗及激素治疗者;③合并严重肝、肾、心功能障碍者;④无法耐受手术者。按住院顺序编号,随机分为A、B两组,每组37例。A组男性23例,女性14例;年龄36~81岁,平均(65.6±9.5)岁;病理类型:腺癌33例,黏液癌1例,小细胞癌1例,未分化癌2例。B组男性24例,女性13例;年龄38~80岁,平均(64.9±10.2)岁;病理类型:腺癌32例,黏液癌2例,小细胞癌2例,未分化癌1例。两组患者的性别、年龄、病理资料比较差异均无统计学意义(P>0.05),具有可比性。
1.2 方法 两组患者的术前、术后处理一致。常规补液、镇痛,作肠内营养支持,术前备好肠内营养管,术后放入十二指肠降部远端5~10 cm处。术后常规放置胃肠道减压管,静脉给予氨基酸、葡萄糖、脂肪乳、维生素等,热量为30 kcal/(kg·d),液体量为50 mL/(kg·d),术后首日给予所需热量的1/3,次日给全量。术后第一天起经空肠鼻饲给予500 mL葡萄糖+氯化钠溶液,第二天鼻饲500 mL百普力,根据患者耐受度逐渐增量,不足者经外周静脉补液,术后1周停止静脉营养。A组出院前,由家庭营养支持小组对家属作家庭肠内营养支持培训,包括营养管维护、使用,营养液配置及方法等。出院前作家庭肠内营养支持,评定患者营养状态,制定个性化家庭营养支持方案,非劳动强者日需给入热量25 kcal/(kg·d),纯体力劳动者为35 kcal/(kg·d),需从事体力劳动者30 kcal/(kg·d)。本组所有患者术后1个月均不能从事体力劳动,但可能存在营养不良,设定热量为25~30 kcal/(kg·d),热氮比150:1,液体总量2 000~3 000 mL/d,营养管留置至术后3周。出院时由家庭营养小组制定家庭肠内营养方案,出院后3 d、1周、3周严格随访。B组则不给予家庭肠内营养支持。
1.3 检测方法 两组患者均于出院前、出院3周后清晨抽取肘静脉血液3 mL,抗凝后送检,测定其血清前蛋白(PA)、白蛋白(ALB)、血红蛋白(Hb),测定体质量(BW)等营养指标的改善,监测免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、白细胞计数(WBC)等免疫指标的变化。
1.4 观察指标与评价方法 采用卡式功能状态评分表(KPS)[3]评估患者出院后恢复情况,总分0~100分,得分越高,表示健康状况越好,治疗后较治疗前增加超过10分为改善,较治疗前减少超过10分为降低,变化在10分范围内表示稳定;记录两组患者出院3周并发症发生率。
1.5 统计学方法 应用SPSS19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者出院前和出院3周营养指标比较 出院前,两组患者的营养指标比较差异均无统计学意义(P>0.05),出院3周后,A组PA、ALB、Hb、BW均上升,且高于B组,差异有统计学意义(P<0.05),见表1。
2.2 两组患者出院前和出院3周免疫指标比较 出院前,两组患者的免疫指标比较差异均无统计学意义(P>0.05),出院3周后,A组患者的IgG、IgA均上升,且明显高于B组,差异均有统计学意义(P<0.05),但IgM、WBC比较差异均无统计学意义(P>0.05),见表2。
2.3 两组患者出院前和出院3周的KPS评分比较 两组患者出院前的KPS评分比较差异无统计学意义(P>0.05),出院3周,A组患者的KPS评分明显高于B组,差异有统计学意义(P<0.05),见表3。
2.4 两组患者的并发症比较 两组患者术后并发症发生率相近[13.51%(5/37)vs 18.92%(7/37)],组间比较差异无统计学意义(χ2=0.397,P>0.05),见表4。
表1 两组患者出院前和出院3周营养指标比较(±s)

表1 两组患者出院前和出院3周营养指标比较(±s)
组别A组(n=37) B组(n=37) t值P值PA(g/L) ALB(g/L) Hb(g/L) BW(kg)出院前0.18±0.05 0.18±0.06 0.000>0.05出院3周0.25±0.06 0.18±0.05 5.451<0.05出院前34.36±2.12 33.26±3.58 1.608>0.05出院3周38.65±3.84 34.59±4.72 4.058<0.05出院前89.32±12.21 88.41±11.28 0.332>0.05出院3周93.21±10.41 89.39±4.65 2.038<0.05出院前62.91±11.21 58.72±8.65 1.799>0.05出院3周65.06±10.44 57.32±8.26 3.536<0.05
表2 两组患者出院前和出院3周的免疫指标比较(±s)

表2 两组患者出院前和出院3周的免疫指标比较(±s)
组别IgA(g/L) IgM(g/L) WBC(×109/L) A组(n=37) B组(n=37) t值P值IgG(g/L)出院前9.81±2.34 9.83±2.32 0.036>0.05出院3周13.01±1.81 10.12±2.14 6.272<0.05出院前2.40±1.44 2.39±1.07 0.033>0.05出院3周4.11±0.97 3.28±1.52 2.799<0.05出院前1.72±0.44 1.72±0.45 0.000>0.05出院3周1.75±0.57 1.74±0.53 0.078>0.05出院前12.22±3.26 11.92±4.12 0.347>0.05出院3周7.14±2.62 6.82±2.54 0.533>0.05
表3 两组患者出院前和出院3周的KPS评分比较(分,±s)
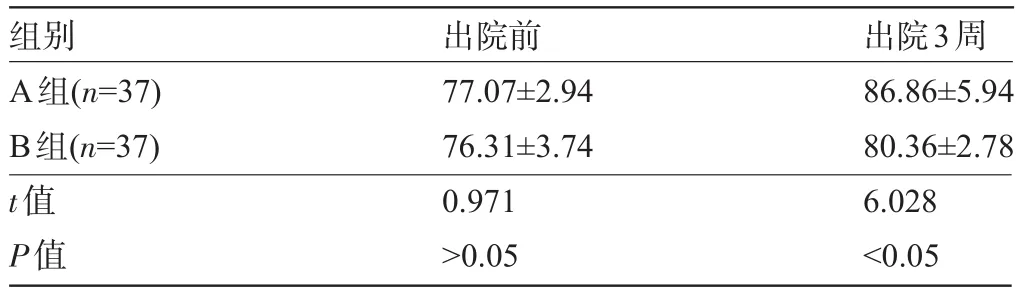
表3 两组患者出院前和出院3周的KPS评分比较(分,±s)
组别A组(n=37) B组(n=37) t值P值出院前77.07±2.94 76.31±3.74 0.971>0.05出院3周86.86±5.94 80.36±2.78 6.028<0.05

表4 两组患者的并发症比较(例)
3 讨 论
胃癌为临床常见恶性肿瘤,患者多预后差,死亡率高[4]。且受到胃部生理作用的影响,大部分胃癌患者多伴不同程度营养不良表现。手术是其主要治疗方案,但一般接受胃癌手术的患者多存在吻合口,加之手术创伤、刺激,破坏患者正常消化道,引起非生理性变化[5]。同时患者术后需配合禁水禁食,营养水平降低,术后胃肠道功能恢复速度较慢,且短时间内无法经吻合口快速进食,进一步加重营养不良,同时多伴进行性体重下降表现[6]。虽目前已广泛应用Y形吻合技术,确保食物可直接进入空肠,但可能影响胃肠道激素分泌及吸收,仅配合术后饮食指导无法从根本上解决患者术后营养不良表现[7]。且胃癌患者术后营养不良可进一步导致患者生活质量降低,影响其预后[8],因此必须重视胃癌患者术后营养状况的改善,使之获取有效的营养支持。
家庭肠内营养是胃癌术后患者出院后常用营养支持方案,主要通过专业营养支持小组指导,使患者出院后可在家庭内实施肠内营养支持干预,多适应于胃肠道有其功能,但经口服摄入无法满足正常营养需求,且可耐受出院家庭营养支持的患者[9]。家庭营养支持自20世纪70年代起在美国开展,后续大量研究证实其可缩短患者住院时间,节约患者医疗资源,改善患者生活质量[10]。营养支持包括肠外、肠内营养支持两种,前者主要以静脉直接输入营养液为主,其对营养液配置、输注过程无菌要求高,易并发高血糖、静脉炎、低血压等并发症,且要求高于肠内营养,因此短期开展难度大。相较来说,家庭肠内营养支持操作简单,营养液可选择种类多,且其组成与正常饮食接近,副作用低,安全性高[11]。研究认为,肠内营养支持不仅可维持患者肠道黏膜及功能的完整性,同时可恢复患者生物、化学、机械、免疫屏障功能,防止细菌入侵,且肠内营养主要经静脉吸收传输至肝脏内部,代谢符合人体生理特征,可促进蛋白质合成及代谢[12]。
早期对胃癌患者营养支持的研究多集中于肠内外营养支持优势对比方面,仅少部分关注患者出院后营养支持问题[13]。本研究中A组所有患者均接受家庭肠内营养支持,在患者住院期间建立肠内营养支持,同时对患者家属作护理培训,告知营养液配置方法,输注调节,常见问题处理方法等,确保患者在出院后可正常接受家庭肠内营养支持,满足其日常营养需求。B组则未给予家庭肠内营养支持,结果证实,A组患者出院3周后,前蛋白、白蛋白、血红蛋白及体重等营养指标均明显上升,改善幅度显著高于B组,且患者免疫指标IgG、IgA上升幅度均高于B组,同时A组患者术后KPS功能评分明显高于B组,两组比较差异有统计学意义(P<0.05),且A、B两组出院后并发症发生率差异无统计学意义(P>0.05),证实了家庭肠内营养支持在胃癌术后出院患者中应用的安全性,与早期报道结论基本一致[14]。
综上所述,在胃癌术后出院患者的干预中,采用家庭肠内营养支持方式,可改善患者出院后营养水平,优化患者机体免疫能力,改善患者术后生活质量,且并发症发生率低,安全性高,值得临床推广。
[1]刘昭晖,苏国强,张思宇,等.老年胃癌术后早期营养支持方式临床研究[J].中华胃肠外科杂志,2013,16(11):1063-1066.
[2]王宏星,李建平.胃癌术后八珍汤加减辅助肠内营养对生长激素、营养状况及免疫功能的影响[J].中国中西医结合杂志,2011,31 (10):1317-1321.
[3]伍红艳,刘国恩.生命质量量表不同计分方法对评价结果的影响[J].中国卫生经济,2013,32(8):66-67.
[4]耿勇,周波.胃癌术后患者早期肠内营养支持的临床价值[J].现代肿瘤医学,2012,20(10):2127-2129.
[5]曹节勤,石海燕,刘文瑞,等.免疫增强型肠内营养制剂在胃癌术后病人辅助化疗中的作用[J].肠外与肠内营养,2015,22(1):20-21, 25.
[6]肖冰.老年胃癌术后应用肠内营养管胃肠减压的疗效[J].中国老年学杂志,2014,34(7):1942-1943.
[7]陈洁生.四君子汤联合肠内营养支持促进胃癌术后恢复临床研究[J].吉林中医药,2013,33(4):383-385.
[8]王峰,邬瑞,董培德,等.老年胃癌术后早期营养支持78例临床分析[J].中国老年学杂志,2011,31(16):3184-3185.
[9]魏海龙,林振海.不同营养方式对胃癌术后患者康复的影响[J].海南医学,2012,23(18):44-45.
[10]王静东,郭倩,王琦三,等.胃癌术后早期瑞素肠内营养对患者机体营养状况的影响[J].武警医学院学报,2011,20(9):716-719,722.
[11]朱信强,张明,丁闯,等.老年胃癌术后早期联合肠内营养的临床观察[J].胃肠病学和肝病学杂志,2013,22(1):43-45.
[12]张红星,范熙明,刘晓刚,等.胃癌术后早期不同营养支持方式的应用价值比较[J].中国老年学杂志,2013,33(10):2411-2412.
[13]孙元水,钱振渊,许晓东,等.胃癌术后辅助化疗期间肠内营养对患者免疫及营养状况的影响[J].中华临床营养杂志,2012,20(2): 84-87.
[14]应伟青,李斌,卢庆华,等.胃癌术后早期肠内营养治疗对患者营养恢复的影响[J].热带医学杂志,2013,13(1):64-67.
Effect of early enteral nutrition intervention on nutritional indexes of discharged patients with gastric cancer after surgery.
CANG Yu-zhen,ZENG Qing-shan,HUANG Wen-jing.Department of Nutrition,the First People's Hospital of Guangzhou,Guangzhou 510180,Guangdong,CHINA
ObjectiveTo analyze the effects of early enteral nutrition intervention on nutritional indexes and recovery in discharged patients with gastric cancer after surgery.MethodsSeventy-four patients who underwent radical gastrectomy in our hospital from May 2011 to April 2015 were selected as the study subjects.According to the order of admission,they were divided into group A and group B by the random number table,with 37 patients in each group. Group A was given early home enteral nutrition intervention after operation,while group B was not given home enteral nutrition support.The postoperative recovery of gastrointestinal indexes,changes of serum pre-albumin(PA),albumin (ALB),immunoglobulin(IgG,IgA,IgM),hemoglobin(Hb)and white blood cell count(WBC)were compared between the two groups in different time periods before and after discharge.Body weight(BW),incidence of complications and improvement of quality of life after discharge were compared between the two groups.ResultsAt 3 weeks after discharge,PA,ALB,HGB and BW in group A were increased to(0.25±0.06)g/L,(38.65±3.84)g/L,(93.21±10.41)g/L and (65.06±10.44)kg,respectively,and IgG and IgA were increased to(13.01±1.81)g/L and(4.11±0.97)g/L,respectively, all showing statistically significant differences with those in group B(P<0.05).The KPS score of group A at 3 weeks after discharge was significantly higher than that of group B,(86.86±5.94)vs(80.36±2.78),P<0.05.The incidence of postoperative complications in group A and group B were 13.51%and 18.92%,respectively,with no statistically significant differences(P>0.05).ConclusionUsing early home enteral nutrition intervention in discharged patients with gastric cancer after operation can improve the nutritional indexes,immune level and the postoperative quality of life,with good safety.
Gastric cancer;Enteral nutrition;Intervention;Nutritional indexes;Recovery
R735.2
A
1003—6350(2016)19—3170—03
10.3969/j.issn.1003-6350.2016.19.025
2016-04-06)
广州医科大学第三附属医院2014年博士启动科研项目(编号:2014Y03)
苍玉珍。E-mai:cyzz667@163.com

