ALK基因在肝细胞癌中的表达及临床意义
贾守薇邵琼吴小延曹利龙子君邵建永黄红兵
作者单位:510060 广州 广州中山大学肿瘤防治中心1药学部,2分子诊断科;3华南肿瘤学国家重点实验室;4肿瘤医学协同创新中心
临床研究
ALK基因在肝细胞癌中的表达及临床意义
贾守薇1,3,4邵琼2,3,4吴小延2,3,4曹利1,3,4龙子君1,3,4邵建永2,3,4黄红兵1,3,4
作者单位:510060 广州 广州中山大学肿瘤防治中心1药学部,2分子诊断科;3华南肿瘤学国家重点实验室;4肿瘤医学协同创新中心
目的探讨间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因在肝细胞癌(hepatocellular carcinoma,HCC)组织中的表达及其临床意义。方法采用荧光原位杂交法(fluorescent in situ hybridization,FISH)检测ALK在213例HCC组织中的表达,并分析其与患者临床病理特征及预后的相关性。结果213例HCC中无ALK基因重排阳性,28例存在ALK基因拷贝数增加(ALK gene copy number gain,ALK-CNG)现象。ALK-CNG阳性表达与HCC患者年龄、性别、AJCC分期、Child-Pugh评分及复发情况均无明显相关性(P>0.05),与HCC患者预后相关(P=0.048),晚期患者中ALKCNG阳性组与阴性组的无进展生存率差异有统计学意义(P=0.007)。单变量和多变量Cox回归分析显示,ALK-CNG阳性是HCC患者的独立预后预测指标(P=0.046)。结论HCC患者ALK基因重排阳性少见,但存在ALK基因拷贝数增加现象,且可能是影响HCC患者预后的不良因素。
肝肿瘤;间变性淋巴瘤激酶(ALK);荧光原位杂交法;临床意义
肝细胞癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤,位居肿瘤相关死亡的第3位[1],在我国90%以上的原发性肝癌为HCC,手术切除是重要治疗手段,但仅30%~40%的患者有手术指征[2]。除手术切除外,还有肝移植、经导管动脉内化疗栓塞、局部放疗等治疗方式,但HCC致死率仍较高[3-4]。多靶点酪氨酸激酶抑制剂索拉非尼被批准用于治疗无法手术或远处转移的HCC[5-6],为分子靶向治疗晚期HCC开启了新时代,而寻找预测治疗反应的生物标志物,筛选靶向治疗的优势人群成为分子靶向研究的重点。
间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)最早在间变性大细胞淋巴瘤细胞株中被发现,属于胰岛素受体家族,人类正常ALK基因包含了受体酪氨酸激酶的经典结构,即细胞外配体结合区、跨膜区及细胞内酪氨酸激酶区[7]。已证实ALK基因异常改变存在于多种肿瘤中,如非小细胞肺癌(non-small cell lung cancer,NSCLC)、间变性大细胞淋巴瘤、横纹肌肉瘤、炎症性肌纤维母细胞瘤、神经母细胞瘤等[8-9]。其异常形式主要包括基因融合、基因突变、基因扩增及蛋白表达增加,其中以基因融合最为常见。ALK基因能与NPM-、EML4-、TMP2-、KIF5B-等多种基因发生重排融合。鉴于ALK抑制剂克唑替尼在治疗NSCLC的临床研究中取得良好效果[10-12],EML4-ALK融合基因成为NSCLC发生发展中重要的分子靶点。本研究旨在通过检测213例HCC组织中ALK基因的表达情况,分析其与临床病理特征及预后的关系,以期为HCC的个体化治疗提供依据。
1 资料与方法
1.1 临床资料
选取1999年1月至2004年8月于中山大学肿瘤防治中心手术切除的213例HCC组织,所有组织均为患者确诊的活检组织标本。经组织病理学确诊为HCC,临床随访资料完整,临床分期采用国际抗癌联盟AJCC分期。剔除因其他疾病或意外死亡的患者。本研究经中山大学肿瘤防治中心伦理委员会同意。
1.2 荧光原位杂交法
组织蜡块以3~5 μm厚度连续切片,65°C烤片3 h;二甲苯室温脱蜡,每次5 min,共3次;100%、85%、70%梯度乙醇复水各2 min,浸入去离子水3 min。将组织切片浸入EDTA缓冲液20 min,2×柠檬酸钠缓冲液(SSC)中漂洗2次,每次5 min;再浸泡于蛋白酶K工作液,37°C下孵育20~25 min;浸入10%中性福尔马林溶液固定10 min,2×SSC溶液中漂洗2次,每次5 min;然后依次置于70%、85%、100%乙醇梯度脱水,每缸3 min;室温自然干燥玻片。将杂交缓冲液7 μL、去离子水2 μL和探针1 μL混匀加到微量离心管,将探针混合物均匀滴于玻片杂交区域,置于原位杂交仪,调出相应程序。将组织切片置于2×SSC溶液中,再于2×SSC/0.1%乙基苯基聚乙二醇(NP-40)溶液中洗涤5 min;室温浸泡于70%、85%、100%乙醇各3 min后取出,暗处自然干燥玻片。将DAPI复染液均匀滴加在杂交区域位置,荧光显微镜观察结果。
1.3 ALK-FISH阳性结果判定
荧光原位杂交结果判定采用双盲法,由2名对病例资料完全不知情的病理科医生对结果进行判定。双色探针分别用Spectrum Orange和Spectrum Green标记位于2号染色体的ALK基因断点两侧的DNA片段,在激发光波长下分别呈红色和绿色荧光信号。无ALK基因转位时,因两个探针位置靠近,可表现为一个叠加而成的黄色信号或互相靠在一起的红色和绿色荧光信号。当发生ALK基因断裂时,Spectrum Orange随ALK基因转位到其他染色体,两个探针分开,表现为分开的红色荧光信号和绿色荧光信号[13]。因此,ALK基因重排阳性结果指红色荧光信号同绿色荧光信号分离并间隔不小于两个信号点直径的距离,或者是细胞中单独存在红色荧光信号而不存在与其相应的绿色荧光信号。每份计数不少于100个肿瘤细胞的组织样本,如有不小于15%的细胞出现上述阳性结果,则认为该样本检测ALK基因重排结果为阳性。
1.4 ALK基因拷贝数增加阳性的结果判定
目前ALK基因拷贝数增加(ALK gene copy number gain,ALK-CNG)的阳性标准尚未建立,本研究通过构建受试者工作特征曲线(receiver operating characteristic,ROC)确定检测的最佳阈值。当ALK-CNG值为4个拷贝数时,其敏感度、特异度和Youden's指数分别为35.6%、97.1%和0.327,由此确定4个拷贝数为ALKCNG阳性的最佳临界点。本研究中一份计数不少于100个肿瘤细胞的组织样本,如其中不少于40%的细胞出现红色荧光信号及绿色荧光信号均≥4个,即认为ALK-CNG阳性。
1.5 统计学处理
采用SPSS 13.0统计软件对实验数据进行处理。ALK基因表达情况同相应临床资料的分析采用χ2检验或者Fisher精确概率检验,总生存期(overall survival,OS)为首次确诊至死亡或末次随访时间。无进展生存时间(progression free survival,PFS)为接受手术时间起至疾病进展或末次随访时间。生存分析采用Kaplan-Meier,组间差异行log-rank检验。单因素分析有意义的变量引入Cox比例风险回归模型进行多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 ALK基因在HCC组织中的表达
荧光原位杂交结果显示,213例HCC组织样本中未发现ALK基因重排阳性病例,通过计数ALK基因拷贝数,发现28例存在ALK-CNG现象,见图1。
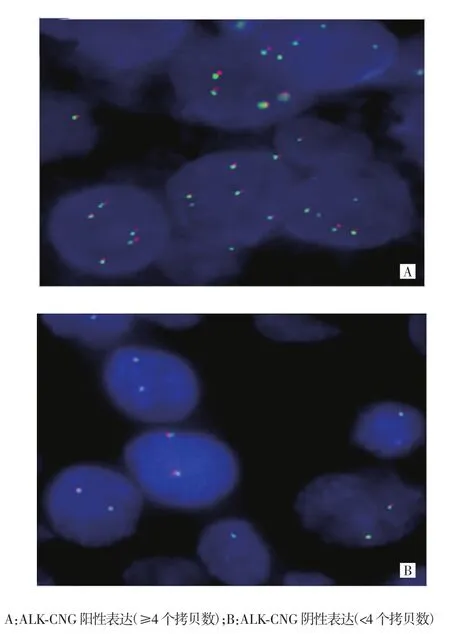
图1 ALK-CNG在HCC组织中的表达
2.2 ALK-CNG阳性表达水平与HCC患者临床病理特征的关系
ALK-CNG阳性表达与HCC患者年龄、性别、AJCC分期、Child-Pugh评分及复发情况均无明显相关性(P>0.05)。见表1。
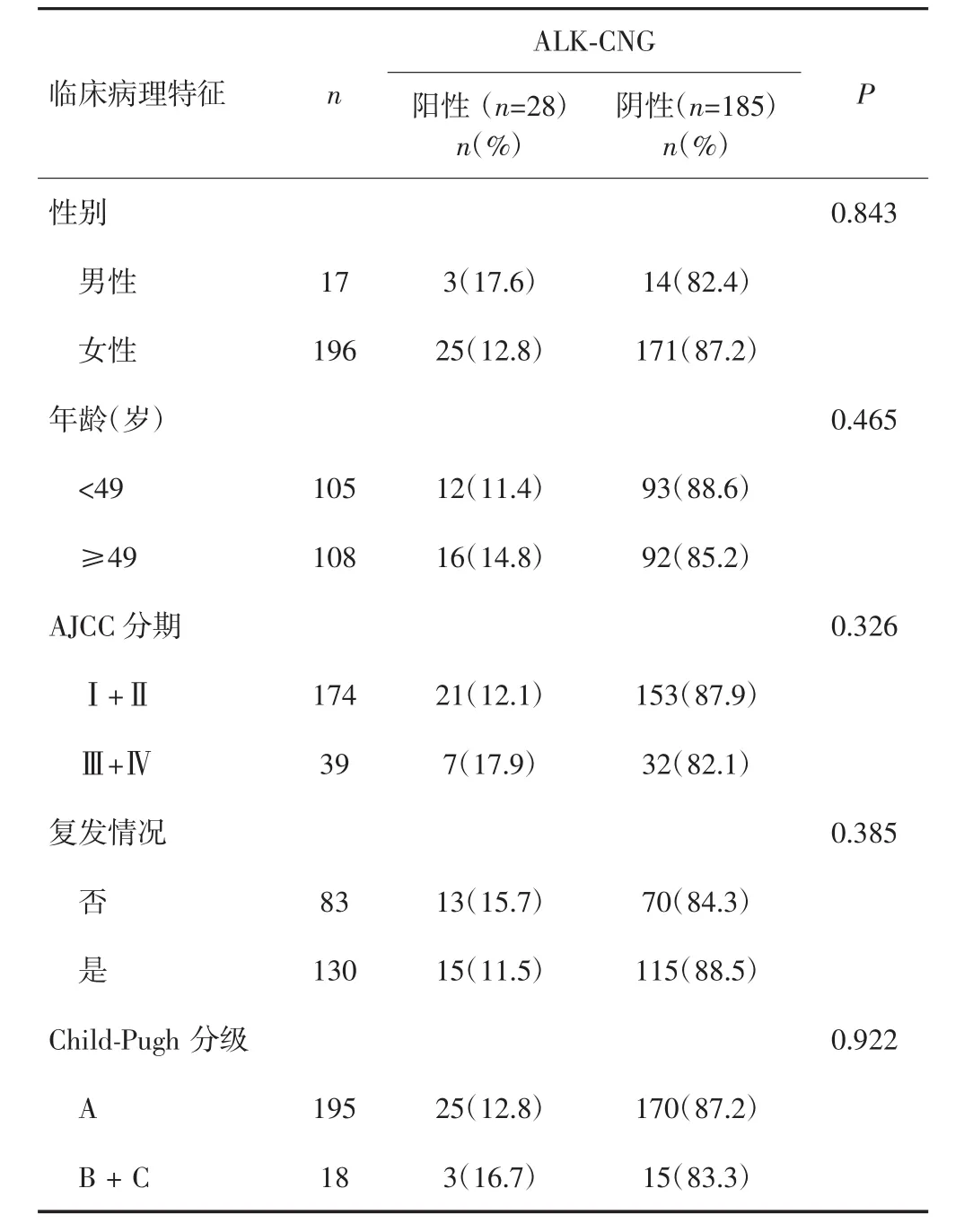
表1 ALK-CNG表达与HCC患者临床病理特征的关系[n(%)]
2.3 ALK-CNG表达与HCC患者预后的关系
本次研究末次随访时间为2012年12月,中位随访时间为42.47个月,147例因肿瘤死亡。Kaplan-Meier法分析显示,213例HCC患者3年总生存率为53.0%,无进展生存率为40.8%。ALK-CNG阳性组患者3年总生存率为38.1%,ALK-CNG阴性组为57.6%,两组差异无统计学意义(P=0.089),见图2A。ALK-CNG阳性组患者3年无进展生存率为27.3%,ALK-CNG阴性组为42.5%,两组差异有统计学意义(P=0.048),见图2B。
进一步按临床分期进行分层分析,结果显示,晚期(Ⅲ+Ⅳ期)患者中,ALK-CNG阳性者(n=7)与阴性者(n=32)3年总生存率分别为0和40.6%,差异无统计学意义(P=0.054),见图2C。ALK-CNG阳性者3年无进展生存率为0,明显低于ALK-CNG阴性者的33.5%(P=0.007),见图2D。在早期(I+Ⅱ期)患者中,ALK-CNG阳性者(n=21)和阴性者(n=153)3年总生存率分别为56.7%和61.8%,差异无统计学意义(P=0.394),见图2E;无进展生存率分别为36.9%和44.4%,差异亦无统计学意义(P=0.314),见图2F。
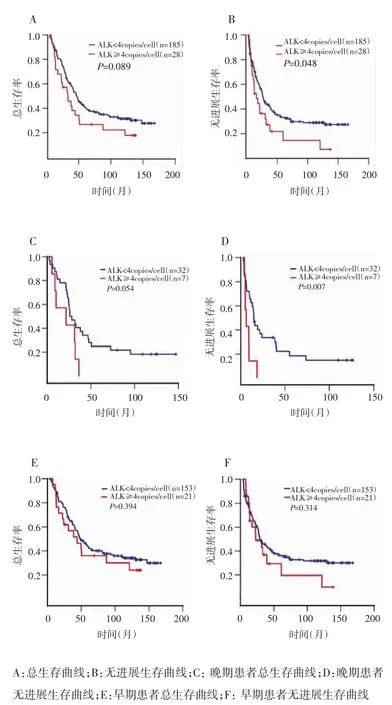
图2 ALK-CNG阳性与阴性HCC患者的总生存和无进展生存曲线
2.4 单因素和多因素分析结果
单变量回归分析显示ALK-CNG阳性(HR=1.479,95%CI:0.939~2.329,P=0.091)并非HCC患者总生存率的预后预测因子。无进展生存率的单变量回归分析显示,ALK-CNG阳性(HR=1.598,95%CI:1.001~2.552,P=0.049)、Child-Pugh分级(HR=2.165,95%CI:1.300~3.608,P=0.002)及AJCC分期(HR=1.926,95%CI:1.304~2.845,P=0.001)均为HCC患者的独立预后因子。
多因素回归分析结果显示,ALK-CNG阳性(HR= 1.596,95%CI:1.008~2.526,P=0.046)、Child-Pugh分级(HR=1.744,95%CI:1.021~2.979,P=0.042)及AJCC分期(HR=1.775,95%CI:1.179~2.673,P=0.006)是HCC患者无进展生存率的预后预测因子,ALK-CNG阳性是HCC患者独立的预后指标。
3 讨论
研究表明ALK基因在多种肿瘤中表达异常,且与肿瘤的发生、发展相关。有学者采用RT-PCR法检测ALK基因在肝癌及乳腺癌等多种肿瘤中的表达情况,结果在232例肝癌及90例乳腺癌患者中均未发现ALK基因重排阳性[14],而Lin等[15]检测209例乳腺癌患者ALK基因重排情况,其阳性率仅为2.4%。本研究采用荧光原位杂交法检测213例HCC组织中ALK基因的表达,亦未发现ALK基因重排阳性患者。由此可见,ALK基因重排在HCC中的阳性表达率并不高。
ALK基因的表达异常还包括ALK基因扩增及拷贝数增加。2002年,Miyake等[16]首次报道在神经母细胞瘤中存在ALK基因扩增,其发生率明显高于肿瘤组织。ALK基因扩增与神经母细胞瘤患者预后的关系尚不清楚[17],但研究发现ALK抑制剂对有ALK基因扩增的神经母细胞瘤细胞株表现出了抑制其细胞增殖及促进细胞凋亡的作用[18-19],因此,针对ALK基因扩增的靶向治疗仍有望成为治疗神经母细胞瘤的新手段。近期研究发现,在食管癌及NSCLC脑转移的组织样本中虽然未发现ALK基因重排阳性,但均存在ALK基因扩增现象,其发生率约为10%[20-21]。另外在炎性乳腺癌组织样本中也发现存在ALK基因扩增[22],且有学者通过动物实验证实低剂量的ALK抑制剂克唑替尼可使该类肿瘤缩小[23-24]。在NSCLC组织样本中,ALK基因扩增现象亦较明显,有研究表明在ALK基因重排阳性的样本中亦发现了ALK基因扩增现象[25]。而与ALK基因扩增相比,ALK基因拷贝数增加在肿瘤组织中的发生率较高。在神经母细胞瘤中,ALK-CNG的发生率为10%~20%[26]。在NSCLC中,有35.2%~63.6%的组织样本存在ALK-CNG现象,但尚未发现该现象同患者预后之间的关系[27]。本研究虽未发现ALK基因重排阳性病例,但亦观察到ALK-CNG现象,其发生率为13.15%。
目前已有研究表明ALK的异常表达与某些肿瘤的恶性程度或预后相关。在高级别(Ⅲ级、Ⅳ级)胶质瘤中,ALK的表达广泛且较显著[28],约50%的ALK阳性炎性肌纤维母细胞瘤患者易复发[29]。本研究亦发现,ALK-CNG阳性与HCC患者的预后较差相关(P=0.048),对HCC患者无进展生存期有一定影响,可能成为HCC患者独立的预后指标。
综上所述,本研究在HCC患者组织样本中未发现ALK基因重排阳性患者,但存在ALK基因拷贝数增加现象,且ALK-CNG阳性与HCC患者预后相关。因此,在指导HCC患者的个体化治疗中,ALK-CNG可能是一个有效的指标,有望用于患者预后评估,也可能为HCC的个体化治疗提供依据。但本研究未能在肿瘤组织样本中检测其他基因的表达情况,ALK-CNG与其他基因表达的关系,仍需进一步研究。同时ALK-CNG在肿瘤细胞系中的功能及调控机制尚不清楚,值得进一步研究。
[1] Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2] Yang YB,Lu YY,Wang CP,et al.Cryotherapy is associated with improved clinical outcomes of sorafenib for the treatment of advanced hepatocellular carcinoma[J].Exp Ther Med,2012,3(2):171-180.
[3] Baek YH,Kim KT,Lee SW,et al.Efficacy of hepatic arterial infusion chemotherapy in advanced hepatocellular carcinoma[J]. World J Gastroenterol,2012,18(26):3426-3434.
[4] Cao H,Phan H,Yang LX.Improved chemotherapy for hepatocelluar carcinoma[J].Anticancer Res,2012,32(4):1379-1386.
[5] Cervello M,McCubrey JA,Cusimano A,et al.Targeted therapy for hepatocellular carcinoma:novel agents on the horizon[J].Oncotarget,2012,3(3):236-260.
[6] Tanaka S,Arii S.Molecular targeted therapies in hepatocellular carcinoma[J].Semin Oncol,2012,39(4):486-492.
[7] Palmer RH,Vernersson E,Grabbe C,et al.Anaplastic lymphoma kinase:signalling in development and disease[J].Biochem J,2009,420(3):345-361.
[8] Soda M,Choi YL,Enomoto M,et al.Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer[J].Nature,2007,448(7153):561-566.
[9] George RE,Sanda T,Hanna M,et al.Activating mutations in ALK provide a therapeutic target in neuroblastoma[J].Nature,2008,455(7215):975-978.
[10]Camidge DR,Bang YJ,Kwak EL,et al.Activity and safety of crizotinib in patients with ALK-positive non-small-cell lung cancer: updatedresultsfromaphase 1 study[J].Lancet Oncol,2012,13(10):1011-1019.
[11]TiseoM,GelsominoF,BartolottiM,etal.Anaplasticlymphomakinase as a new target for the treatment of non-small-cell lung cancer[J]. Expert Rev Anticancer Ther,2011,11(11):1677-1687.
[12]ShawAT,KimDW,NakagawaK,etal.Crizotinibversuschemotherapy in advanced ALK-positive lung cancer[J].N Engl J Med,2013,368(25):2385-2394.
[13]Sun Y,Ren Y,Fang Z,et al.Lung adenocarcinoma from East Asian never-smokers is a disease largely defined by targetable oncogenic mutant kinases[J].J Clin Oncol,2010,28(30):4616-4620.
[14]Fukuyoshi Y,Inoue H,Kita Y,et al.EML4-ALK fusion transcript is not found in gastrointestinal and breast cancers[J].Br J Cancer,2008,98(9):1536-1539.
[15]Lin E,Li L,Guan Y,et al.Exon array profiling detects EML4-ALK fusion in breast,colorectal,and non-small cell lung cancers[J]. Mol Cancer Res,2009,7(9):1466-1476.
[16]Miyake I,Hakomori Y,Shinohara A,et al.Activation of anaplastic lymphoma kinase is responsible for hyperphosphorylation of ShcC in neuroblastoma cell lines[J].Oncogene,2002,21(38):5823-5834.
[17]Azarova AM,Gautam G,George RE.Emerging importance of ALK in neuroblastoma[J].Semin Cancer Biol,2011,21(4):267-275.
[18]Janoueix-Lerosey I,Lequin D,Brugières L,et al.Somatic and germline activating mutations of the ALK kinase receptor in neuroblastoma[J]. Nature,2008,455(7215):967-970.
[19]Grande E,Bolós MV,Arriola E.Targeting Oncogenic ALK:A Promising Strategy for Cancer Treatment[J].Mol Cancer Ther,2011,10(4):569-579.
[20]Schoppmann SF,Streubel B,Birner P.Amplification but not translocation of anaplastic lymphoma kinase is a frequent event in oesophageal cancer[J].Eur J Cancer,2013,49(8):1876-1881.
[21]Preusser M,Berghoff AS,Ilhan-Mutlu A,et al.ALK gene translocations and amplifications in brain metastases of non-small cell lung cancer[J].Lung Cancer,2013,80(3):278-283.
[22]Robertson FM,Petricoin Iii EF,Van Laere SJ,et al.Presence of anaplastic lymphoma kinase in inflammatory breast cancer[J]. Springerplus,2013,2:497.
[23]Tuma RS.ALKgene amplified in most inflammatory breast cancers[J]. J Natl Cancer Inst,2012,104(2):87-88.
[24]Tothova Z,Wagner AJ.Anaplastic lymphoma kinase-directed therapy in inflammatory myofibroblastic tumors[J].Curr Opin Oncol,2012,24(4):409-413.
[25]Wojas-Krawczyk K,Krawczyk PA,Ramlau RA,et al.The analysis of ALK gene rearrangement by fluorescence in situ hybridization in non-small cell lung cancer patients[J].Contemp Oncol(Pozn),2013,17(6):484-492.
[26]De Brouwer S,De Preter K,Kumps C,et al.Meta-analysis of neuroblastomas reveals a skewed ALK mutation spectrum in tumors with MYCN amplification[J].Clin Cancer Res,2010,16(17):4353-4362.
[27]Salido M,Pijuan L,Martínez-Avilés L,et al.Increased ALK gene copy number and amplification are frequent in non-small cell lung cancer[J].J Thorac Oncol,2011,6(1):21-27.
[28]侯景辉,曾敬,赵美卿,等.间变性淋巴瘤激酶基因蛋白在不同级别胶质瘤中表达[J].临床与实验病理学杂志,2004,20(5):645.
[29]Coffin CM,Hornick JL,Fletcher CD.Inflammatory myofibroblastic tumor:comparison of clinicopathologic,histologic,and immunohisto chemical features including ALK expression in atypical and aggressive cases[J].Am J Surg Pathol,2007,31(4):509-520.
[2016-08-03收稿][2016-10-20修回][编辑 罗惠予]
Anaplastic lymphoma kinase gene expression and its clinical significance in hepatocellular carcinoma
Jia Shouwei1,3,4,Shao Qiong2,3,4,Wu Xiaoyan2,3,4,Cao Li1,3,4,Long Zijun1,3,4,Shao Jianyong2,3,4,Huang Hongbing1,3,4(1Department of Pharmacy,Sun Yat-sen University Cancer Center;2Department of Molecular Diagnostics,Sun Yat-sen University Cancer Center;3State Key Laboratory of Oncology in South China;4Collaborative Innovation Center for Cancer Medicine,Guangzhou 510060,P.R.China)
Huang Hongbing.E-mail:huanghb@sysucc.org.cn
ObjectiveTo examine the status and clinical significance of anaplastic lymphoma kinase(ALK)gene alterations in hepatocellular carcinoma(HCC)patients.MethodsWe detected ALK gene expression in HCC tissues using fluorescent in situ hybridization,and we assessed the correlation of ALK gene expression with clinicopathologic outcomes and prognosis in HCC.ResultsALK gene translocation was not observed in any HCC cases in the present study.In contrast,gain in ALK gene copy number(ALK-CNG)was detected in 28 HCC patients,and this copy number gain did not positively correlate with age,sex,AJCC stage,recurrence or Child-Pugh classification(P>0.05).Copy number gain did positively correlate with poorer prognosis in HCC(P=0.048),especially among patients with stageⅢ/Ⅳ disease(P=0.007).Univariate and multivariate Cox proportional hazards regression analysis suggested that ALK-CNG was an independent prognostic indicator for patients with HCC(P=0.046).ConclusionALK-CNG,but not translocation of ALK,is present in HCC and may predict unfavorable prognosis.
Liver neoplasms;Anaplastic lymphoma kinase;Fluorescent in situ hybridization;Clinical significance
R735.7
A
1674-5671(2016)06-06
10.3969/j.issn.1674-5671.2016.06.04
黄红兵。E-mail:huanghb@sysucc.org.cn

