广西肝癌高发区不同水源微囊藻毒素含量调查
李科志邓伟李云西利基林张春燕任静静吴杭航
作者单位:530021 南宁1广西壮族自治区肿瘤防治研究所;532100 扶绥2扶绥县人民医院
流行病学调查
广西肝癌高发区不同水源微囊藻毒素含量调查
李科志1邓伟1李云西2利基林1张春燕1任静静1吴杭航1
作者单位:530021 南宁1广西壮族自治区肿瘤防治研究所;532100 扶绥2扶绥县人民医院
目的了解广西肝癌高发区扶绥县饮用水水体微囊藻毒素(microcystin,MC)污染状况。方法采集扶绥县11个自然村水源水样及28个自然村的末梢水水样,同时记录采样时水温及pH值。采用酶联免疫吸附法测定水样中的MC含量。结果(1)水源水和末梢水之间温度和pH值差异无统计学意义(P>0.05)。(2)水源水和末梢水MC平均浓度分别为(15.64±2.08)ng/L、(14.42±2.28)ng/L,两者差异无统计学意义(P>0.05)。水源水中河水MC浓度最高,为16.69 ng/L,其他依次为地下河水和井水,各种水源水间MC浓度差异无统计学意义(P>0.05)。末梢水中MC浓度从高到低依次为水库水、井水、地下河水和河水,来源不同的末梢水间MC浓度差异无统计学意义(P>0.05)。(3)经水厂处理和未经水厂处理的末梢水水样MC平均浓度分别为(13.90±2.62)ng/L、(14.71±2.09)ng/L,两者差异亦无统计学意义(P>0.05)。结论广西肝癌高发区扶绥县饮用水MC浓度均未超过WHO推荐的安全限值,不同水源水间的MC浓度无明显差异。
肝肿瘤;微囊藻毒素;水源;调查
广西是肝癌高发地区之一,肝癌死亡率较高的县、市主要集中在以扶绥县为中心,半径约80 km的桂西南地区,该地区的肝癌死亡率是全广西平均水平的2倍左右[1-2]。乙型肝炎病毒(hepatitis B virus,HBV)感染、黄曲霉毒素摄入和饮用水源污染是广西肝癌发病的三大危险因素。虽然通过乙肝疫苗接种、控制黄曲霉毒素污染及饮用水改造等一级预防措施,高发区居民肝癌发病率上升的势头得到了遏制,但近年广西扶绥县肝癌发病率依然维持在50/10万~55/10万之间,高于全区平均水平[3-4]。广西肝癌高发区人畜饮用水源改造后,其中的化学污染指标含量明显下降,但改造后的新水源极易出现富营养化,淡水中浮游藻类(称为“水华”)大量繁殖,微囊藻毒素(microcystin,MC)是水华暴发时蓝藻的代谢产物,具有较强的肝脏毒性[5]。世界卫生组织在《水中有毒蓝藻:公共卫生后果监测与管理指南》中推荐微囊藻素安全值为不大于0.001 mg/L,我国《生活饮用水卫生标准》(GB5749-2006)中新增了微囊藻素限值为0.001 mg/L。为了探明该地区的肝癌危险因素,我们对广西肝癌高发区扶绥县饮用水MC的污染情况进行调查,现将结果报道如下。
1 材料与方法
1.1 水样采集
在广西的肝癌高发现场扶绥县,选取以河水、水库水和井水作为饮用水源的村庄各10个。采集2015年夏季的水源水和管网末梢水,记录水源水采样时的水温、pH值和影响MC产生的环境因素,测定水源水和末梢水中的MC浓度。
1.2 酶联免疫吸附法测定微囊藻毒素
将所有试剂及样品置于室温下。从铝箔袋中取出微孔条,放入干燥剂并重新封好。将100倍浓缩清洗液稀释为1倍清洗液。吸取50 μL酶标记物至微孔板各孔,吸取50 μL标准的阴性对照样品至对应微孔,每种溶液均用干净吸头吸取,避免交叉污染。加入50 μL抗体溶液至每个小孔,快速震荡使溶液混合,敷上薄膜,或将微孔板置于振荡器震荡孵育,达到孵育期持续震荡的效果。孵育30 min,去掉封口膜将微孔中溶液倒入水槽,用1倍清洗液充满微孔,震荡后倒掉,重复4次,共5次洗板。在吸水纸上拍打,尽可能将水拍干。每个微孔中加入100 μL底物溶液,盖上小孔并孵育30 min,按照加底物的顺序每孔中加入100 μL停止液。450 nm下读板,计算MC浓度。
1.3 统计学方法
应用SPSS 19.0统计分析软件对数据进行处理。水源水与末梢水MC含量比较、自来水厂处理与未经处理水的比较采用t检验。不同水源类型之间MC含量比较采用方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 水样基本情况
共采集水样39份,其中河水水源5份,平均温度27.2℃,pH 5.8;对应末梢水11份,平均温度27.4℃,pH 5.8。井水水源4份,平均温度23.8℃,pH 6.2;对应末梢水7份,平均温度25.6℃,pH 6.2。地下河水水源2份,平均温度24.0℃,pH 5.4;对应末梢水7份,平均温度24.9℃,pH 5.7。水库末梢水3份,平均温度27.3℃,pH 5.4。水源水和末梢水的温度和pH值均值间差异无统计学意义(P>0.05)。比较不同水源类型间的温度和pH值,仅水源水的温度有差异,其中河水温度最高,为27.2℃;其次为地下河水,水温为24.0℃;井水的水温最低,为23.8℃(F=22.34,P<0.05)。
2.2 水样MC污染情况
39份水样中水源水 11份,MC平均浓度为(15.64±2.08)ng/L;末梢水28份,MC平均浓度为(14.42±2.28)ng/L,两者差异无统计学意义(t=1.529,P>0.05),所有样本微囊藻毒素检出值均低于WHO推荐值0.001 mg/L。
2.3 不同水源水MC浓度检测结果
将不同水源类型中的MC浓度进行比较,结果见表1。在水源水中,河水中的MC浓度最高,为16.69 ng/L,其他依次为地下河水和井水,各种水源水间MC浓度差异无统计学意义(F=1.904,P>0.05)。在末梢水中,MC的浓度从高到低依次为水库水、井水、地下河水和河水,来源不同的末梢水间MC浓度差异无统计学意义(F=1.207,P>0.05)。
2.4 不同水源处理方式对MC浓度的影响
在28份末梢水样中,经水厂处理的10份,MC平均浓度为(13.90±2.62)ng/L;未经水厂处理的水样18份,MC平均浓度为(14.71±2.09)ng/L,两者差异无统计学意义(t=0.904,P>0.05)。按水样来源进行分类后,比较是否经水厂处理的水样之间MC的含量,两者间差异均无统计学意义,见表2。
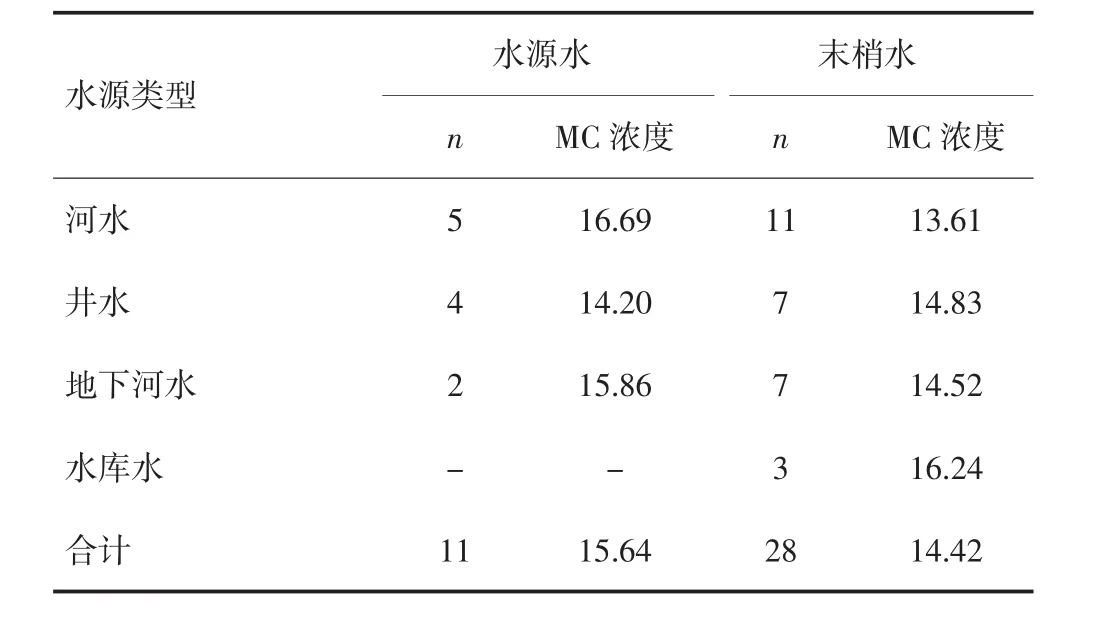
表1 不同水源水MC浓度检测结果(ng/L)
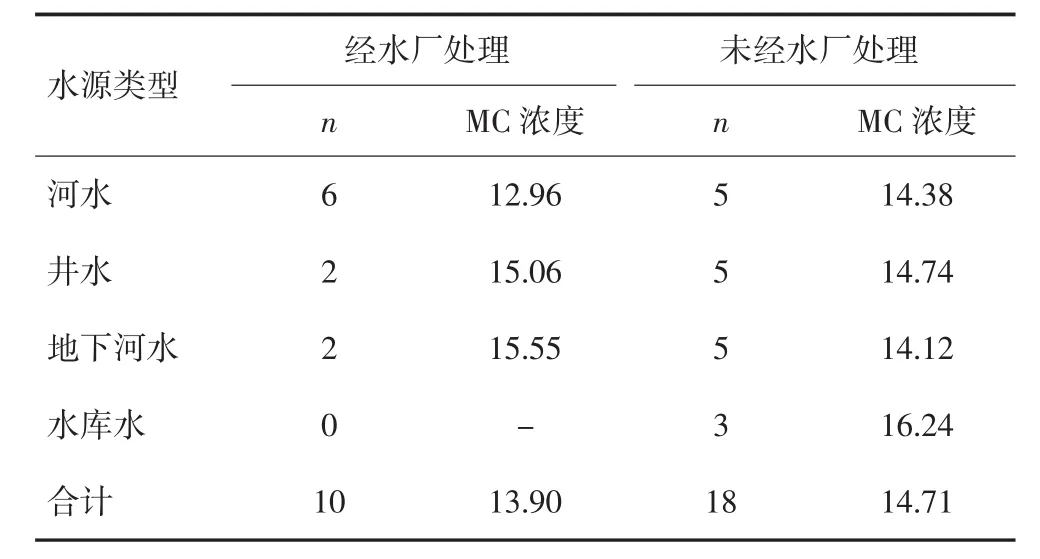
表2 不同处理方式对水样MC浓度的影响(ng/L)
3 讨论
肝癌的发生、发展是一个多因素参与的过程,大量流行病学研究表明饮用水的污染与其相关[6]。扶绥地区水质与肝癌病因的早期研究提示,上世纪90年代当地饮用水污染程度按重至轻依次为塘水>河水>井水,与对应不同类型饮用水源地居民的肝癌死亡率一致,但限于当时的研究水平,未能明确其中何种污染物为主要致癌因子[7]。
为解决农村居民饮水安全问题,扶绥县2005年至2013年共投入1亿多元,建成226个农村饮水安全工程,受益人口达19万多人。其中农村集中式供水覆盖人口比例为75.02%~85.15%,分散式供水为14.85%~24.98%。有研究指出,不管是集中式供水还是分散式供水,毒理学指标合格率均为100%,感官性状和一般化学指标的合格率在96%以上,而微生物指标的合格率在60%以下,说明影响水质的主要是微生物指标[8]。
MC是一类由水源微生物产生的典型的生物污染物[9-11],大量研究表明其具有较强的肝脏毒性,同时也有很多研究者认为MC是肝癌的一个重要致病因素[12-15]。本次调查结果显示水源水样本及末梢水样本中的MC浓度均低于WHO设定的安全警戒指标。结合本次调查结果并从时间趋势变化分析扶绥县肝癌的调整发病率及年度变化百分比(APC%),均呈下降趋势(统计截至2009年)[16-17],提示其与水质改善密切相关。
各种水源水MC含量差异不显著的原因可能由于采集样本期为雨季,充沛的雨水使水中污染物得到稀释,浓度降低。MC含量最高的水库水的检出值也低于国家规定的饮用水标准。未来,我们将在不同季节分别采样以期获得更全面、准确的数据,进一步明确扶绥地区饮用水MC污染与肝癌之间的关系,为今后水质监测及改善提供依据。
[1] 黄天壬,余家华,张振权,等.广西肝癌流行特征和流行趋势分析[J].广西医学,2000,22(4):677-679.
[2] 毛赛兰,何承诚,赵瑞强,等.广西扶绥县壮族肝癌家系人群Itgb1基因多态性与肝癌遗传易感性的研究[J].中国癌症防治杂志,2016,8(2):78-82.
[3] 郝捷,陈万青.中国肿瘤登记年报[M].北京:军事医学科学出版社,2009.
[4] 李召发,邓伟,黄天壬,等.广西扶绥地区乙型肝炎病毒基因型分布的概况[J].中国癌症防治杂志,2015,7(2):112-114.
[5] 孙瑜,徐立红.微囊藻毒素LR对肝细胞系HL7702内的蛋白磷酸酶PP2A下游靶点的影响[D].浙江大学,2012.
[6] 孙元设,胡志坚.微囊藻毒素与原发性肝癌的关系研究[D].福建医科大学,2011.
[7] 黎丹戎,刘宗河,张振权,等.肝癌高发区居民饮用水质与肝癌病因研究[J].中华预防医学杂志,1994,28(1):24-26.
[8] 李月红,黄敬秀,罗华山,等.2008~2013年广西扶绥县农村生活饮用水水质监测结果分析[J].应用预防医学,2015,21(2):124-125.
[9] Kounnis V,Chondrogiannis G,Mantzaris MD,et al.Microcystin LR shows cytotoxic activity against pancreatic cancer cells expressing the membrane OATP1B1 and OATP1B3 transporters[J].Anticancer Res,2015,35(11):5857-5865.
[10]Ikehara T,Nakashima J,Nakashima S,et al.Different responses of primary normal human hepatocytes and human hepatoma cells toward cyanobacterialhepatotoxinmicrocystin-LR[J].Toxicon,2015,105:4-9.
[11]Takumi S,Ikema S,Hanyu T,et al.Naringin attenuates the cytotoxicity of hepatotoxinmicrocystin-LRbythecurious mechanisms to OATP1B1-and OATP1B3-expressing cells[J].Environ Toxicol Pharmacol,2015,39(2):974-981.
[12]Labine M,Minuk GY.Long-term,low-dose exposure to microcystin toxin does not increase the risk of liver tumor development or growth in mice[J].Hepatol Res,2015,45(6):683-692.
[13]Wang J,Yu S,Jiao S,et al.κ-Selenocarrageenan prevents microcystin-LR-induced hepatotoxicity in BALB/c mice[J].Food Chem Toxicol. 2013,59:303-310.
[14]Sedan D,Giannuzzi L,Rosso L,et al.Biomarkers of prolonged exposure to microcystin-LR in mice[J].Toxicon,2013,68:9-17.
[15]Laughinghouse HD,Prá D,Silva-Stenico ME,et al.Biomonitoring genotoxicity and cytotoxicity of Microcystis aeruginosa(Chroococcales,cyanobacteria)using the Allium cepa test[J].Sci Total Environ,2012,432:180-188.
[16]韦忠亮,梁任祥,汪凯波,等.扶绥县1974~2003年肝癌发病率变化趋势分析[J].中国肿瘤,2007,16(9):679-680.
[17]何明荣.广西扶绥县2009年恶性肿瘤发病分析[J].中国肿瘤,2013,22(12):1001-1005.
[2016-10-09收稿][2016-11-14修回][编辑 江德吉]
Microcystin content of different water sources in a region of Guangxi showing high incidence of liver cancer
Li Kezhi1,Deng Wei1,Li Yunxi1,Li Jilin2,Zhang Chunyan1,Ren Jingjing1,Wu Hanghang1(1Research Department of Guangxi Cancer Institute,Nanning 530021,P.R.China;2Fusui People's Hospital,Fusui 532100,P.R.China)
Deng Wei.E-mail:9608946@qq.com
ObjectiveTo investigate microcystin contamination in water bodies that feed the water supply system of Fusui County,which shows a high incidence of liver cancer in Guangxi Province.Method Water sources in 11 villages and tapwater in 28 villages were sampled.Temperature and pH were recorded during sampling,and microcystin was assayed using ELISA.Result Source water and tapwater did not differ significantly in temperature or pH.Average microcystin concentration was(15.64±2.08)ng/L in source water,and(14.42±2.28)ng/L in tapwater.These values were not significantly different.Microcystin concentration in source water varied with the trend:river>subterranean river>well water.Microcystin concentration in tapwater varied with the trend:reservoir water>well river>subterranean river>river water.However,these trends were not statistically significant.The concentration of microcystin was 16.69 ng/L in river water,which was the highest concentration of all water sources tested.Average microcystin concentration was(13.90±2.62)ng/L in treated tapwater and(14.71±2.09)ng/L in untreated tapwater.These values were not significantly different.ConclusionMicrocystin concentration did not exceed the WHO-recommended limit of 0.001 mg/L in any sample tested.
Liver neoplasms;Microcystin;Drinking water;Survey
R735.7
A
1674-5671(2016)06-04
10.3969/j.issn.1674-5671.2016.06.11
国家自然科学基金资助项目(81260319,81660561)
邓伟。E-mail:9608946@qq.com

