HIF-1α、CD44在胃癌组织中的表达及临床意义
黄名威 吴留成 覃宇周 李照 张猛 苏弟 陈建思
作者单位:530021 南宁 广西医科大学附属肿瘤医院胃肠外科
临床研究
HIF-1α、CD44在胃癌组织中的表达及临床意义
黄名威 吴留成 覃宇周 李照 张猛 苏弟 陈建思
作者单位:530021 南宁 广西医科大学附属肿瘤医院胃肠外科
目的探讨缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)、CD44在胃癌组织中的表达及临床意义。方法采用免疫组织化学法检测184例胃癌组织中HIF-1α和CD44的表达,并分析其与患者临床病理特征及预后的关系。结果HIF-1α、CD44在胃癌组织中的阳性表达率分别为55.4%(102/184)、62.4%(116/184);HIF-1α的表达与肿瘤浸润深度及淋巴结转移密切相关(P<0.05),CD44表达与肿瘤大小、肿瘤浸润深度及淋巴结转移密切相关(P<0.05);相关分析结果显示,CD44和HIF-1α在胃癌组织中的表达呈正相关(r=0.71,P=0.003)。多因素分析显示,HIF-1α阳性表达、CD44阳性表达、淋巴结转移和肿瘤浸润深度为胃癌的独立预后因素(P<0.05)。结论HIF-1α、CD44在胃癌组织中的表达呈正相关且与胃癌预后密切相关。
胃肿瘤;缺氧诱导因子1α;CD44;预后
胃癌是常见的消化道恶性肿瘤之一,恶性程度高、异质性强、预后较差[1]。研究与胃癌生物学行为相关的生物标志物并对其进行干预,对提高患者生存预后有着重要的意义。缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)是肿瘤细胞在缺氧因素诱导下产生的一种核转录因子,具有调控细胞内多种靶基因表达的作用并影响肿瘤的发生、发展[2]。CD44分子是由单基因编码的I类跨膜糖蛋白在多种细胞和组织表面广泛表达,与肿瘤生长、侵袭、转移以及造血干细胞的归巢等密切相关[3]。在胃癌中HIF-1α是否参与调控CD44表达及其机制尚未明确。本研究对胃癌组织中HIF-1α和CD44的表达情况进行研究,探讨两者表达的相关性及与胃癌临床病理特征及预后的关系,进一步研究两者的作用机制。
1 资料与方法
1.1 临床资料
收集2009年1月至2010年12月行根治性手术切除的胃癌组织标本。纳入标准:(1)初诊的胃癌或胃食管结合部癌,无远处转移;(2)无合并其他恶性肿瘤;(3)接受根治性手术(R0手术),术前未行化疗、放疗及其他抗肿瘤治疗;(4)根据术后病理学检查结果,有化疗指征者常规完成辅助化疗。184例符合标准纳入研究,其中男性104例,女性80例,年龄27~83岁,平均年龄61.3岁;行远端胃切除98例,近端胃切除34例,全胃切除52例,其他临床资料见表1。
1.2 免疫组织化学染色
兔抗人CD44单克隆抗体、鼠抗人HIF-1α单克隆抗体和广谱二抗试剂盒均购自北京中杉金桥生物技术有限公司。免疫组织化学染色采用SP法,染色程序按试剂盒说明书进行。每例癌组织均以对应正常胃黏膜(距离癌灶边缘≥5 cm)为正常对照。
1.3 结果判定
由2位经验丰富的病理医师独立读片,每张切片随机选取2个高倍视野(×400倍)。CD44结果判定采用十三点评分法判定[4],HIF-1α结果判定参照半定量评分方法[5]。两者得分的乘积为最终得分:0~1分为阴性,≥2分为阳性。
1.4 随访情况
由本院随访办公室和课题组采用门诊、电话、上门等方式进行随访,术后2年内,每3月随访1次,2年后6~12个月随访1次。记录的生存时间为手术时间至末次随访时间或死亡时间,随访至2016年5月。
1.5 统计学处理
采用SPSS 18.0统计软件对数据进行分析。计数资料比较采用χ2检验或Fisher精确概率检验;相关性分析采用Spearman法;生存分析采用Life-Table法,Kaplan-Meier法绘制生存曲线,生存率比较采用log-rank检验;采用Cox比例风险回归模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 CD44和HIF-1α蛋白在胃癌组织中的表达
CD44蛋白主要在细胞膜上表达,部分伴细胞质表达;HIF-1α主要分布在细胞核、细胞质或间质中(图1)。CD44在胃癌组织中的阳性表达率为62.4%(116/184),在正常胃黏膜组织中的阳性表达率为2.2%(4/184),差异有统计学意义(χ2=77.56,P<0.001)。HIF-1α在胃癌组织中的阳性表达率为55.4%(102/184),在正常胃黏膜组织中的阳性表达率为1.1%(2/184),差异亦有统计学意义(χ2=67.02,P<0.001)。Spearman相关分析显示,CD44和HIF-1α蛋白在胃癌组织中的表达呈正相关(r=0.71,P=0.003)。
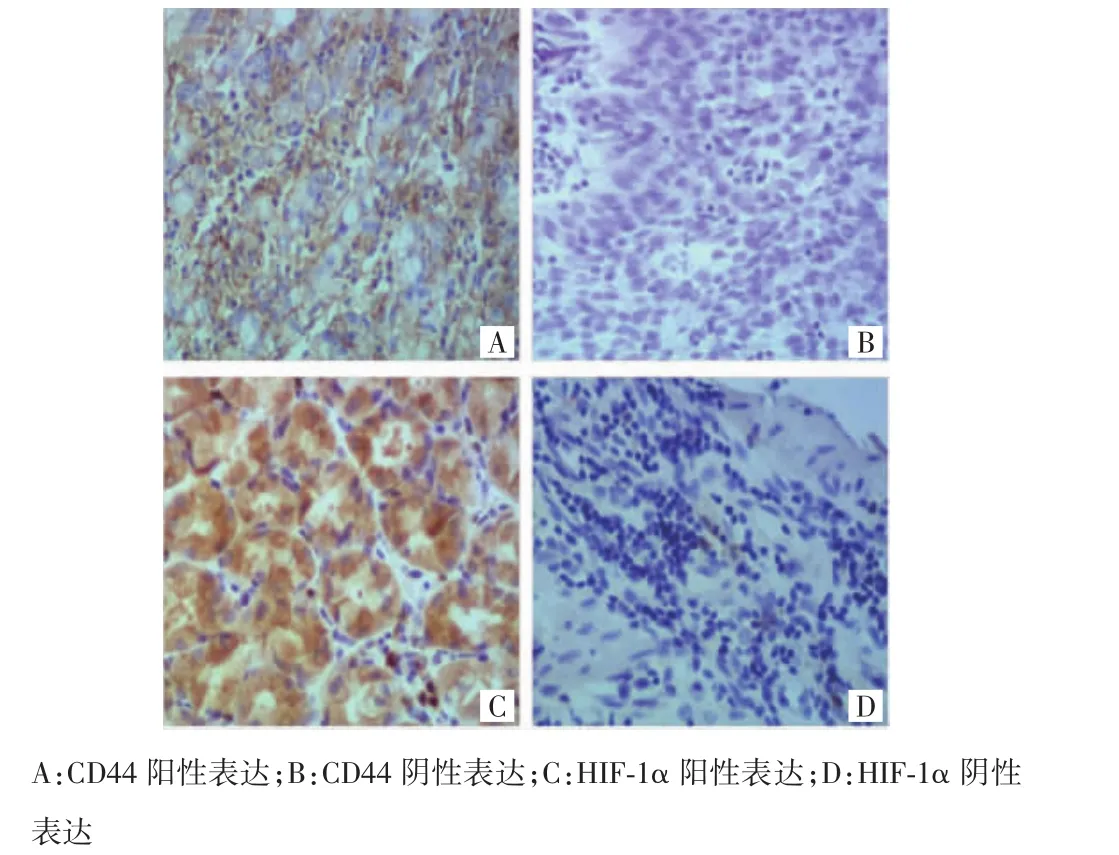
图1 CD44、HIF-1α在胃癌组织中的表达(SP×400)
2.2 胃癌组织中CD44和HIF-1α表达与临床病理特征的关系
胃癌组织中CD44与HIF-1α的表达均与肿瘤浸润深度(T分期)、淋巴结转移密切相关(P<0.05),CD44表达还与肿瘤大小相关(P<0.05)。见表1。
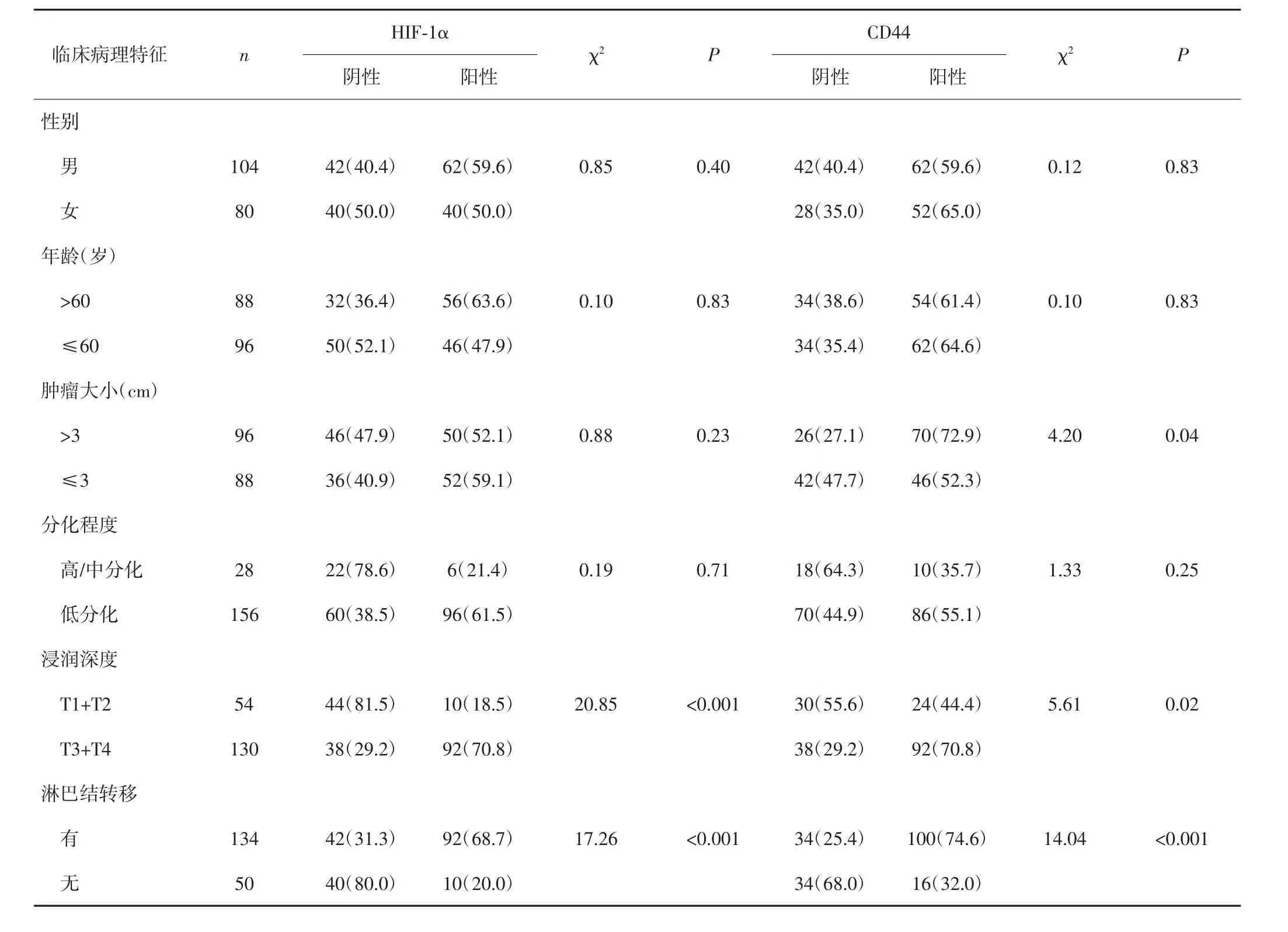
表1 胃癌组织中CD44和HIF-1α的表达与临床病理特征的关系[n(%)]
2.3 胃癌组织中CD44和HIF-1α表达与预后的关系
本组随访结果显示,5年总生存率为44.6%,中位生存时间为36个月(95%CI:26.69~45.30)。单因素分析显示,CD44阳性表达、HIF-1α阳性表达、浸润深度、淋巴结转移与预后密切相关(P<0.05),其中CD44阳性表达与阴性表达组术后5年生存率分别为37.9%和55.9%,差异有统计学意义(χ2=4.98,P=0.03)。HIF-1α阳性表达与阴性表达组术后5年生存率分别为35.3%和56.1%,差异亦有统计学意义(χ2=5.37,P=0.02)。根据CD44和HIF-1α蛋白表达情况进行亚组分析,Kaplan-Meier分析结果显示,CD44和HIF-1α双阴性表达组患者预后较其他亚组有明显优势(P<0.05),见表2、图2。多因素分析显示,CD44阳性表达、HIF-1α阳性表达、淋巴结转移和肿瘤浸润深度为胃癌的独立预后因素,见表3。
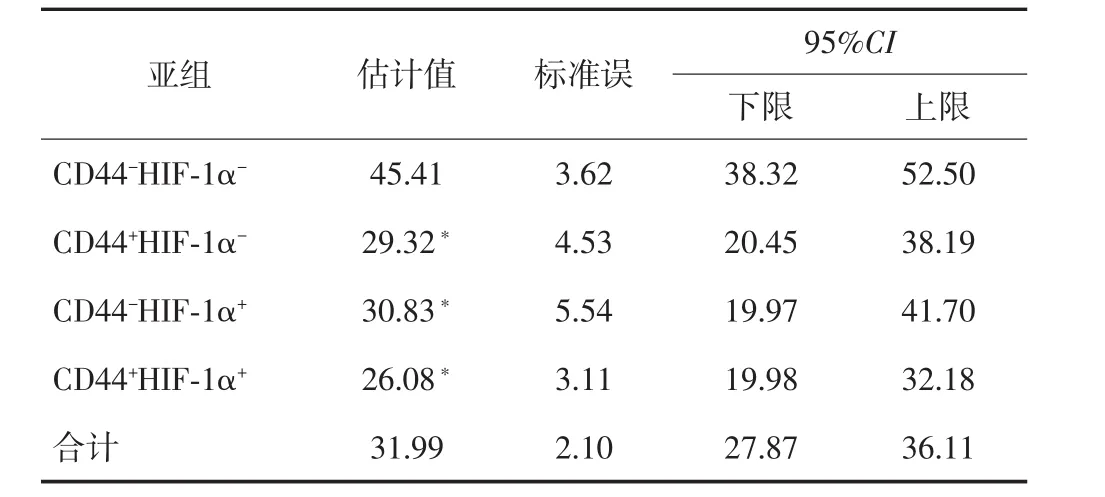
表2 不同CD44、HIF-1α表达情况亚组的生存比较
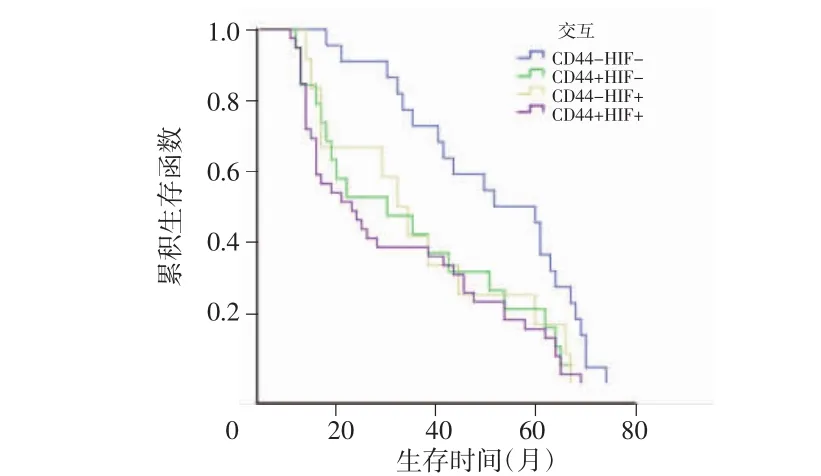
图2 不同CD44、HIF-1α表达情况亚组的生存曲线

表3 182例胃癌患者预后的多因素分析
3 讨论
在我国,胃癌的发病率高且预后较差,5年生存率仅为40%左右[6]。胃癌发病因素除与地域相关外,还与饮食、幽门螺杆菌感染及遗传因素相关,但具体的发病机制未明确[7]。当前的研究认为,肿瘤的微环境对肿瘤的发生、发展有重要作用,缺氧是实体肿瘤中普遍存在的环境特征[8]。缺氧可诱发肿瘤细胞基因的不稳定性并激活一些肿瘤生存因子,从而造成肿瘤对化疗和放疗耐受[9],促进转移[10-11]。因此,肿瘤缺氧微环境与肿瘤的发生、发展、预后和转移,以及治疗的效果密切相关,而对这一领域的研究已经成为寻找癌症新治疗方法的热点[12]。HIF-1α是组织缺氧诱导的关键转录因子,目前研究证实,HIF-1α调控的下游基因多达100多个,广泛参与肿瘤耐药性、异常增殖、抑制凋亡及侵袭和转移等多种信号通路[13]。吴友亮等[14]研究显示,胃癌组织细胞核表达HIF-1α与预后密切相关,其阳性表达组的患者生存期更短。一项综合了1 103例胃癌患者的Meta分析结论同样提示HIF-1α是胃癌的独立预后因子[15]。本研究结果亦显示HIF-1α在胃癌组织中高表达并与生存预后较差相关,与上述文献报道一致。
CD44分子属于细胞黏附分子家族,是由单基因编码的I类跨膜糖蛋白在多种细胞和组织表面广泛表达。CD44可以通过选择性剪切和翻译后修饰形成多种异构体,与细胞表面的多种配体相结合,在细胞的多种生理、病理过程中发挥重要作用[16]。CD44不但在多种肿瘤中高表达,还与肿瘤的生长、侵袭、转移以及造血干细胞的归巢等密切相关,而且作为多种肿瘤干细胞的标志物,CD44还是潜在的肿瘤治疗靶点[17-18]。CD44的生物学功能及其表达调控模式因肿瘤种类以及生长条件的不同而有所不同。有研究[19]发现乳腺癌细胞中,缺氧可通过HIF-1α调控CD44的表达,但在胃癌中缺氧调控CD44表达的机制尚未完全清楚。本研究显示胃癌组织中HIF-1α和CD44的阳性表达率分别为55.4%和62.4%,而在正常胃黏膜组织中几乎无表达,与文献报道[20]一致。进一步分析HIF-1α和CD44在胃癌组织中的表达,发现两者呈正相关(P=0.003),且两者的表达均与胃癌的浸润深度及淋巴结转移密切相关,多因素分析显示胃癌的浸润深度、淋巴结转移、HIF-1α和CD44阳性表达均为胃癌的独立预后因素。综上推测,胃癌组织中存在的缺氧微环境有可能通过HIF-1α诱导CD44表达并参与胃癌的恶性进程,但相关机制仍需进一步研究验证。
[1] Lim B,Kim JH,Kim M,et al.Genomic and epigenomic heterogeneity in molecular subtypes of gastric cancer[J].World J Gastroenterol,2016,22(3):1190-1201.
[2] Fu Z,Chen D,Cheng H,et al.Hypoxia-inducible factor-1α protects cervical carcinoma cells from apoptosis induced by radiation via modulation of vascular endothelial growth factor and p53 under hypoxia[J].Med Sci Monit,2015,21:318-325.
[3] Orian-Rousseau V,Sleeman J.CD44 is a multidomain signaling platform thatintegratesextracellularmatrixcueswithgrowthfactorandcytokine signals[J].Adv Cancer Res,2014,123:231-254.
[4] Seidal T,Balaton AJ,Battifora H.Interpretation and quantification of immunostains[J].Am J Surg Pathol,2001,25(9):1204-1207.
[5] Carcangiu ML,Chambers JT,Voynick IM,et al.Immunohistochemical evaluation of estrogen and progesterone receptor content in 183 patients with endometrial carcinoma.Part I:Clinical and histologic correlations[J].Am J Clin Pathol,1990,94(3):247-254.
[6] 邹文斌,李兆申.中国胃癌发病率及死亡率研究进展[J].中国实用内科杂志,2014,34(4):408-415.
[7] Petrovchich I,Ford JM.Genetic predisposition to gastric cancer[J]. Semin Oncol,2016,43(5):554-559.
[8] Martin JD,Fukumura D,Duda DG,et al.Reengineering the tumor microenvironment to alleviate hypoxia and overcome cancer heterogeneity[J].Cold Spring Harb Perspect Med,2016,6(12):a031195.
[9] Zhao Q,Li Y,Tan BB,et al.HIF-1α induces multidrug resistance in gastric cancer cells by inducing MiR-27a[J].PLoS One,2015,10(8):e0132746.
[10]Miyake S,Kitajima Y,Nakamura J,et al.HIF-1α is a crucial factor in the development of peritoneal dissemination via natural metastatic routes in scirrhous gastric cancer[J].Int J Oncol,2013,43(5):1431-1440.
[11]Zeng W,Wan R,Zheng Y,et al.Hypoxia,stem cells and bone tumor[J].Cancer Lett,2011,313(2):129-136.
[12]孙学英,姜宪,姜洪池.针对肿瘤缺氧微环境探寻新的治疗方法[J].世界华人消化杂志,2010,18(17):1741-1746.
[13]Carmeliet P,Dor Y,Herbert JM,et al.Role of HIF-1alpha in hypoxiamediated apoptosis,cell proliferation and tumour angiogenesis[J]. Nature,1998,394(6692):485-490.
[14]吴友亮,胡玲娜,郑成德,等.缺氧诱导因子1α在胃癌组织中的表达及其临床意义[J].中华医学杂志,2016,96(18):1418-1423.
[15]Lin S,Ma R,Zheng XY,et al.Meta-analysis of immunohistochemical expression of hypoxia inducible factor-1αas a prognostic role ingastric cancer[J].World J Gastroenterol,2014,20(4):1107-1113.
[16]Orian-Rousseau V.CD44 Acts as a signaling platform controlling tumor progression and metastasis[J].Front Immunol,2015,6:154.
[17]Moratha I,Hartmannb TN,Orian-Rousseau V.CD44:more than a mere stem cell marker[J].Int J Biochem Cell Biol,2016,81(Pt A):166-173.
[18]Lau WM,Teng E,Chong HS,et al.CD44v8-10 is a cancer-specific marker for gastric cancer stem cells[J].Cancer Res,2015,74(9):2630-2641.
[19]Krishnamachary B,Penet MF,Nimmagadda S,et al.Hypoxia regulates CD44 and its variantisoforms through HIF-1α in triple negative breast cancer[J].PLoS One,2012,7(8):e44078.
[20]谢建伟,黄昌明,郑朝辉,等.CD44v6与胃癌淋巴结转移及预后关系研究[J].福建医科大学学报,2015,49(3):145-148.
[2016-10-12收稿][2016-12-10修回][编辑 罗惠予]
Expression and clinical significance of both hypoxia-inducible factor(HIF)-1α and CD44 in gastric cancer
Huang Mingwei,Wu Liucheng,Qin Yuzhou,Li Zhao,Zhang Meng,Su Di,Chen Jiansi(Department of Gastrointestinal Surgical,Affiliated Tumor Hospital of Guangxi Medical University,Nanning 530021,P.R.China)
Chen Jiansi.E-mail:Chenjiansigx@163.com
ObjectiveTo investigate the relationship of expression of both HIF-1α and CD44 with clinicopathological features and outcomes in gastric cancer patients.MethodsTissue from 184 gastric cancer cases who underwent R0 resection were analyzed by immunohistochemistry to examine the expression of HIF-1α and CD44.Potential relationships of expression of HIF-1α and CD44 with clinicopathological features and prognosis were investigated.ResultsHIF-1α was expressed in 102/184(55.4%)of gastric cancer patients,and CD44 was expressed in 116/184(62.4%).HIF-1α and CD44 expression correlated with tumor invasion depth and lymphatic metastasis(P<0.05),and CD44 expression also correlated with tumor size(P<0.05).Spearman rank correlation analysis indicated that HIF-1α expression positively correlated with CD44 expression(r=0.71,P=0.003).Cox multivariate regression analysis indicated that tumor invasion depth,lymphatic metastasis,HIF-1α and CD44 expression were independent prognostic factors in gastric cancer patients(P<0.05).Conclusions HIF-1α expression positively correlated with CD44 expression in gastric cancer patients,and expression of both proteins was related to poor prognosis.
Gastrointestinal neoplasms;HIF-1α;CD44;Prognosis
R735.2
A
1674-5671(2016)06-05
10.3969/j.issn.1674-5671.2016.06.05
广西肿瘤学优势特色重点学科资助项目(024012002);广西壮族自治区卫生厅自筹课题资助项目(Z2014255)
陈建思。E-mail:chenjiansigx@163.com

