新型香草醛缩苯并咪唑Schiff碱的合成及其抑菌活性
邓 平, 吴 敏*
(1. 玉林师范学院 生命科学与技术学院,广西 玉林 537000;
2. 桂东南珍稀经济物种保护利用重点实验室培育基地,广西 玉林 537000)
·快递论文·
新型香草醛缩苯并咪唑Schiff碱的合成及其抑菌活性
邓平1,2, 吴敏1,2*
(1. 玉林师范学院 生命科学与技术学院,广西 玉林537000;
2. 桂东南珍稀经济物种保护利用重点实验室培育基地,广西 玉林537000)
摘要:以邻苯二胺和香草醛为原料,合成了3个新型的香草醛缩苯并咪唑Schiff碱(5a~5c),其结构经1H NMR和IR表征。用菌丝生长速率法研究了5a~5c对小麦赤霉病菌(F.gra),马铃薯干腐病菌(F.oxy),玉米弯苞叶斑病菌(C.sor),番茄早疫病菌(A.sol)和棉花枯萎病菌(F.oxy.s.v)的抑制活性。结果表明:香草醛缩2-甲基-5-氨基苯并咪唑(5c)对F.gra,F.oxy和C.sor的抑制活性高于多菌灵,其EC50值分别为19.76 mg·L-1, 24.94 mg·L-1和29.15 mg·L-1。
关键词:苯并咪唑; 希夫碱; 合成; 抑菌活性
香草醛(1)主要存在于香草和桉树叶中,是一种重要的天然产物,临床上常用于镇静、抗惊厥、抗癫痛和治疗神经性头疼等。1可与胺类反应生成相应的Schiff碱,该Schiff碱具有性能稳定、易于合成、水溶性和脂溶性好等特点,在抗菌[1-3]、抗癌[4]药物开发领域有良好的应用前景。
苯并咪唑类化合物具有良好的杀菌[5-8]、抗病毒[9-10]和抗肿瘤[11-14]等活性,并已有部分药物用于临床治疗[15-17]。但由于细菌耐药性不断增强,该类杀菌剂的杀菌效果大幅降低。
通过修饰、改进现有药物的结构(如苯并咪唑的2-, 5-和6-位取代[18]),获得高活性、低毒性的新型杀菌剂具有重要的实际意义。本文依据药物基团拼合原理[19],将1和苯并咪唑环通过亚氨基形成Schiff碱键合,设计并合成了3个新型的香草醛缩苯并咪唑Schiff碱(5a~5c, Scheme 1),其结构经1H NMR和IR表征。并测定了5a~5c对小麦赤霉病菌(F.gra),马铃薯干腐病菌(F.oxy),玉米弯苞叶斑病菌(C.sor),番茄早疫病菌(A.sol)和棉花枯萎病菌(F.oxy.s.v)的抑制活性。
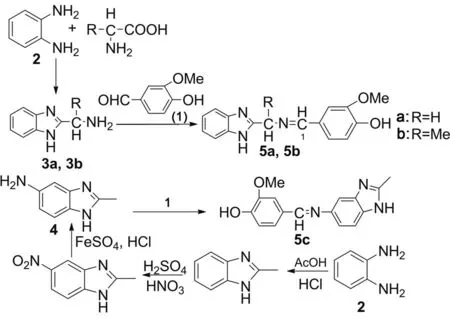
Scheme 1
1实验部分
1.1仪器与试剂
WRS-21B型熔点仪(温度未校正);Bruker Avance 400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Bruker EQUINOX-55型红外光谱仪(KBr压片)。
2-氨甲基苯并咪唑(3a)[20], 2-氨乙基苯并咪唑(3b)[21], 2-甲基苯并咪唑[21],2-甲基-5-硝基苯并咪唑[22]和2-甲基-5-氨基苯并咪唑(4)[22]按文献方法合成;多菌灵,50%可湿性粉剂,青岛阳光农药厂;F.gra,F.oxy,C.sor,A.sol,F.oxy.s.v,西北农林科技大学农药研究所生测室;其余所用试剂均为分析纯或化学纯。
1.2合成
(1) 香草醛缩2-烷氨基苯并咪唑(5a和5b)的合成(以5a为例)
在三口烧瓶中加入3a 1 g(6.8 mmol)和无水乙醇30 mL,加热搅拌使其完全溶解;缓慢滴加1 1.04 g(6.8 mmol)的无水乙醇(10 mL)溶液,滴毕,滴加冰乙酸两滴,回流反应约8 h(TLC跟踪)。减压浓缩至约10 mL,冷却至室温,析出墨绿色粉末,过滤,滤饼用乙酸乙酯洗涤,无水乙醇-乙酸乙酯重结晶得淡绿色粉末5a 0.82 g,收率43%, m.p.250 ℃;1H NMRδ: 3.83(s, 3H, OCH3), 4.81(s, 2H, NCH2), 6.91~7.59(m, 8H, ArH), 8.11(m, 1H, 1-H); IRν: 3 357, 3 257, 3 060, 2 958, 1 633, 1 599, 1 518, 1 461, 1 361, 1 271, 1 145, 1 025, 765 cm-1。
以3b替代3a,用类似的方法合成粉色粉末5b 0.76 g,收率41%, m.p.262~264 ℃;1H NMRδ: 1.65(d,J=6.6 Hz, 3H, CH3), 3.95(s, 3H, OCH3), 4.59(m, 1H, CHN), 7.09~8.11(m, 9H, ArH, 1-H); IRν: 3 360, 3 257, 3 060, 2 958, 1 630, 1 594, 1 518, 1 461, 1 361, 1 271, 1 145, 1 025, 765 cm-1。
(2) 香草醛缩2-甲基-5-氨基苯并咪唑(5c)的合成
在反应瓶中加入4 1.47 g(10 mmol)和无水乙醇30 mL,加热搅拌使其充分溶解;缓慢滴加1 1.55 g(10 mmol)的乙醇(15 mL)溶液,滴毕,滴加冰乙酸两滴,回流反应5 h(TLC跟踪)。减压除去大部分溶剂,冷却至室温,过滤,滤饼用冷乙醇洗涤,干燥,用乙醇重结晶得黄色结晶5c 1.51 g,产率57%, m.p.179~180 ℃;1H NMRδ: 2.45(s, 3H, CH3), 3.8(s, 3H, OCH3), 6.85~7.45(m, 6H, ArH), 8.48(s, 1H, NCH); IRν: 3 440, 1 621, 1 608, 1 580, 1 515, 1 460, 1 136 cm-1。
1.3抑菌活性测定[23-24]
菌种活化:将待测菌种在PDA培养基上连续培养3代,试验前3 d转接1次,于28 ℃恒温培养箱培养备用。
含药培养基的制备:在容量瓶中加入样品20.0 mg和二甲基亚砜5 mL,搅拌使其完全溶解;用二甲基亚砜定容,配制c为2 000, 1 000, 500, 250 mg·L-1的待测药液。以二甲基亚砜为空白组,多菌灵为对照组。在试管中加入待测药液1 mL,将融化的PDA培养基趁热倒至10 mL,迅速摇匀,倒入直径为9 cm的无菌培养皿中,制成薄厚均匀的平板[c终=(200, 100, 50, 25, 0 mg·L-1)],冷却备用。
接种:在接种工作台上,将活化后的供试菌种用直径为0.4 cm的打孔器在菌落边缘生长旺盛处打出菌丝饼,用接种针将菌丝饼移至含药培养皿中央,菌丝面朝下,每皿一块,加盖标记,每一处理重复3次,于28 ℃恒温培养箱中培养72 h。
数据处理:取出培养皿,用游标卡尺测量菌落直径,取3次试验的平均值d0,计算用药后菌落直径d(d=d0-0.4)。用SPSS统计软件分析得相关系数(r)和50%抑制浓度(EC50)。
2结果与讨论
2.1合成
按文献方法合成3a和3b时,反应时间较长(约72 h),条件苛刻(需使用高浓度无机酸)。为缩短反应时间和提高产率,可考虑采用微波辐射的方法合成。
5a~5c的合成反应较容易进行,其原因在于芳香醛中芳基的吸电子作用使氧负离子上的负电荷分散,使共振结构更有利于过渡态稳定而加快反应。实验过程中采用冰乙酸调节反应环境至微酸性。反应原料中有部分酮,增大了反应体系的空间效应,因此部分反应选用沸点较高的甲苯作溶剂,通过提高反应温度以克服空间阻力,促进反应进行。
2.2表征
由1H NMR分析可知,1的醛基氢的δ位于9.9, 5a~5c中该峰消失,但在δ8.1~8.5处出现H-C=N吸收峰。
由IR分析可知,5a~5c的C=N伸缩振动吸收峰位于1 590 cm-1~1 630 cm-1, 1 700 cm-1附近无C=O伸缩振动吸收峰,表明取代芳醛(酮)中的羰基与苯并咪唑的氨基已缩合脱去一分子水形成了C=N。
综上可见,5a~5c已成功合成。
2.2抑菌活性
表1为5a~5c对5种植物病菌的抑菌活性。
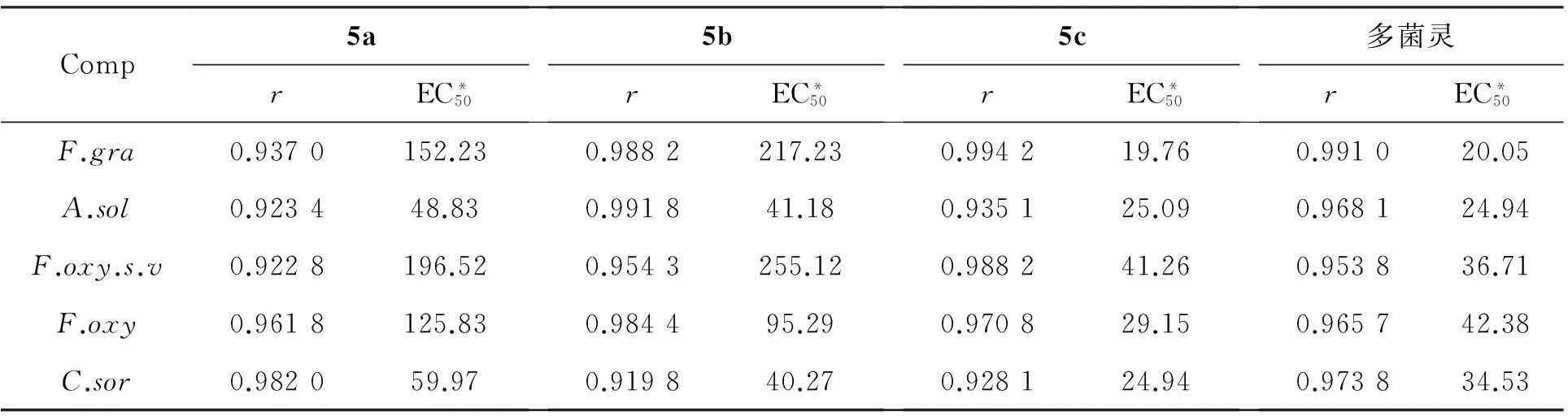
表1 5a~5c的抑菌活性
*mg·L-1;r为相关系数
由表1可见,5c对F.gra,F.oxy和C.sor的抑制活性高于多菌灵,其EC50值分别为19.76 mg·L-1, 24.94 mg·L-1和29.15 mg·L-1。
3结论
合成了3个新型的香草醛缩苯并咪唑Schiff碱(5a~5c)。用菌丝生长速率法研究了5a~5c对小麦赤霉病菌(F.gra),马铃薯干腐病菌(F.oxy),玉米弯苞叶斑病菌(C.sor),番茄早疫病菌(A.sol)和棉花枯萎病菌(F.oxy.s.v)的抑制活性。结果表明:5c对F.gra,F.oxy和C.sor的抑制活性高于多菌灵,其EC50值分别为19.76 mg·L-1,24.94 mg·L-1和29.15 mg·L-1,优于多菌灵。
参考文献
[1]江腊梅,王红燕. 邻香草醛-2-硫代呋喃羧酸腙及其金属配合物抑菌活性研究[J].山东医药工业,2000,19(3):11-12.
[2]李先春,赫荣安. 香草醛邻氨基苯甲酸席夫碱铜(Ⅱ)配合物的合成表征及抗癌活性研究[J].天然产物研究与开发,2000,11(6):33-35.
[3]Gehad G M, Carmen M S. Metal complexes of Schiff base derived from sulphametrole ando-vanilin synthesis,spectral,thermal characterization and biological activity[J].Spectrochim Acta Part A:Molecular and Biomolecular Spectroscopy,2007,66(4-5):949-958.
[4]陈琪,朱海亮,戚穗坚,等. 六氮杂大环希夫碱与银(Ⅰ)系列配合物的抗肿瘤活性研究[J].中山大学学报(自然科学版),2001,40(2):65-67.
[5]Bharti N, Shailendra G, Garza M T,etal. Synthesis,characterization and antiamoebic activity of benzimidazole derivatives and their vanadium and molybdenum complexes[J].Bioorg Med Chem Lett, 2002,12(6):869-871.
[6]Navarrete V G, Cedillo R, Hernandez C A,etal. Synthesis an antiparasitic activity of 2-(trifluomethyl) benzimidazole derivatives[J].Bioorg Med Chem Lett,2001,11(2):187-190.
[7]Valdez J, Cedillo R, Hernandez C,etal. Synthesis and antiparasitic activity of 1H-benzimidazole derivations [J].Bioorg Med Chem Lett,2002,12(16):2221-2224.
[8]Ramanatham V, Sanjay D V, Bobba V S K,etal. Synthesis,anti-bacterial,anti-asthmatic and anti-diabetic activities of novelN-substituted-2-(4-phenylethynyl-phenyl)-1H-benzimidazoles andN-substituted 2-[4-(4,4-dimethyl-thiochroman-6-yl-ethynyl)-phenyl]-1H-benzimidazoles[J].Eur J Med Chem,2008,43(5):986-995.
[9]Aagela R, Alba C, Erik D C,etal. Synthesis and anti-HIV activity of 1-(2,6-difluorophenyl)-1H, 3H-thiazolo [3,4-a]benzimidezole structurally related 1,2-substituted benzimidazoles[J].ⅡFarmaco,2002,57(10):819-823.
[10]Andries K, Moeremans M, Gevers T. Substituted benzimidazoles with nanomolar activity against respiratory syncytial virus[J].Antiviral Res,2003,60(3):209-219.
[11]LaBarbera D V, Skibo E B. Synthesis of imidazo[1,5,4-de]quinoxaline-9-ones,benzimidazole analogues of pyrrolo imino-quinone marine natural products[J].Bioorg Med Chem,2005,13:387-395.
[12]Mostafa M R, Mohamed A O, Tokuda H,etal. Synthesis and inhibitory activity of new benzimidazole derivatives against Burkitt’s lymphoma promotion[J].Bioorg Med Chem,2007,15(19):6489-6496.
[13]Mostafa M R, Mohamed A O, Abdel-Momen M E K,etal. Synthesis and antitumor activity of 1-substituted- 2-methyl-5-nitrobenzimidazoles[J].Bioorg Med Chem,2006,14(21):7324-7332.
[14]Kristina S, Marijeta K, Katja E,etal. Synthesis,antiviral and antitumor activity of 2-substituted-5-amidino-benzimidazoles[J].Bioorg Med Chem,2007,15(13):4419-4426.
[15]田敏,王陆瑶,陈邦,等. 芳香基苯并咪唑衍生物的合成、表征及抑菌活性研究[J].化学通报,2005,68(9):709-713.
[16]王敏,张一宾. 聚咪唑基杀菌剂的研究开发进展[J].现代农药,2003,2(1):36-38.
[17]高学军,李庆章. 苯并咪唑氨基甲酸酯类抗蠕虫药物作用机理研究进展[J].东北农业大学学报,2004,35(4):492-495.
[18]宋琳,谢毓元,王惠贞. 苯并咪唑Schiff碱的合成及其杀菌活性[J].中国药物化学杂志,2000,10(2):92-93.
[19]仉文升,李安良. 药物化学[M].北京:高等教育出版社,1999.
[20]Pascaly M, Duda M, Schweppe F,etal. The systematic inuence of tripodal ligands on the catechol cleaving activity of iron(III) containing model compounds for catechol 1,2-dioxygenases[J].J Chem Soc Dalton Trans,2001:828-837.
[21]Pool W O, Harwood H J, Ralston A W. 2-Alkylbenzimidazoles as derivatives for the identification of aliphatic acids[J].J Am Chem Soc,1937,59(1):178-179.
[22]Bapat D G, Shirsat M V. Chemotherapy of bacterial infections:Part XV-synthesis of some new 2-alkyl-,2- aryl-2-pyridyl-5(6)-aminobenzimidazoles[J].Indian J Chem,1965,3(2):81-83.
[23]周德庆. 微生物学教程[M].北京:高等教育出版社,1992.
[24]沈萍,范秀荣,李广武. 微生物学实验[M].北京:高等教育出版社,1999.
《合成化学》入网超星公司学术期刊“域出版”
为进一步方便读者,紧跟“互联网+”潮流,《合成化学》于2015年6月起正式加入超星公司学术期刊“域出版”。“域出版”是借助移动出版技术,通过“以智带栏”的模式,主要依托移动智能终端的在线学术交流互动平台。该平台的APP(支持Android和ios)将于7月底上线,欢迎广大读者下载使用。
《合成化学》编辑部
Synthesis and Antibacterial Activities of Novel Vanillin
Benzimidazole Schiff Bases
DENG Ping1,2, WU Min1,2*
(1. College of Life Science & Technology, Yulin Normal University, Yulin 537000, China; 2. Cultivation Base for
Key Laboratory of Conservation and Utilization of Rare and Economic Species at Southeast, Yulin 537000, China)
Abstract:Three novel vanillin benzimidazole Schiff bases(5a~5c) were synthesized, usingo-phenylenediamine and vanillin as raw materials. The structures were characterized by1H NMR and IR. The antibacterial activities of 5a~5c againstFusariumoxysporium(F.oxy),Alternariasolani(A.sol),Fusariumgraminearum(F.gra),Cercosporasorghi(C.sor) andFusauriumoxysporiumf.sp.vasinfectum(F.oxy) were investigated by mycelial growth rate method. The results indicated that 5c exhibited better antimicrobial activities againstF.gra,F.oxandC.sorthan Carbendazim with EC50of 19.76 mg·L-1, 24.94 mg·L-1and 29.15 mg·L-1.
Keywords:benzimidazole; Schiff base; synthesis; antibacterial activity
通讯作者:吴敏,女,博士,讲师, E-mail: yier253160@126.com
作者简介:邓平(1983-),男,汉族,新疆阿克苏人,讲师,主要从事天然产物化学研究。
基金项目:广西高校科学技术研究项目[KY2015LX304]; 玉林师范学院科学研究项目[2014YJYB07]
收稿日期:2015-07-01;
修订日期:2015-12-28
中图分类号:O626.23
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.02.15260

