表面高巯基功能化介孔材料的制备及对Hg2+的吸附性能
宋 波, 李云萍, 王 醇, 王 安
(1. 四川大学 建筑与环境学院,四川 成都 610065; 2. 中国科学院 成都生物研究所,四川 成都 610041)
·快递论文·
表面高巯基功能化介孔材料的制备及对Hg2+的吸附性能
宋波1,2, 李云萍2, 王醇2, 王安1*
(1. 四川大学 建筑与环境学院,四川 成都610065; 2. 中国科学院 成都生物研究所,四川 成都610041)
摘要:在酸性条件下,以三嵌段非离子表面活性剂P123为模板剂,四氧基硅烷(TEOS)预水解后与3-巯基丙基三乙基硅(MPTES)共聚,合成了具有不同巯基官能团比例x[n(MPTES)/n(TEOS+MPTES)]的功能化介孔材料(SBA-SH-x),其结构和性能经FT-IR,元素分析,SEM, TEM,小角X-ray和N2吸附-脱附表征。结果表明:x<10%, SBA-SH-x为六方p6mm介观结构;10%
关键词:巯基; 功能化介孔材料; 制备; 汞吸附性
随着电池、涂料和造纸业的迅速发展,汞污染对生态环境和人类健康的危害日益严重。硫对Hg2+有很强的亲和性,因此学者将巯基引入多孔材料(如活性炭[1],黏土[2],硅[3]等),用于吸附Hg2+。然而,由于这些材料的孔径较小,孔型不均匀,导致官能团不能得到充分利用[4]。
硅基介孔材料具有孔道均匀,比表面积大和易修饰等优点,是优质的重金属吸附材料。经巯基功能化的硅基介孔材料,如HMS[5],MCM-41[6],SBA-15[7]和MSU[8-9]等均有较好的Hg2+吸附性能,其中SBA型介孔材料因孔径较大而吸附效率最高。目前,不同晶体结构,如六方[10]、立方[11]等晶型有机功能化介孔材料的制备方法已有较多报道。然而,制备表面官能化的有序介孔材料,其官能团掺入量需低于10%[12]这一特点,极大地限制了功能材料对Hg2+的吸附性能。
为提高官能团负载量,提升功能材料吸附性能,本文在酸性条件下,以三嵌段非离子表面活性剂P123为模板剂,四氧基硅烷(TEOS)预水解后与3-巯基丙基三乙基硅(MPTES)共聚,合成了具有不同巯基官能团比例x[n(MPTES)/n(TEOS+MPTES)]的功能化介孔材料(SBA-SH-x),其结构和性能经FT-IR,元素分析,SEM, TEM,小角X-ray和N2吸附-脱附表征。
1实验部分
1.1仪器与试剂
PHS-3C型酸度计;Spectrum 100型傅立叶变换红外光谱仪(KBr压片);Euro EA 3000型元素分析仪;SSA-4200孔隙比表面积分析仪(样品于150 ℃预干燥2 h,比孔容和比表面积用多点BTE法计算,孔径和孔径分布用BJH法计算);JSM-7500F型场发射扫描电子显微镜;Tecnai G2 F20 S-TWIN型场发射透射电子显微镜;PANalytical X′Pert3Powder型X-射线衍射仪(CuKα射线,管电压40 kV,管电流40 mA, 2θ=0.5~5°);SPECTRO ARCOS型电感耦合等离子体发射光谱仪。
所用试剂均为分析纯;实验用水为去离子水。
1.2SBA-SH-x的制备[7,13,15]
在锥形瓶中加入P123 3 g,去离子水94 mL和12 mol·L-1盐酸15 mL,于室温搅拌至清澈得溶液A(约3 h)。将溶液A于40 ℃(浴温)加热1 h;滴加TEOS 6.15 mL(27.75 mmol),滴毕,剧烈搅拌下于40 ℃反应45 min。用注射器于4 min内缓慢注入MPTES 1.18 mL(4.88 mmol),反应23 h。反应液转移至高压反应釜,于100 ℃晶化30 h。抽滤,滤饼用去离子水洗涤至中性后用95%乙醇(3×10 mL)洗涤,于室温干燥24 h得白色固体M。
在圆底烧瓶中加入M 2 g和95%乙醇150 mL,于60 ℃洗涤6 h。过滤,滤饼于室温干燥12 h,用索氏提取器在95%乙醇中回流24 h,除去P123,于100 ℃干燥2 h得白色固体SBA-SH-15 1.7 g。
用类似的方法制得白色固体SBA-SH-0, SBA-SH-5, SBA-SH-10, SBA-SH-20和SBA-SH-30。
1.3Hg2+吸附性能测定
研究SBA-SH-0对Hg2+的吸附性能发现,材料未经巯基改性,对Hg2+的吸附能力可以忽略,因此研究SBA-SH-x对Hg2+的吸附能力是有意义的。
采用静态分批独立吸附实验绘制等温吸附曲线。分别配制SBA-SH-5~SBA-SH-30浓度为50~700 mg·L-1, 100~900 mg·L-1, 100~1 100 mg·L-1, 100~1 300 mg·L-1和200~1 800 mg·L-1。
在塑料管中加入SBA-SH-x 20 mg和不同c(Hg2+)0的HgCl2溶液10 mL(pH 5.5),于20 ℃剧烈搅拌至吸附平衡(约5.5 h)。过滤,滤液经去离子水稀释5倍后用ICP-OES在波长195 nm处测定c(Hg2+),计算Hg2+吸附值qe[qe=c(Hg2+)0-c(Hg2+)/401.2]。
2结果与讨论
2.1表征
(1) FT-IR
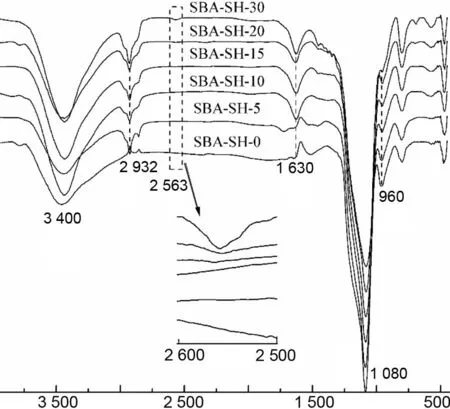
图1为SBA-SH-0~SBA-SH-30的FT-IR谱图。
由图1可见,SBA-SH-5~SBA-SH-30在3 400 cm-1附近均有一个较宽的Si-OH伸缩振动吸收峰,1 630 cm-1处为O-H弯曲振动吸收峰,1 080 cm-1处为Si-O-Si不对称伸缩振动吸收峰,960 cm-1为Si-OH弯曲振动吸收峰,2 932 cm-1附近有弱吸收峰,可能归属为残余P123或MPTES中C-H伸缩和弯曲振动吸收峰。此外,值得注意的是,2 563 cm-1附近出现的S-H伸缩振动吸收峰[14],其吸收峰随着巯基含量增加而逐渐增强,表明巯基已顺利导入。SBA-SH-5和SBA-SH-10的S-H伸缩振动吸收峰相对较弱,可能是由于MPTES含量过低和S-H吸收峰本身较弱所致。
ν/cm-1

Comp元素分析a/%CHSQs/mmol·g-1实测b理论cMPTES聚合度/%SBA-SH-58.183.041.880.591.02457.6SBA-SH-109.983.213.030.941.83351.3SBA-SH-1511.902.935.321.662.09079.4SBA-SH-2014.933.367.202.252.63985.1SBA-SH-3018.804.039.653.013.14495.7
a测量值;bQS实测=wS×103/MS;cQS理论=nMPTES×103/[(nMPTES)+ (nTEOS)×MSiO2+nMPTES×MC3H7S];dMPTES聚合度=QS实测/QS理论
(2) 元素分析和MPTES聚合度
表1为SBA-SH-5~SBA-SH-30的元素分析结果。由表1可见,MPTES聚合度随着S含量增加而增加,SBA-SH-5~SBA-SH-30的C/S质量比的实测值分别为4.35, 3.29, 2.24, 2.07和1.95,均高于理论值(1.12),这可能是由于TEOS未完全水解或P123未除尽所致。由表1还可见,MPTES聚合度分别为57.6%, 51.3%, 79.4%, 85.1%和95.7%,表明MPTES聚合度与其用量有关。
(3) SEM与TEM
图2为SBA-SH-0~SBA-SH-15的SEM和SBA-SH-10, SBA-SH-15的TEM照片。由图2(A)~图2(D)可见,SBA-SH-0~SBA-SH-10的微观形貌相似,粒径均匀;SBA-SH-15的微观结构由棒状变为块状。由图2(E)和图2(F)可见,SBA-SH-10为典型的二维六方p6mm介孔相,而SBA-SH-15%与Xiao等[11]报道的FDU-5三维立方Ia3d介孔相相同。此外,SBA-SH-10的孔径明显大于SBA-SH-15; SBA-SH-0, SBA-SH-5和SBA-SH-10则均为规则管状孔道。
(4) N2吸附-脱附
表2,图3(A)和图3(B)分别为SBA-SH-x的结构参数,N2吸附-脱附等温曲线和孔径分布。由图3(A)可见,SBA-SH-0, SBA-SH-5和SBA-SH-10为H1型滞后环,其孔道为均匀圆筒状;SBA-SH-15为H2型滞后环,其孔道结构为墨水瓶状或网状;SBA-SH-20和SBA-SH-30为H4型滞后环,其孔道结构为狭缝状。由图3(B)可见, 0

图 2 SBA-SH-x的SEM(A~D)和TEM照片(E~F)*
(5) 小角X-ray
图4为SBA-SH-x的小角X-ray衍射图。
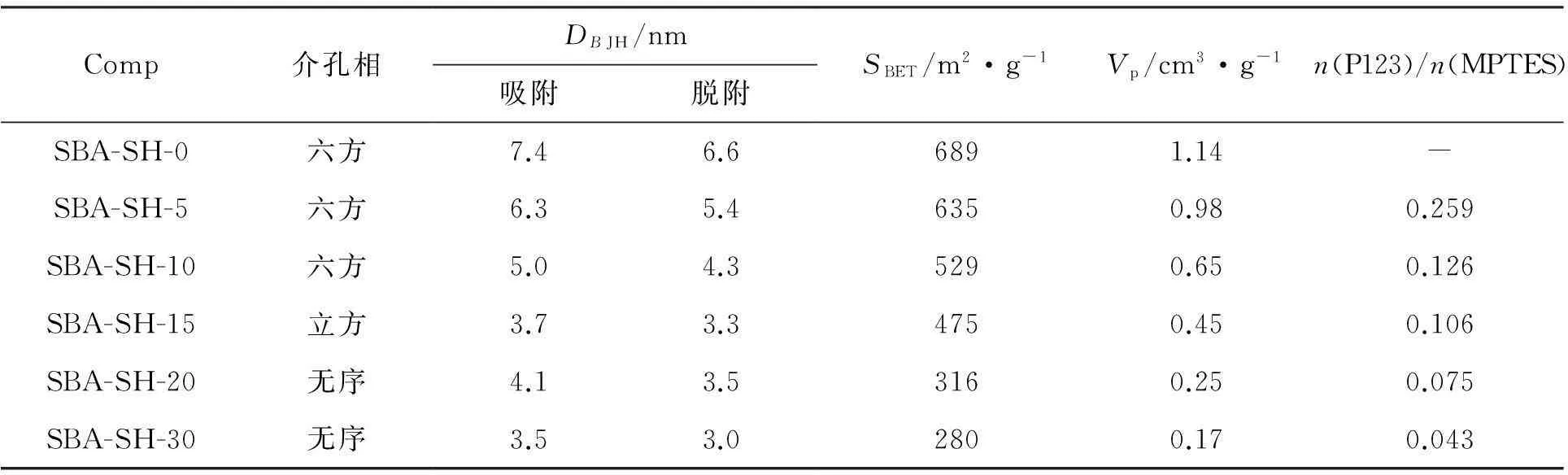
表2 SBA-SH-x结构参数

P/P0

D/nm
由图4可见,SBA-SH-0和SBA-SH-5均有一个强衍射峰(100)和2个弱晶面衍射峰(110和200);SBA-SH-10有一个强衍射峰(100)和弱晶面衍射峰(200),结合TEM分析可知,SBA-SH-0~SBA-SH-10为二维六方相。SBA-SH-15有一个强衍射峰(211)和弱晶面衍射峰(220)[10],结合TEM分析可知,SBA-SH-15为三维立方相,其空间构型为Ia3d;SBA-SH-20和SBA-SH-30基本无衍射峰,说明二者均为基本无序。由图4还可见,随着巯基含量增加,主峰强度逐渐减弱,主峰宽度不断增加,说明SBA-SH-x的有序性逐渐变弱。因此,为制得高度有序的Ia3d型巯基功能化介孔材料,需严格控制n(P123)/n(MPTES)(约0.106)[16],pH[15]和晶化时间(30 h)。

2θ/(°)
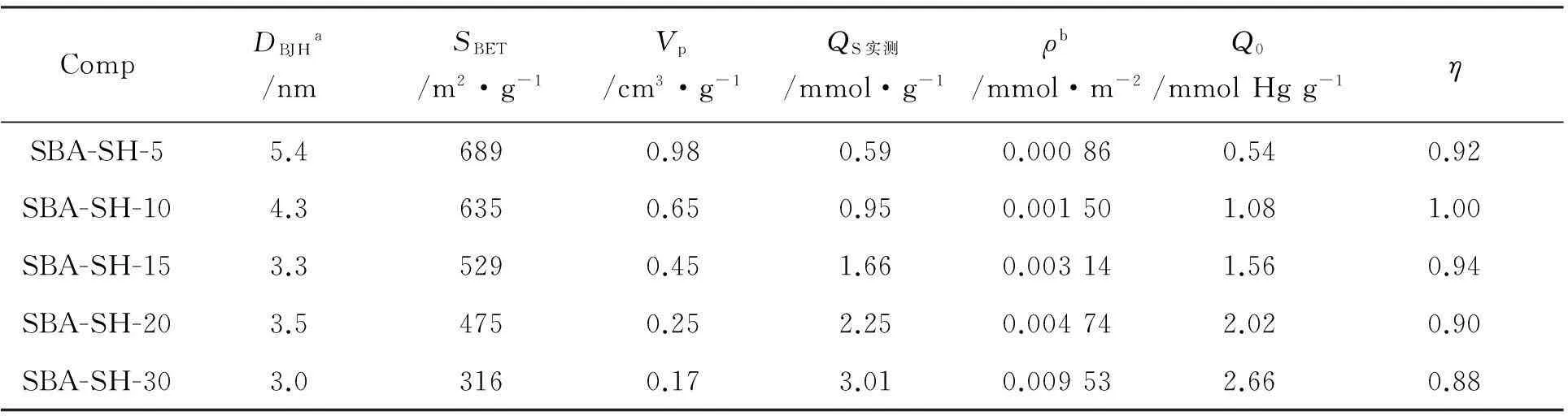
CompDBJHa/nmSBET/m2·g-1Vp/cm3·g-1QS实测/mmol·g-1ρb/mmol·m-2Q0/mmolHgg-1ηSBA-SH-55.46890.980.590.000860.540.92SBA-SH-104.36350.650.950.001501.081.00SBA-SH-153.35290.451.660.003141.560.94SBA-SH-203.54750.252.250.004742.020.90SBA-SH-303.03160.173.010.009532.660.88
a脱附孔直径;b巯基密度(ρ)=QS实测/SBET;c巯基可利用率(η)=Q0/QS实测
2.2Hg2+吸附性能
Ce/mg·L-1
Ce/mg Hg·L-1
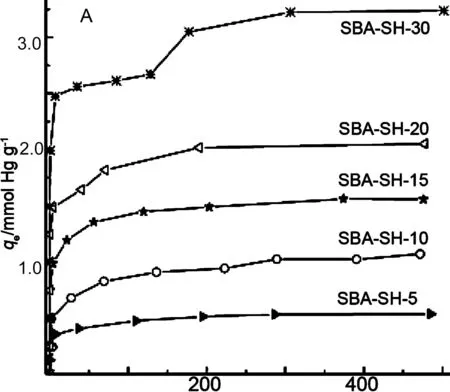
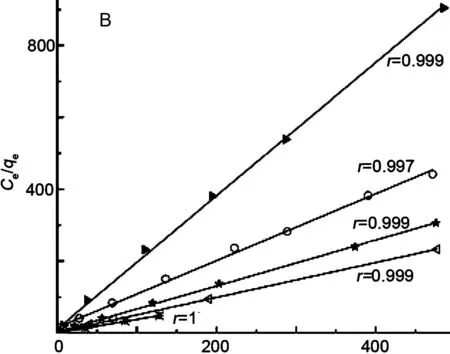
图5(A)为SBA-SH-x对Hg2+的吸附等温线。由图5可见,当Ce=128 mg·L-1时,SBA-SH-30吸附量急剧上升,说明其吸附方式由单分子层吸附变为多分子层吸附[17-18]。采用Langmuir线性方程拟合吸附数据得到最大Hg2+吸附量Q0[图5(B)]。
表3为SBA-SH-x的Hg2+吸附性能。由表3可见,η随ρ增加而呈下降趋势。SBA-SH-5~SBA-SH-15的η均大于0.92,说明其巯基大多分布于孔道表面或颗粒表面[15],利于吸附Hg2+。当x>20时,η分别降低至0.90和0.88,并开始出现多分子层吸附现象。其可能原因在于:(1)有机官能团增加,SBA-SH-x的孔径、比表面积及孔容积均下降,结构有序性降低,孔道结构变得不均匀,导致官能团的可接近性降低;(2)在有限的孔道内表面,有机官能团过多,会出现部分有机官能团被包埋于硅骨架中的现象,使吸附能力降低[15,19-20]。
3结论
合成了一系列巯基功能化介孔材料。SBA-SH-x在水溶液中吸附Hg2+的结果表明:SBA-SH-10和SBA-SH-15的Hg2+吸附性能较好。该结果对于设计并合成高效的功能化介孔材料具有一定指导意义。
参考文献
[1]Zhu J Z, Deng B L, Yang J,etal. Modifying activated carbon with hybrid ligands for enhancing aqueous mercury removal[J].Carbon,2009, 47(8):2014-2025.
[2]Zhang X Y, Wang Q C, Zhang S Q,etal. Stabilization/solidification (S/S) of mercury-contaminated hazardous wastes using thiol-functionalized zeolite and Portland cement[J].J Hazard Mater,2009,168(2-3):1575-1580.
[3]Wang W J, Chen M L, Chen X W,etal. Thiol-rich polyhedral oligomeric silsesquioxane as a novel adsorbent for mercury adsorption and speciation[J].Chem Eng J,2014,242:62-68.
[4]Mercier L, Pinnavaia T J. A functionalized porous clay heterostructure for heavy metal ion (Hg2+) trappiing[J].Microporous Mesoporous Mater,1998,20(1-3):101-106.
[5]Brown J, Mercier L, Pinnavaia T J. Selective adsorption of Hg2+by thiol-functionalized nanoporous silica[J].Chem Commun,1999,(1):69-70.
[6]Feng X, Fryxell G E, Wang L Q,etal. Functionalized monolayers on ordered mesoporous supports[J].Science,1997,276:923-926.
[7]Aguado J, Arsuaga J M, Arencibia A. Adsorption of aqueous mercury(II) on propylthiol-functionalized mesoporous silica obtained by cocondensationEng[J].Ind Eng Chem Res,2005,44(10):3665-3671.
[8]Brown J, Richer R, Mercier L. One-step synthesis of high capacity mesoporous Hg2+adsorbents by non-ionic surfactant assembly[J].Microporous Mesoporous Mater,2000,37(1-2):41-48.
[9]Bibby A, Mercier L. Mercury(II) ion adsorption behavior in thiol-functionalized mesoporous silica microspheres[J].Chem Mater,2002,14(4):1591-1597.
[10]Lee B, Kim Y, Lee H,etal. Synthesis of functionalized porous silicas via templating method as heavy metal ion adsorbents:The introduction of surface hydrophilicity onto the surface of adsorbents[J].Microporous Mesoporous Mater,2001,50(1):77-90.
[11]Xiao Y L, Tian B Z, Yu C Z,etal. Room-temperature synthesis in acidic media of large-pore three-dimensional bicontinuous mesoporous silica withIa3dsymmetry[J].Angew Chem Int Ed,2002,41(20):3876-3878.
[12]Hodgkins R P, Garcia-Bennett A E, Wright P A. Structure and morphology of propylthiol-functionalised mesoporous silicas templated by non-ionic triblock copolymers[J].Microporous Mesoporous Mater,2005,79(1-3):241-252.
[13]Margolese D, Melero J A, Christiansen S C,etal. Direct syntheses of ordered SBA-15 mesoporous silica containing sulfonic acid groups[J].Chem Mater,2000,12(8):2448-2459.
[14]Krupadama R J, Nesterovb E E, Spivakb D A. Highly selective detection of oil spill polycyclic aromatichydrocarbons using molecularly imprinted polymers for marineecosystems[J].J Hazard Mater,2014,274:1-7.
[15]Aguado J, Arsuaga J M, Arencibia A. Influence of synthesis conditions on mercury adsorption capacity of propylthiol functionalized SBA-15 obtained by co-condensation[J].Microporous Mesoporous Mater,2008,109(1-3):513-524.
[16]Atluri R, Sakamoto Y, Garcia-Bennett A E. Co-structure directing agent induced phase transformation of mesoporous materials[J].Langmuir,2009,25(5):3189-3195.
[17]Olafadehan O A, Susu A A. Modeling and simulation of liquid-phase ternary adsorption in activated carbon column[J].Ind Eng Chem Res, 2004,43(25):8107-8116.
[18]Brunauer S, Deming L S, Deming W E,etal. On a theory of Van der Waals adsorption of gases[J].J Am Chem Soc,1940,62(7):1723-1732.
[19]Mercier L, Pinnavaia T J. Heavy metal ion adsorbents formed by the grafting of a thiol functionality to mesoporous silica molecular sieves:Factors affecting Hg(II) uptake[J].Environ Sci Technol,1998,32(18):2749-2754.
[20]Lim M H, Blanford C F, Stein A. Synthesis of ordered microporous silicates with organosulfur surface groups and Their applications as solid acid catalysts[J].Chem Mater,1998,10(2):467-470.
Preparation and Hg2+Adsorption Properties of
Thiol Functionalized Mesoporous Materials
SONG Bo1,2, LI Yun-ping2,WANG Chun2,WANG An1*
(1. College of Architecture and Environment, Sichuan University, Chengdu 610065, China;
2. Chengdu Institute of Biology, Chinese Academy of Sciences, Chengdu 610041, China)
Abstract:A series of thiol functionalized mesoporous materials(SBA-SH-x) with different thiol ratio[x=n(MPTES)/n(TEOS+MPTES)] were prepared by copolymerization of hydrolyzed TEOS and MPTES in acid condition, using tri-block non-ionic surfactant P123 as template. The structures and properties were characterized by FT-IR, elemental analysis, SEM, TEM, small angle X-ray and N2adsorption-desorption. The results showed that x<10%, SBA-SH-x were hexagonalp6mmmesophase; 10%
Keywords:thiol; functionalized mesoporous material; preparation; mercury adsorption property
通信作者:王安,副教授, E-mail: wangchun@cib.ac.cn
作者简介:宋波(1990-),男,汉族,四川遂宁人,硕士研究生,主要从事介孔材料的合成及其吸附性能的研究。 E-mail: songboseven@hotmail.com
基金项目:国家自然科学基金资助项目(21442012); 四川省苗子工程资助项目(2015MZGC001)
收稿日期:2015-03-20;
修订日期:2015-12-01
中图分类号:O611.4; O647.3
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.02.15078

