黄芪、丹参酮ⅡA和5-氟尿嘧啶单用及联合应用对人宫颈癌HeLa细胞的体外作用研究
田亚萍,王园园,迟宝荣
·论著·
·中医·中西医结合研究·
黄芪、丹参酮ⅡA和5-氟尿嘧啶单用及联合应用对人宫颈癌HeLa细胞的体外作用研究
田亚萍,王园园,迟宝荣
目的 检测黄芪、丹参酮ⅡA、5-氟尿嘧啶(5-FU)单用及联合应用对人宫颈癌HeLa细胞的抑制作用及其抗肿瘤机制,探讨黄芪、丹参酮ⅡA在宫颈癌治疗中的应用价值。方法 2014年3—12月选取人宫颈癌HeLa细胞,分为6组,包括对照组、黄芪组、丹参酮ⅡA组、5-FU组、黄芪+丹参酮ⅡA组、黄芪+丹参酮ⅡA+5-FU组,每组分别加入不同浓度的药物进行处理。应用四甲基偶氮唑盐比色法(MTT法)和流式细胞术检测人宫颈癌HeLa细胞生长抑制率及细胞凋亡率,检测氧化应激因子丙二醛(MDA)水平及超氧化物歧化酶(SOD)、谷胱甘肽(GSH)活力。结果 4.0 g/ml黄芪、8.0 μg/ml丹参酮ⅡA、50.0 mg/L 5-FU、4.0 g/ml黄芪+8.0 μg/ml丹参酮ⅡA、4.0 g/ml黄芪+8.0 μg/ml丹参酮ⅡA+50.0 mg/L 5-FU人宫颈癌HeLa细胞生长抑制率最高,同组培养72 h后人宫颈癌HeLa细胞生长抑制率最高(P<0.05)。培养72 h后,黄芪+丹参酮ⅡA组人宫颈癌HeLa细胞生长抑制率较黄芪组、丹参酮ⅡA组、5-FU组升高(P<0.05);黄芪+丹参酮ⅡA+5-FU组人宫颈癌HeLa细胞生长抑制率较黄芪组、丹参酮ⅡA组、5-FU组、黄芪+丹参酮ⅡA组升高(P<0.05)。黄芪+丹参酮ⅡA+5-FU组人宫颈癌HeLa细胞凋亡率较黄芪组、丹参酮ⅡA组、5-FU组、黄芪+丹参酮ⅡA组升高(P<0.05)。不同组MDA水平及GSH活力比较,差异无统计学意义(P>0.05);不同组SOD活力比较,差异有统计学意义(P<0.05);其中黄芪组、丹参酮ⅡA组、5-FU组、黄芪+丹参酮ⅡA组、黄芪+丹参酮ⅡA+5-FU组SOD活力较对照组降低(P<0.05)。结论 黄芪、丹参酮ⅡA、5-FU可诱导人宫颈癌HeLa细胞发生凋亡,联用后可增加抗肿瘤活性,具有临床应用价值。
宫颈肿瘤;黄芪;丹参酮;氟尿嘧啶;HeLa细胞;体外研究
田亚萍,王园园,迟宝荣.黄芪、丹参酮ⅡA和5-氟尿嘧啶单用及联合应用对人宫颈癌HeLa细胞的体外作用研究[J].中国全科医学,2016,19(9):1081-1085.[www.chinagp.net]
Tian YP,Wang YY,Chi BR.In vitro effect of astragalus,tanshinoneⅡA,5-fluorouracil alone or their combined use on human cervical carcinoma HeLa cells[J].Chinese General Practice,2016,19(9):1081-1085.
宫颈癌是引起妇女死亡的主要原因之一。中药联合化疗药物在一定程度上减少化疗药物毒副作用的产生,提高肿瘤细胞对化疗药物的敏感性,改善患者生活质量[1]。临床用于各类中、晚期癌症患者的扶正固本方剂对提高患者近期、远期疗效均有益处[2-3]。黄芪(astragalus)具有健脾补中、升阳举陷、益卫固表、利尿等功效,在体内和体外均对各类癌症具有较好的抑制作用[3]。从丹参中提取的脂溶性单体——丹参酮ⅡA (tanshione ⅡA)有抑制肿瘤细胞增殖、诱导其分化和凋亡的作用[4-5]。黄芪和丹参酮ⅡA对人宫颈癌HeLa细胞的抑制作用已有研究报道[6-7],但二者联合应用对人宫颈癌HeLa细胞的作用及机制研究尚未见报道。另外,黄芪丹参复方注射液具有清除氧自由基、减轻氧化应激对机体细胞损伤的作用[8],此种药物活性能否保护肿瘤细胞未见报道。因而,本研究于2014年3—12月研究黄芪、丹参酮ⅡA、5-氟尿嘧啶(5-FU)单用及联合应用对人宫颈癌HeLa细胞的抑制作用及其抗肿瘤机制,为其临床应用提供实验依据。
1 材料与方法
1.1 主要试剂 黄芪注射液为正大制药集团产品(每毫升相当于生药黄芪 2 g,批号1305051)。丹参酮ⅡA为中国药品生物制品检定所的标准品(批号1401026),溶解于适量的二甲基亚砜(DMSO),终浓度为0.1%。5-FU购自上海旭东海普药业有限公司(批号130801)。胎牛血清(GIBCO公司),RPMI-1640培养液(GIBCO公司),胰蛋白酶(AMRESCO公司)。3-(4,5-二甲基噻唑-2)-2(MTT)试剂盒(武汉华美生物工程有限公司),丙二醛(MDA)试剂盒(上海碧云天生物技术有限公司),超氧化物歧化酶(SOD)、谷胱甘肽(GSH)试剂盒(南京建成生物科技有限公司)。
1.2 仪器与器材 荧光显微镜、流式细胞仪(Olympus),5%二氧化碳(CO2)培养箱(Thermo Electron Corporation),恒温培养箱(诺基仪器),生物安全柜〔力新仪器(上海)有限公司〕,倒置相差显微镜(Olympus),Mode1680型酶标仪(美国Bio-Rad)。
1.3 研究方法
1.3.1 细胞培养 人宫颈癌HeLa细胞购于中国医学科学院基础医学研究所细胞中心,置于含10%胎牛血清及青霉素、链霉素各100 U/ml的DMEM培养液中,37 ℃、5%CO2培养箱中培养。
1.3.2 实验分组 对照组不加入任何药物;黄芪组:分别加入不同浓度黄芪注射液,含生药0.1、0.5、1.0、2.0、4.0 g/ml;丹参酮ⅡA组:分别加入不同浓度丹参酮ⅡA,终浓度0.5、1.0、2.0、4.0、8.0 μg/ml;5-FU组:分别加入不同浓度5-FU,终浓度3.5、7.0、12.5、25.0、50.0 mg/L;黄芪+丹参酮ⅡA组:分别加入不同浓度黄芪注射液和丹参酮ⅡA,0.1 g/ml+0.5 μg/ml、0.5 g/ml+1.0 μg/ml、1.0 g/ml+2.0 μg/ml、2.0 g/ml+4.0 μg/ml、4.0 g/ml+8.0 μg/ml;黄芪+丹参酮ⅡA+5-FU组:分别加入不同浓度黄芪注射液、丹参酮ⅡA和5-FU:0.1 g/ml+0.5 μg/ml+3.5 mg/L、0.5 g/ml+1.0 μg/ml+7.0 mg/L、1.0 g/ml+2.0 μg/ml+12.5 mg/L、2.0 g/ml+4.0 μg/ml+25.0 mg/L、4.0 g/ml+8.0 μg/ml+50.0 mg/L。
1.3.3 生长抑制率检测 采用四甲基偶氮唑盐比色法(MTT法)检测黄芪、丹参酮ⅡA、5-FU单用及联合应用对人宫颈癌HeLa细胞生长的抑制作用。取1×108个对数生长期宫颈癌HeLa细胞接种于96孔培养板中,200 μl/孔,培养24 h,吸去培养液,分别加入200 μl不同浓度、不同组分药物,每组设3个复孔。各用药组细胞培养24、48、72 h后,每孔加入MTT(5 g/L)20 μl,继续培养6 h,弃上清液,每孔加入DMSO 150 μl,室温下振荡 10 min将结晶完全溶解。酶标仪570 nm波长处测吸光度值(OD 值)。生长抑制率=(1-实验组OD值/对照组OD值)×100%。
1.3.4 细胞凋亡率检测 各用药组细胞于培养72 h后消化收集,磷酸盐缓冲液(PBS)洗涤后,70%乙醇固定,4 ℃过夜。PBS洗涤2次RNA酶,消化30 min后,采用流式细胞术检测。每组重复3次。采用CellQuest软件计算细胞凋亡率。
1.3.5 MDA水平及SOD、GSH活力测定 各组细胞于培养72 h后消化收集,PBS洗涤2次,收集细胞于1.5 ml EP 管中,-80 ℃超低温冰箱冻存待检。每份细胞样本加入0.5 ml 0.9%氯化钠溶液,超声波破碎,3 000 r/min离心10 min(离心半径10 cm)。收集上清液。按照试剂盒说明书分别检测MDA水平及SOD、GSH活力。
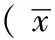
2 结果
2.1 不同浓度黄芪组人宫颈癌HeLa细胞生长抑制率比较 培养24、48、72 h后,不同浓度黄芪组人宫颈癌HeLa细胞生长抑制率比较,差异有统计学意义(P<0.05);其中4.0 g/ml黄芪人宫颈癌HeLa细胞生长抑制率最高,同组培养72 h后人宫颈癌HeLa细胞生长抑制率最高(P<0.05,见表1)。
2.2 不同浓度丹参酮ⅡA组人宫颈癌HeLa细胞生长抑制率比较 培养24、48、72 h后,不同浓度丹参酮ⅡA组人宫颈癌HeLa细胞生长抑制率比较,差异有统计学意义(P<0.05);其中8.0 μg/ml丹参酮ⅡA人宫颈癌HeLa细胞生长抑制率最高,同组培养72 h后人宫颈癌HeLa细胞生长抑制率最高(P<0.05,见表2)。
2.3 不同浓度5-FU组人宫颈癌HeLa细胞生长抑制率比较 培养24、48、72 h后,不同浓度5-FU组人宫颈癌HeLa细胞生长抑制率比较,差异有统计学意义(P<0.05);其中50.0 mg/L 5-FU人宫颈癌HeLa细胞生长抑制率最高,同组培养72 h后人宫颈癌HeLa细胞生长抑制率最高(P<0.05,见表3)。
2.4 不同浓度黄芪+丹参酮ⅡA组人宫颈癌HeLa细胞生长抑制率比较 培养24、48、72 h后,不同浓度黄芪+丹参酮ⅡA组人宫颈癌HeLa细胞生长抑制率比较,差异有统计学意义(P<0.05);其中4.0 g/ml黄芪+8.0 μg/ml丹参酮ⅡA人宫颈癌HeLa细胞生长抑制率最高,同组培养72 h后人宫颈癌HeLa细胞生长抑制率最高(P<0.05,见表4)。
2.5 不同浓度黄芪+丹参酮ⅡA+5-FU组人宫颈癌HeLa细胞生长抑制率比较 培养24、48、72 h后,不同浓度黄芪+丹参酮ⅡA+5-FU组人宫颈癌HeLa细胞生长抑制率比较,差异有统计学意义(P<0.05);其中4.0 g/ml黄芪+8.0 μg/ml丹参酮ⅡA+50.0 mg/L 5-FU人宫颈癌HeLa细胞生长抑制率最高,同组培养72 h后人宫颈癌HeLa细胞生长抑制率最高(P<0.05,见表5)。
2.6 不同用药组人宫颈癌HeLa细胞生长抑制率比较 培养72 h后,选取各用药组最高浓度组进行比较,不同用药组人宫颈癌HeLa细胞生长抑制率比较,差异有统计学意义(P<0.05);其中黄芪+丹参酮ⅡA组人宫颈癌HeLa细胞生长抑制率较黄芪组、丹参酮ⅡA组、5-FU组升高,差异有统计学意义(P<0.05);黄芪+丹参酮ⅡA+5-FU组人宫颈癌HeLa细胞生长抑制率较黄芪组、丹参酮ⅡA组、5-FU组、黄芪+丹参酮ⅡA组升高,差异有统计学意义(P<0.05,见表6)。

Table 1 Comparison of human cervical carcinoma HeLa cell growth inhibition rate in astragalus group among different drug concentrations

黄芪(g/ml)24h48h72hF值P值01365±045987±087e1723±168ef11000<000105534±042a1564±144ae2427±327aef6246<0001101769±205ab2579±198abe3175±522abef12670007201936±278abc3142±403abce3937±377abcef23930001402864±196abcd4723±339abcde5545±493abcdef4283<0001F值1009092184111P值<0001<0001<0001
注:与0.1 g/ml黄芪比较,aP<0.05;与0.5 g/ml黄芪比较,bP<0.05;与1.0 g/ml黄芪比较,cP<0.05;与2.0 g/ml黄芪比较,dP<0.05;与同组培养24 h后比较,eP<0.05;与同组培养48 h后比较,fP<0.05
2.7 不同用药组人宫颈癌HeLa细胞凋亡率比较 培养72 h后,选取各用药组最高浓度组进行比较,不同用药组人宫颈癌HeLa细胞凋亡率比较,差异有统计学意义(P<0.05);其中黄芪+丹参酮ⅡA+5-FU组人宫颈癌HeLa细胞凋亡率较黄芪组、丹参酮ⅡA组、5-FU组、黄芪+丹参酮ⅡA组升高,差异有统计学意义(P<0.05,见表7)。
2.8 不同组MDA水平及SOD、GSH活力比较 培养72 h后,选取各组最高浓度组进行比较,不同组MDA水平及GSH活力比较,差异无统计学意义(P>0.05);不同组SOD活力比较,差异有统计学意义(P<0.05);其中黄芪组、丹参酮ⅡA组、5-FU组、黄芪+丹参酮ⅡA组、黄芪+丹参酮ⅡA+5-FU组SOD活力较对照组降低,差异有统计学意义(P<0.05,见表8)。

Table 2 Comparison of human cervical carcinoma HeLa cell growth inhibition rate in tanshinone ⅡA group among different drug concentrations

丹参酮ⅡA(μg/ml)24h48h72hF值P值05459±0521285±187e1723±222ef4264<000110792±064a2528±311ae3764±421aef7215<0001201524±138ab3104±369abe4396±594abef3665<0001402035±153abc4666±582abce5537±674abcef3664<0001803004±300abcd5642±581abcde5953±688abcdef26230001F值1108047432786P值<0001<0001<0001
注:与0.5 μg/ml丹参酮ⅡA比较,aP<0.05;与1.0 μg/ml丹参酮ⅡA比较,bP<0.05;与2.0 μg/ml丹参酮ⅡA比较,cP<0.05;与4.0 μg/ml丹参酮ⅡA比较,dP<0.05;与同组培养24 h后比较,eP<0.05;与同组培养48 h后比较,fP<0.05

Table 3 Comparison of human cervical carcinoma HeLa cell growth inhibition rate in 5-FU group among different drug concentrations

5⁃FU(mg/L)24h48h72hF值P值35457±0671184±296e1516±245ef1736000370741±065a1864±233ae2945±498aef3566<00011251609±211ab2374±198abe3098±451abef173800032502066±185abc2549±365abce3647±410abcef176100035002946±365abcd4283±458abcde5689±687abcdef20780002F值691038082979P值<0001<0001<0001
注:5-FU=5-氟尿嘧啶;与3.5 mg/L 5-FU比较,aP<0.05;与7.0 mg/L 5-FU比较,bP<0.05;与12.5 mg/L 5-FU比较,cP<0.05;与25.0 mg/L 5-FU比较,dP<0.05;与同组培养24 h后比较,eP<0.05;与同组培养48 h后比较,fP<0.05

表4 不同浓度黄芪+丹参酮ⅡA组人宫颈癌HeLa细胞生长抑制率比较±s,%,n=3)
注:与0.1 g/ml黄芪+0.5 μg/ml丹参酮ⅡA比较,aP<0.05;与0.5 g/ml黄芪+1.0 μg/ml丹参酮ⅡA比较,bP<0.05;与1.0 g/ml黄芪+2.0 μg/ml丹参酮ⅡA组比较,cP<0.05;与2.0 g/ml黄芪+4.0 μg/ml丹参酮ⅡA比较,dP<0.05;与同组培养24 h后比较,eP<0.05;与同组培养48 h后比较,fP<0.05

Table 5 Comparison of human cervical carcinoma HeLa cell growth inhibition rate in astragalus+tanshinone ⅡA+5-FU group among different drug concentrations

黄芪+丹参酮ⅡA+5⁃FU24h48h72hF值P值01g/ml+05μg/ml+35mg/L735±0851467±165e1868±225ef3492<000105g/ml+10μg/ml+70mg/L534±058a2558±384ae4629±598aef7421<000110g/ml+20μg/ml+125mg/L1769±421ab3587±425abe5735±765abef3761<000120g/ml+40μg/ml+250mg/L2836±365abc4267±566abce6558±829abcef2781<000140g/ml+80μg/ml+500mg/L4164±596abcd6743±955abcde8285±1055abcdef16390004F值509337513066P值<0001<0001<0001
注:与0.1 g/ml黄芪+0.5 μg/ml丹参酮ⅡA+3.5 mg/L 5-FU比较,aP<0.05;与0.5 g/ml黄芪+1.0 μg/ml丹参酮ⅡA+7.0 mg/L 5-FU比较,bP<0.05;与1.0 g/ml黄芪+2.0 μg/ml丹参酮ⅡA+12.5 mg/L 5-FU比较,cP<0.05;与2.0 g/ml黄芪+4.0 μg/ml丹参酮ⅡA+25.0 mg/L 5-FU比较,dP<0.05;与同组培养24 h后比较,eP<0.05;与同组培养48 h后比较,fP<0.05
3 讨论
临床上,黄芪常被单独或组成方剂用于各种中、晚期肿瘤患者的治疗,如十全大补汤、补中益气汤等[6]。黄芪具有抗炎、免疫调节、抗氧化、抑制肿瘤生长、抗病毒等作用,同时具有保护心肌、肝脏等重要脏器的作用,是新药及食品保健研究的热点之一[9-10]。丹参酮ⅡA是一种低毒、抗瘤谱广的中药单体,已证实其对多种肿瘤具有杀伤作用[4]。黄芪与丹参酮ⅡA联合应用治疗宫颈癌疗效是否优于单药以及其作用机制的研究,对治疗宫颈癌和黄芪与丹参酮ⅡA的进一步开发利用具有十分重要的价值。

Table 6 Comparison of human cervical carcinoma HeLa cell growth inhibition rate among different drug groups

组别生长抑制率黄芪组5545±493丹参酮ⅡA组5953±6885⁃FU组5689±687黄芪+丹参酮ⅡA组6647±666abc黄芪+丹参酮ⅡA+5⁃FU组8285±1055abcdF值690P值0006
注:与黄芪组比较,aP<0.05;与丹参酮ⅡA组比较,bP<0.05;与5-FU组比较,cP<0.05;与黄芪+丹参酮ⅡA组比较,dP<0.05
本研究发现,黄芪、丹参酮ⅡA对人宫颈癌HeLa细胞具有明显的抑制作用,且黄芪+丹参酮ⅡA组人宫颈癌HeLa细胞抑制率高于黄芪组、丹参酮ⅡA、5-FU组,同时本实验还证实,黄芪+丹参酮ⅡA+5-FU组人宫颈癌HeLa细胞抑制率高于黄芪组、丹参酮ⅡA组、5-FU组及黄芪+丹参酮ⅡA组。表明黄芪、丹参酮ⅡA联合应用在抑制人宫颈癌HeLa细胞增殖方面效果优于两药单用,除本身对肿瘤细胞的增殖有抑制作用外,还能对化疗药物有增敏作用[11]。

Table 7 Comparison of human cervical carcinoma HeLa cell apoptosis rate among different drug groups

组别细胞凋亡率黄芪组4674±334丹参酮ⅡA组5459±6655⁃FU组4907±536黄芪+丹参酮ⅡA组5584±485黄芪+丹参酮ⅡA+5⁃FU组6592±888abcdF值446P值0025
注:与黄芪组比较,aP<0.05;与丹参酮ⅡA组比较,bP<0.05;与5-FU组比较,cP<0.05;与黄芪+丹参酮ⅡA组比较,dP<0.05

Table 8 Comparison of MDA level and the activity of SOD and GSH among different groups

组别MDA(nmol/ml)SOD(nU/mg)GSH(nU/mg)对照组055±0153132±055132±104黄芪组059±0142817±040a124±161丹参酮ⅡA组060±0132870±177a1269±1555⁃FU组067±0092716±058a1189±127黄芪+丹参酮ⅡA组069±0152651±075a1044±161黄芪+丹参酮ⅡA+5⁃FU组074±0112563±111a1001±017F值0911260285P值0508<00010064
注:MDA=丙二醛, SOD=超氧化物歧化酶,GSH=谷胱甘肽;与对照组比较,aP<0.05
许多诱导剂能抑制肿瘤细胞生长、诱导其分化,作用机制主要是通过抑制细胞原癌基因表达、诱导抑癌基因表达,抑制细胞进入S期及DNA合成[12]。本研究提示,黄芪、丹参酮ⅡA、5-FU联合应用于人宫颈癌HeLa 细胞后,诱导细胞凋亡的作用显著提高,与前期研究结果一致[13]。
SOD在抗肿瘤药物诱导肿瘤细胞凋亡的过程中发挥重要的作用[14],SOD亦可通过多种途径激活自噬[15]。生理情况下,SOD的产生和清除保持动态平衡,如果SOD产生超过了清除的能力,就会破坏生物膜磷脂中的不饱和脂肪酸产生过量的MDA,损伤细胞的正常结构和功能[16]。黄芪和丹参酮ⅡA能够保护机体细胞减轻氧化应激损伤,本研究结果表明,黄芪组、丹参酮ⅡA组、5-FU组、黄芪+丹参酮ⅡA组、黄芪+丹参酮ⅡA+5-FU组SOD活力较对照组降低,加剧活性氧对肿瘤细胞的破坏,但该作用与时间、药物浓度的关系仍需要深入探索。
黄芪和丹参是我国传统中药,药理作用机制明确,不良反应小,二者联合应用于宫颈癌的治疗和作为辅助化疗药物国内外迄今还未见报道,本研究为二者联合治疗肿瘤的临床应用提供实验依据。
作者贡献:田亚萍进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;田亚萍、王园园进行实验实施、评估、资料收集;迟宝荣进行质量控制及审校。
本文无利益冲突。
[1]Owrangi AM,Prisciandaro JI,Soliman A,et al.Magnetic resonance imaging-guided brachytherapy for cervical cancer:initiating a program[J].J Contemp Brachytherapy,2015,7(5):417-422.
[2]Wang X,Feng Y,Wang N,et al.Chinese medicines induce cell death:the molecular and cellular mechanisms for cancer therapy[J].Biomed Res Int,2014,2014:530342.
[3]Hu B,Wang SS,Du Q.Traditional Chinese medicine for prevention and treatment of hepatocarcinoma:from bench to bedside[J].World J Hepatol,2015,7(9):1209-1232.
[4]Zhang Y,Jiang P,Ye M,et al.Tanshinones:sources,pharmacokinetics and anti-cancer activities[J].Int J Mol Sci,2012,13(10):13621-13666.
[5]王茂林,陈世益,李云霞,等.黄芪皂甙和丹参酮ⅡA注射液对大鼠骨骼肌钝挫伤后氧化应激的影响[J].中国运动医学杂志,2011,30(2):162-165.
[6]李敏州,高彦彬.自拟黄芪生脉散治疗糖尿病冠心病29例临床观察[J].疑难病杂志,2010,09(9):676-678.
[7] 沈隽,王照艳,张晓,等.丹参酮ⅡA对HeLa宫颈癌细胞凋亡的影响[J].中国药房,2007,18(27):2012-2014.
[8]Geng LM,Han FQ,Tian JB,et al.Effects of the combination of Danshen injection and Huangqi injection on the cardic patients′hemorheology and ejection fraction[J].Chinese General Practice,2004,7(7):455,458.(in Chinese) 耿立梅,韩凤芹,田金彪,等.丹参液与黄芪液合用对冠心病患者血液流变学及射血分数的影响[J].中国全科医学,2004,7(7):455,458.
[9]王晓莉,苏志红,李妍芹,等.黄芪对体外培养人宫颈癌Hela细胞的抑制作用[J].西北国防医学杂志,2010,31(4):270-272.
[10]Shan GZ,Ye XT.Clinical observation of astraglaus polysaccharide combined with chemotherapy in 84 cases of patients with advanced cancer[J].Chinese Journal of Clinical Oncology,2007,34(6):355-356.(in Chinese) 山广志,叶兴涛.注射用黄芪多糖联合化疗治疗84例晚期恶性肿瘤临床疗效观察[J].中国肿瘤临床,2007,34(6):355-356.
[11]王冬,田亚平,姜英雁,等.丹参酮ⅡA抑制Hela细胞生长及诱导凋亡的体外实验研究[J].中国现代医学杂志,2007,17(6):676-678.
[12]Fuhrman CB,Kilgore J,LaCoursiere YD,et al.Radiosensitization of cervical cancer cells via double-strand DNA break repair inhibition[J].Gynecol Oncol,2008,110(1):93-98.
[13]王冬,田亚平,姜英雁,等.丹参酮ⅡA与5-FU抑制HeLa细胞生长及诱导细胞凋亡的研究[J].中国现代医学杂志,2008,18(22):3237-3240.
[14]Guha P,Dey A,Sen R,et al.Intracellular GSH depletion triggered mitochondrial Bax translocation to accomplish resveratrol-induced apoptosis in the U937 cell line[J].J Pharmacol Exp Then,2011,336(1):206-214.
[15] 纪元,龙建纲,刘健康.自噬发生中的ROS调节机制[J].中国生物化学与分子生物学报,2014,30(4):321-327.
[16] 李宏林,王炜,杜英.自拟活血通脉灵对心肌缺血大鼠SOD活性和MDA含量的影响[J],疑难病杂志,2012,11(4):277.
(本文编辑:陈素芳)
In Vitro Effect of Astragalus,TanshinoneⅡA,5-fluorouracil Alone or Their Combined Use on Human Cervical Carcinoma HeLa Cells
TIANYa-ping,WANGYuan-yuan,CHIBao-rong.DepartmentofDermatologyandVenereology,theFirstHospitalofJilinUniversity,Changchun130021,China
Objective To investigate the inhibitory effect and anti-tumor mechanism of astragalus,tanshinoneⅡ A,and 5-fluorouracil(5-FU) used alone or in combination on human cervical carcinoma cells,and to explore the application value of astragalus injection and tanshinoneⅡA in cervical cancer treatment.Methods Human cervical carcinoma HeLa cells were sampled and divided into six groups:control group,astragalus group (group 1),tanshinone ⅡA group (group 2),5-FU group(group 3),astragalus+tanshinoneⅡA group(group 4),astragalus+tanshinone ⅡA+5-FU group(group 5) from March to December in 2014.Each group was administrated with different concentrations of drugs.MTT method and FCM method were used to detect the HeLa cell growth inhibition rate and cell apoptosis rate of human cervical carcinoma and detect MDA level and the activity of SOD and GSH.Results Group 1,group 2,group 3,group 4 and group 5 had the highest human cervical carcinoma HeLa cell growth inhibition rates when drug concentration was 4.0 g/ml,8.0 μg/ml,50.0 mg/L,4.0 g/ml +8.0 μg/ml,4.0 g/ml +8.0 μg/ml+50.0 mg/L(P<0.05);the 5 groups had highest HeLa cell growth inhibition rates after 72 h culture(P<0.05).After 72 h culture,group 4 was higher than group 1,group 2 and group 3 in HeLa cell growth inhibition rate(P<0.05);group 5 was higher than group 1,group 2 and group 3 and group 4 in HeLa cell growth inhibition rate (P<0.05).Group 5 was higher than group 1,group 2 and group 3 and group 4 in HeLa cell apoptosis rate (P<0.05).No significant differences existed in MDA level and GSH activity among different groups (P>0.05);significant differences existed in SOD activity among different groups (P<0.05);group 1,group 2,group 3,group 4 and group 5 were lower than control group in SOD activity (P<0.05).Conclusion Astragalus injection solution,tanshinoneⅡA and 5-FU can induce the apoptosis of human cervical cancer HeLa cells,and their combined use can increase antitumor activity,and have clinical application value.
Uterine cervical neoplasms;Astragalus membranaceus;Tanshinone;Fluorouracil;HeLa cells;In vitro
吉林省中医药管理局中医药科技项目(2012-130)
130021 吉林省长春市,吉林大学第一医院皮肤性病科(田亚萍,王园园),消化内科(迟宝荣)
迟宝荣,130021 吉林省长春市,吉林大学第一医院消化内科;E-mail:chibr@jlu.edu.cn
R 737.33
A
10.3969/j.issn.1007-9572.2016.09.020
2015-05-24;
2016-01-10)

