1,25(OH)2D3对人系膜细胞增殖及PI3K/Akt信号通路的影响
唐玉玲,张春江,马 莉,贾 林,杨 锐,杨晓萍
1,25(OH)2D3对人系膜细胞增殖及PI3K/Akt信号通路的影响
唐玉玲,张春江,马 莉,贾 林,杨 锐,杨晓萍
【摘要】目的观察1,25-二羟维生素D3〔1,25(OH)2D3〕对人系膜细胞(HMC)增殖及Akt、mTOR表达的影响,探讨PI3K/Akt信号通路在1,25(OH)2D3对HMC增殖调控中的作用。方法体外培养HMC,取传代培养至第3~7代细胞分为4组:正常对照组(N组)、1,25(OH)2D3组(10-8mol/L,VD组)、PI3K抑制剂干预组(LY294002 2 μg/ml,LY组),LY294002(2 μg/ml)联合1,25(OH)2D3组(10-8mol/L)组(LY+VD组),干预48 h,倒置相差显微镜观察各组细胞生长,CCK-8法检测各组细胞增殖,流式细胞术检测各组细胞周期时相分布,Western blotting检测各组Akt、p-Akt、mTOR、p-mTOR表达的情况。结果各实验组吸光度值(A值)比较,差异有统计学意义(F=281.641,P<0.01),其中VD组、LY组和LY+VD组A值均低于N组,LY+VD组A值均分别低于VD组和LY组,差异均有统计学意义(P<0.01)。各实验组G2/M期比较,差异无统计学意义(P>0.05)。各实验组G1期、S期和PI比较,差异均有统计学意义(P<0.05);其中VD组、LY组和LY+VD组G1期均高于N组,S期和PI均低于N组,LY+VD组G1期均高于VD组,S期和PI均低于VD组,差异均有统计学意义(P<0.05)。各实验组Akt/β-actin、mTOR/β-actin灰度值比较,差异无统计学意义(P>0.05)。各实验组p-Akt/Akt、p-mTOR/mTOR灰度值比较,差异有统计学意义(P<0.05);其中VD组、LY组和LY+VD组p-Akt/Akt、p-nmTOR/mTOR灰度值均低于N组,LY+VD组p-Akt/Akt、p-nmTOR/mTOR灰度值均低于VD组和LY组,差异有统计学意义(P<0.05)。结论1,25-(OH)2D3可通过PI3K/Akt信号通路抑制体外培养HMC的增殖。
系膜细胞(mesangial cell,MC)进行性异常增生将发展为肾小球硬化,最终导致肾衰竭,而早期抑制MC增殖、促进其凋亡对改善和延缓病情至关重要。1,25-二羟维生素D3〔1,25(OH)2D3〕是维生素D3在体内的活性形式,其能对多种类型细胞的增殖及凋亡起调节作用[1]。本课题组前期研究已证实,1,25(OH)2D3能抑制体外培养的正常人MC(HMC)增殖,诱导其凋亡[2-3]。本实验使用磷脂酰肌醇-3激酶(PI3K)抑制剂LY294002作用于体外培养的HMC,旨在初步探讨1,25(OH)2D3影响HMC增殖的具体机制,为其临床应用提供理论依据。
1材料与方法
1.1材料与试剂
1.1.1细胞株HMC株购自湘雅医学院中心实验室。
1.1.2主要试剂1,25-(OH)2D3(10 μg)、LY294002、CCK-8试剂盒、碘化丙啶(PI)(购自美国Sigma公司),0.25% 胰蛋白酶(美国Gibco公司),小鼠抗人β-actin单克隆抗体、兔抗人Akt单克隆抗体、兔抗人p-nAkt单克隆抗体(Cell Signaling公司);山羊抗兔IgG二抗、山羊抗小鼠IgG二抗(北京中杉金桥生物技术有限公司)。
1.2仪器与设备普通光学显微镜(日本Olympus公司),倒置相差显微镜(日本Olympus公司),ELX-800酶标仪(美国Biokit公司),流式细胞仪(德国Partec公司),Gel DocTMXR+凝胶成像系统(美国BIO RAD公司)。
1.3实验方法
1.3.1细胞培养采用L-DMEM完全培养基(10%FBS,100 μg/ml青霉素,100 μg/ml链霉素)复苏细胞株,置于5% CO2、37 ℃、饱和湿度的培养箱中培养,当细胞生长至70%~80%融合时,用0.25%胰蛋白酶消化,传代继续培养,第3~7代用于实验。
1.3.2实验分组收集生长良好的对数期HMC,计数后接种于培养瓶中,待细胞完全贴壁后弃完全培养基,加入L-DMEM同步化24 h,将细胞分为4组:(1)N组:对照(L-DMEM培养基,5%FBS),(2)VD组:1,25(OH)2D3(10-8mol/L),(3)LY组:LY294002(2 μg/ml),(4)LY+VD组:LY294002(终浓度为2 μg/ml)联合1,25(OH)2D3(终浓度为10-8mol/L)。
1.3.3CCK-8法检测各组HMC增殖参照文献[4]及CCK-8试剂盒使用说明书操作。取对数期HMC,调整浓度为1×104/ml,200 μl/孔接种于96孔板内;按照实验分组干预48 h,干预结束后磷酸盐缓冲液(PBS)冲洗1次,加入100 μl L-DMEM及10 μl CCK-8溶液,培养4 h后振荡15 min,酶标仪检测各孔在450 nm波长处的吸光度值(A值)。实验重复3次,并计算抑制率(inhibition rate,IR),IR=A对照组-A实验组/ A对照组×100%。
1.3.4流式细胞仪(PI染色)检测各组HMC周期时相分析取对数期HMC,调整浓度为2×105/ml,接种于培养瓶内;按照实验分组干预48 h,干预结束后收集细胞,4 ℃预冷的70%乙醇重悬,4 ℃固定过夜;上机前以800 r/min离心5 min,PBS洗涤1次,1×Buffer液重悬细胞,加入RNA酶(终浓度为10 μg/μl),37 ℃孵育30 min,加入PI染液(终浓度为50 μg/ml),4 ℃避光反应30 min,移入流氏管中,再加入PBS至2 ml,上机检测。实验重复3次,计算细胞增殖指数(proliferation index,PI),PI=(S期细胞比例+G2期细胞比例)/(G1期细胞比例+S期细胞比例+G2期细胞比例)。
1.3.5Western blotting法检测Akt、p-nAkt、mTOR、p-nmTOR表达取对数期HMC,用无血清DMEM培养基培养24 h,同步化于G0期,按实验分组干预48 h,300 μl细胞裂解液提取蛋白,BCA法测蛋白浓度并配平,取10 μl上样电泳3 h,PVDF转膜50 min,5%奶粉/BSA封闭1 h,分别用兔抗人Akt单抗(1∶1 000)、兔抗人p-nAkt单抗(1∶1 000)、小鼠抗人β-actin单抗(1∶2 000)4 ℃孵育过夜,山羊抗兔、抗鼠IgG(1∶20 000)室温1 h,ECL显色成像。相同实验条件重复3次。Gelpro软件比较目的条带相对灰度值。
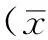
2结果
2.1各实验组HMC生长情况各实验组分别干预HMC 48 h后,N组HMC:胞体呈长梭形、不规则星形或树枝状,胞核居中,圆形或卵圆形,较清晰,见图1A(本文图1、图2的彩图见本刊官网www.chinagp.net电子期刊相应文章附件)。VD组HMC:少数胞体皱缩,体积变小,核浓缩成点状,胞质浓缩甚至出现空泡,部分细胞漂浮(见图1B)。LY组和LY+VD组:与N组相比,细胞核数目明显减少,胞体呈长梭形突出或消失(见图1C、1D)。

注:A=N组,B=VD组,C=LY组,D=LY+VD组
图1各实验组HMC生长情况(×200)
Figure 1Proliferation of human mesangial cells by the intervention of each group
2.2各实验组HMC增殖情况各实验组A值比较,差异有统计学意义(F=281.641,P<0.01),其中VD组、LY组和LY+VD组A值均低于N组,LY+VD组A值均分别低于VD组和LY组,差异均有统计学意义(P<0.01,见表1)。
表1各实验组HMC增殖情况比较
Table 1Comparison of proliferation of human mesangial cells by the intervention of each group

组别A值IR(%)N组0.8028±0.02340 VD组0.5432±0.0380a32.34LY组0.3946±0.0395a50.85LY+VD组0.3608±0.0186abc55.06
注:与N组比较,aP<0.01;与VD组比较,bP<0.01;与LY组比较,cP<0.01
2.3各实验组HMC周期时相分布各实验组G2/M期比较,差异无统计学意义(P>0.05)。各实验组G1期、S期和PI比较,差异均有统计学意义(P<0.05);其中VD组、LY组和LY+VD组G1期均高于N组,S期和PI均低于N组,LY+VD组G1期均高于VD组,S期和PI均低于VD组,差异均有统计学意义(P<0.05,见表2、图2)。

Table 2Comparison of cycle phase distribution of human mesangial cells by the intervention of each group

组别细胞周期时相分布G1期 S期 G2/M期PIN组54.94±0.5633.05±1.9712.01±1.4945.06±3.46VD组62.06±1.93a22.80±1.47a15.14±2.8337.94±4.30aLY组68.19±1.33a20.11±1.18a11.76±0.5632.86±5.05aLY+VD组67.14±1.55ab19.01±2.46ab13.85±2.5931.81±1.74abF值409.06815.60191.659123.263P值<0.05<0.05>0.05<0.05
注:与N组比较,aP<0.05;与VD组比较,bP<0.05;PI=细胞增殖指数

注:A=N组,B=VD组,C=LY组,D=LY+VD组
图2各实验组HMC周期时相分布
Figure 2Cycle phase distribution of human mesangial cells by the intervention of each group
2.4各实验组Akt、p-nAkt、mTOR、p-nmTOR表达情况各实验组Akt/β-actin、mTOR/β-actin灰度值比较,差异无统计学意义(P>0.05)。各实验组p-Akt/Akt、p-nmTOR/mTOR灰度值比较,差异有统计学意义(P<0.05);其中VD组、LY组和LY+VD组p-Akt/Akt、p-nmTOR/mTOR灰度值均低于N组,LY+VD组p-Akt/Akt、p-nmTOR/mTOR灰度值均低于VD组和LY组,差异有统计学意义(P<0.05,见表3、图3)。

Table 3Comparison of the expression of Akt,p-nAkt,mTOR and p-nmTOR among the four groups
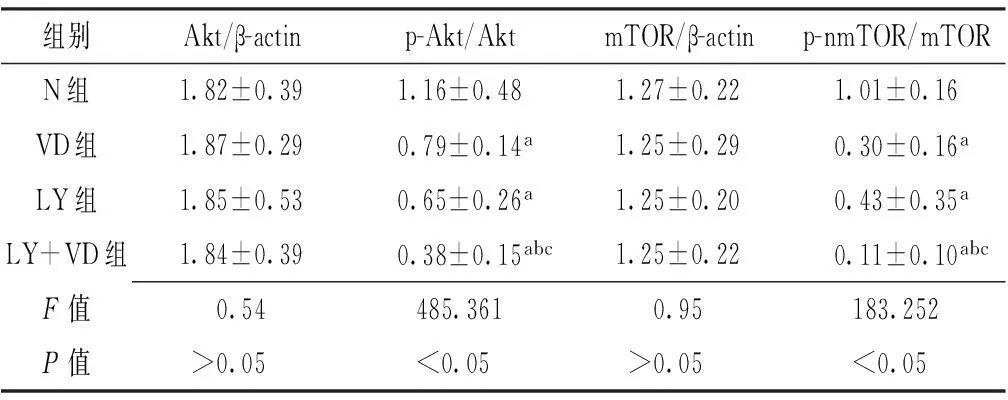
组别Akt/β-actinp-Akt/AktmTOR/β-actinp-nmTOR/mTORN组1.82±0.391.16±0.481.27±0.221.01±0.16VD组1.87±0.290.79±0.14a1.25±0.290.30±0.16aLY组1.85±0.530.65±0.26a1.25±0.200.43±0.35aLY+VD组1.84±0.390.38±0.15abc1.25±0.220.11±0.10abcF值0.54485.3610.95183.252P值>0.05<0.05>0.05<0.05
注:与N组比较,aP<0.05;与VD组比较,bP<0.05;与LY组比较,cP<0.05

图3 各实验组Akt、p-nAkt、mTOR、p-nmTOR的表达
Figure 3Expression of Akt,p-nAkt,mTOR and p-nmTOR among the four groups
3讨论
1,25(OH)2D3是维生素D3在人体内的活性形式,属于类固醇激素,也是人体必需的一种营养物质。研究证明:1,25(OH)2D3具有广泛的生物学效应,包括调节钙磷平衡,调节免疫系统、神经系统、肾素血管紧张素、胰岛素的分泌,以及细胞的分化、增殖、凋亡等[1]。1,25(OH)2D3可以抑制体外培养的小鼠系膜细胞的增殖[5]。Weinreich等[6]检测到HMC含有维生素D受体(VDR),1,25(OH)2D3可抑制HMC DNA的合成与细胞增殖。本研究通过CCK-8法、流氏细胞术检测1,25(OH)2D3对体外培养的正常HMC的影响,与正常对照组相比,1,25(OH)2D3组抑制率显著降低、G1期细胞显著增多、S期细胞显著减少,进一步证实了活性维生素D3能阻滞HMC细胞周期的进程,对HMC的增殖有明显的抑制作用。
MC异常增殖的本质是促进与抑制增生的失衡,主要是DNA复制和蛋白质的合成加速,G1/S期(DNA合成前期/DNA合成期)和G2/M期(DNA合成后期/有丝分裂期)是细胞周期调控的两个关键时期,主要受细胞周期蛋白(cyclin)、细胞周期蛋白依赖性激酶(CDK)及CDK抑制因子(CDKI)的相互调控。Huang等[7]证实PI3K、Akt、mTOR信号通路与MC的生长、增殖密切相关:PI3K活化后激活Akt,进一步磷酸化mTOR,将有丝分裂信号传递给核糖体蛋白S6激酶(p70S6K),使细胞周期蛋白(cyclin C、D、E)翻译上调,从而缩短细胞周期、促进增殖。PI3K/Akt信号通路主要与细胞有丝分裂有关,其促进有丝分裂的靶点主要是Akt活化后产生的下游分子,包括糖原合成激酶3β(GSK-3β)、mTOR、p70S6K、真核启动因子4E结合蛋白(4EBPS)等,同时通过磷酸化CDKI(p21Cip1与p27Kip1),正调控cyclin/CDK[8-9]。阻断该信号通路的活化,将抑制细胞增殖,PI3K催化亚基p110的靶向抑制剂LY294002可以阻断3-磷脂肌醇的产生[10],进而阻断此通路的活化。本研究结果显示,与正常对照组比较,LY294002能显著抑制HMC增殖,且LY294002组HMC G1期细胞显著增加,S期细胞显著减少,提示PI3K/Akt信号通路存在于系膜细胞中,且被激活,给予PI3K抑制剂LY294002将HMC阻滞于G1期,从而抑制其生长,也验证PI3K/Akt信号通路在HMC的增殖过程中起重要的调控作用。
多项研究表明,PI3K/Akt信号通路参与多种癌细胞的生长、增殖、分化、凋亡和自噬过程[11-12]。Shemesh等[13]研究发现,抑制PI3K/Akt信号通路,可抑制高糖所致MC增殖及细胞中Ⅰ型胶原蛋白累积,从而延缓高糖所致MC功能损害。Zhang等[14]研究发现1,25(OH)2D3能协同LY294002发挥阻滞HL-60细胞(人早幼粒白血病细胞)周期的作用,且与协同上调p27Kip1有关。本研究结果显示:与LY294002组相比,1,25(OH)2D3与LY294002联合仍能抑制HMC增殖,继续将其阻滞于G1期,提示1,25(OH)2D3可能通过抑制PI3K的活化,阻滞MC增殖。本实验进一步检测Akt/p-nAkt、mTOR/p-nmTOR的表达,结果显示Akt/p-nAkt、mTOR/p-nmTOR在正常对照组中有表达,且1,25(OH)2D3及LY294002组中p-nAkt、p-nmTOR表达量较正常对照组、1,25(OH)2D3组、LY294002组显著降低,进一步证实PI3K/Akt信号通路存在于HMC中,1,25(OH)2D3可单独及联合PI3K抑制剂抑制PI3K/Akt信号通路阻滞MC增殖。另有研究发现,与张力蛋白同源在10号染色体有缺失的磷酸酶基因(PTEN)通过阻断PIP2产生PIP3,抑制Akt的活化[15],但Axanova等[16]报道,1,25(OH)2D3与Akt抑制剂共同抑制前列腺癌细胞的生长,并不完全依赖于PTEN。Gao等[17]研究证实,蛋白磷酸酶PHLPP可以使Akt去磷酸化,进而抑制肿瘤细胞的生长,促进其凋亡。因此,推断1,25(OH)2D3可能是通过抑制PI3K的活化,或通过PTEN和/或PHLPP及其他机制抑制Akt活化,进而抑制其下游蛋白mTOR磷酸化,发挥阻滞HMC增殖的作用。
综上所述,PI3K/Akt信号通路在HMC的增殖过程中起重要的调控作用,并参与1,25(OH)2D3抑制HMC增殖的过程。1,25(OH)2D3、LY294002可抑制体外培养的HMC增殖,1,25(OH)2D3协同LY294002发挥阻滞HMC周期的作用,共同将细胞阻滞于G1期;1,25(OH)2D3可通过抑制Akt、mTOR磷酸化,从而抑制MC增殖,为1,25(OH)2D3抑制MC增殖相关机制提出了新思路及一定的实验基础,但具体作用机制仍需进一步研究。
作者贡献:唐玉玲、杨晓萍进行试验设计与实施、资料收集整理、撰写论文、成文并对文章负责;张春江、马莉、贾林、杨锐进行实验实施、评估、资料收集;杨晓萍进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Dusso AS,Brown AJ,Slatopolsky E.Vitamin D[J].Am J Physiol Renal Physiol,2005,289(1):F8-28.
[2]Chen JP,Zhang CJ,Zhao D,et al.Effect of 1,25- dihydroxyvitamin D3on the proliferation of human glomerular mesangial cells[J].China Journal of Modern Medicine,2014,24(16):5-9.(in Chinese)
陈建平,张春江,赵丹,等.1,25-二羟基维生素D3对人系膜细胞增殖的影响[J].中国现代医学杂志,2014,24(16):5-9.
[3]Yin X,Zhang H,Chen JP,et al.Effects of 1,25(OH)2D3on proliferation and expression of PCNA of human glomerular mesangial cells[J].Tianjin Medical Journal,2015,43(1):17-19.(in Chinese)
尹璇,张昊,陈建平,等.1,25(OH)2D3对人肾小球系膜细胞增殖及PCNA表达的影响[J].天津医药,2015,43(1):17-19.
[4]Wan-Xin T,Tian-Lei C,Ben W,et al.Effect of mitofusin 2 overexpression on the proliferation and apoptosis of high-glucose-induced rat glomerular mesangial cells[J].J Nephrol,2012,25(6):1023-1030.
[5]Hariharan S,Hong SY,Hsu A,et al.Effect of 1,25-dihydroxyvitamin D3on mesangial cell proliferation[J].J Lab Clin Med,1991,117(5):423-429.
[6]Weinreich T,Merke J,Schönermark M,et al.Actions of 1,25-dihydroxyvitamin D3on human mesangial cells[J].Am J Kidney Dis,1991,18(3):359-366.
[7]Huang S,Zhang A,Ding G,et al.Aldosterone-induced mesangial cell proliferation is mediated by EGF receptor transactivation[J].Am J Physiol Renal Physiol,2009,296(6):F1323-1333.
[8]Nicholson KM,Anderson NG.The protein kinase B/Akt signaling pathway in human malignancy[J].Cell Signal,2002,14(5):381-395.
[9]Xu N,Lao Y,Zhang Y,et al.Akt:a double-edged sword in cell proliferation and genome stability[J].J Oncol,2012,2012:951724.
[10]Vlahos CJ,Matter WF,Hui KY,et al.A specific inhibitor of phosphatidylinositol 3-kinase,2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one(LY294002)[J].J Biol Chem,1994,269(7):5241-5248.
[11]Yuan CX,Zhou ZW,Yang YX,et al.Danusertib,a potent pan-Aurora kinase and ABL kinase inhibitor,induces cell cycle arrest and programmed cell death and inhibits epithelial to measenchymal transition involving the PI3K/Akt/mTOR-mediated signaling pathway in human gastric cancer AGS and NCI-N78 cells[J].Drug Des Devel Ther,2015,9:1293-1318.
[12]Wang H,Duan L,Zou Z,et al.Activation of the PI3K/Akt/mTOR/p70S6K pathway is involved in S100A4-induced viability and migration in colorectal cancer cells[J].Int J Med Sci,2014,11(8):841-849.
[13]Shemesh II,Rozen-Zvi B,Kalechman Y,et al.AS101 prevents diabetic nephropathy progression and mesangial cell dysfunction:regulation of the AKT downstream pathway[J].PLoS One,2014,9(12):e114287.
[14]Zhang Y,Zhang J,Studzinski GP.AKT pathway is activated by 1,25-dihydroxyvitamin D3and participates in its anti-apoptotic effect and cell cycle control in differentiating HL60 cells[J].Cell Cycle,2006,5(4):447-451.
[15]Maehama T,Dixon JE.The tumor suppressor,PTEN/MMAC1,dephosphorylates the lipid second messenger,phosphatidylinositol 3,4,5-trisphosphate[J].J Biol Chem,1998,273(22):13375-13378.
[16]Axanova LS,Chen YQ,McCoy T,et al.1,25-dihydroxyvitamin D(3) and PI3K/AKT inhibitors synergistically inhibit growth and induce senescence in prostate cancer cells[J].Prostate,2010,70(15):1658-1671.
[17]Gao T,Furnari F,Newton AC.PHLPP:a phosphatase that directly dephosphorylates AKT,promotes apoptosis,and suppresses tumor growth[J].Mol Cell,2005,18(1):13-24.
(本文编辑:贾萌萌)
·论著·
【关键词】骨化三醇;磷酸肌醇3-激酶类;Akt;肾小球系膜细胞;细胞增殖
唐玉玲,张春江,马莉,等.1,25(OH)2D3对人系膜细胞增殖及PI3K/Akt信号通路的影响[J].中国全科医学,2016,19(2):190-194.[www.chinagp.net]
Tang YL,Zhang CJ,Ma L,et al.Effects of 1,25(OH)2D3on the proliferation of human mesangial cells and the PI3K/Akt signal pathway[J].Chinese General Practice,2016,19(2):190-194.
Effects of 1,25(OH)2D3on the Proliferation of Human Mesangial Cells and the PI3K/Akt Signal PathwayTANGYu-ling,ZHANGChun-jiang,MALi,etal.MedicalCollegeofShiheziUniversity,Shihezi832003,China
【Abstract】ObjectiveTo investigate the effects of 1,25-dihydroxyvitamin D3〔1,25(OH)2D3〕 on the proliferation of human mesangial cells and the expression of Akt and mTOR and to explore the role of signal pathway of PI3K/Akt in the regulation of the proliferation of human mesangial cells by 1,25(OH)2D3.MethodsHuman mesangial cells were cultured in vitro,and the subcultured cells of three to seven generations were divided into four groups:normal control group(group N),1,25(OH)2D3group(10-8mol/L,group VD),PI3K intervention control group(LY294002 2 μg/ml,group LY),LY294002(2 μg/ml)combined 1,25(OH)2D3group(10-8mol/L)(group LY+VD).Intervention was conducted for 48 hours.Inverted phase contrast microscope was used to observe the cell growth of each group,CCK-8 method was used to detect the cell proliferation of each group,flow cytometry was employed to detect the cycle phase distribution of each group,and western blotting method was adopted to detect the expressions of Akt,p-nAkt,mTOR and p-nmTOR.ResultsThe four groups were significantly different in A(F=281.641,P<0.01).Group VD,group LY and group LY+VD were lower than group N in A(P<0.01),and group LY+VD was lower than group VD and group LY in A(P<0.01).The four groups were not significantly different in G2/M phase(P>0.05).The four groups were not significantly different(P<0.05)in G1phrase,S phrase and PI;group VD,group LY and group LY+VD were higher in G1phrase and lower in S phrase and PI than group N;group LY+VD was higher in G1phrase and lower in S phrase and PI than group VD(P<0.05).The four groups were not significantly different(P>0.05)in the gray values of Akt/β-actin and mTOR/β-actin.The four groups were significantly different(P<0.05)in the gray values of p-Akt/Akt and p-nmTOR/mTOR;group VD,group LY and group LY+VD were lower in the gray value of p-nmTOR/mTOR than N group(P<0.05),and group LY+VD was lower than VD group and LY group in the gray values of p-Akt/Akt and p-nmTOR/mTOR(P<0.05).Conclusion1,25-(OH)2D3can inhibit the proliferation of human mesangial cells cultured in vitro through PI3K/Akt signal pathway.
【Key words】Calcitriol;Phosphatidylinositol 3-kinases;Akt;Mesangial cells;Cell proliferation
收稿日期:(2015-07-06;修回日期:2015-09-10)
【中图分类号】R 977.24
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.02.014
通信作者:杨晓萍,832003新疆石河子市,石河子大学医学院;E-mail:sbkyxp@163.com
基金项目:作者单位:832003新疆石河子市,石河子大学医学院

