乌司他丁不同处理方式对体外循环患者血管内皮细胞的保护作用
杨 鹏,侯 俊,陈 春,汤和青,柯齐斌,林 雷
(三峡大学第一临床医学院麻醉科,湖北 宜昌 443003)
乌司他丁不同处理方式对体外循环患者血管内皮细胞的保护作用
杨 鹏,侯 俊,陈 春,汤和青,柯齐斌,林 雷
(三峡大学第一临床医学院麻醉科,湖北 宜昌 443003)
目的探讨乌司他丁对体外循环(CPB)患者血管内皮细胞保护作用及机制。方法选择择期在体外循环下行风湿性心脏病瓣膜置换术患者80例,随机分为A组(空白对照组)、B组(预处理组)、C组(后处理组、D组(联合处理组),每组20例;B组予乌司他丁2万U/kg,于麻醉后,升主动脉阻断前10 min自中心静脉输入;C组予乌司他丁2万U/kg,于升主动脉阻断后加入CPB预充液中;D组先以乌司他丁1万U/kg于升主动脉阻断前10 min自中心静脉输入,后以乌司他丁1万U/kg于升主动脉阻断后加入预充液中。分别于CPB前(T1)、升主动脉开放5 min(T2)、CPB结束后30 min(T3)、CPB结束后4 h(T4)时采血测定血浆肿瘤坏死因子- (TNF- )、白细胞介素(IL)-6水平及超氧化物歧化酶(SOD)和丙二醛(MDA)浓度。采用标记特异性抗体 CD146的免疫磁珠技术分离循环内皮细胞(CEC)并计数,采用酶联免疫吸附测定(ELISA)法检测血浆血栓调节蛋白(TM)和血管性假血友病因子(vWF)水平。结果与A组比较,B,C,D组TNF- 浓度于T2~T3,IL-6浓度于T2~T4均明显降低,差异有统计学意义(P<0.05);与A组比较,各组SOD血浆浓度在T2~T4明显升高,各组MDA血浆浓度在T2~T3明显降低,差异有统计学意义(P<0.05);B,C,D组TM浓度在T2~T3,B组T4较A组明显降低;B组vWF浓度在T2及T4,C组在T2~T3,D组在T2~T4较A组明显降低,差异有统计学意义(P<0.05);与A组比较,B,C,D组CECs数目于T3点明显减少,差异有统计学意义(P<0.05)。结论乌司他丁预处理和后处理均对体外循环患者血管内皮细胞具有一定的保护作用,其可能通过抑制炎症因子和氧自由基发挥作用。
胰蛋白酶抑制剂;心肺转流术;血管内皮细胞;体外循环;乌司他丁
内皮细胞激活或损伤是体外循环致全身炎症反应和多系统脏器功能损伤的重要环节[1]。血管内皮细胞(VEC)被认为是心血管疾病发生的始动因素[2],其从组织血管表面脱落至外周血液中,成为循环内皮细胞(CECs)。CECs也是目前活体内可以特异地、直接地反映血管损伤的指标[3]。血栓调节蛋白(TM)和血管性假血友病因子(vWF)则能反映体外循环(CPB)中VEC损伤活化程度,可作为判断VEC损伤活化的指标[4]。乌司他丁作为广谱蛋白酶抑制剂,治疗剂量可降低急性重症胰腺炎并发肺损伤[5],大剂量可通过抑制CPB炎症反应,减轻心肌损伤[6]。目前,关于乌司他丁的不同处理方式对VEC的作用研究尚少。本研究中通过乌司他丁不同处理方式,探讨其对体外循环患者VEC的保护作用以及作用机制。
1 资料与方法
1.1 一般资料
选择本院2013年8月至2014年8月择期在CPB下行风湿性心脏病二尖瓣和/或主动脉瓣膜置换术患者80例。纳入标准:美国麻醉师协会(ASA)分级标准Ⅱ~Ⅲ级;年龄38~62岁;术前1周停用阿司匹林及华法林,未使用肝素;均签署知情同意书,经本院医学伦理委员会同意。排除标准:恶性肿瘤;肝肾功能障碍;服用免疫抑制剂;细胞毒性药物;激素替代治疗。随机均分为4组,即 A组(空白对照组)、B组(预处理组)、C组(后处理组)、D组(联合处理组),各20例。
1.2 方法
所有患者入室后心电监护,开放静脉后在局部麻醉下行桡动脉和右颈内静脉穿刺置管。麻醉诱导予咪唑安定 0.1 mg/kg,芬太尼 10~20 μg/kg,依托咪酯0.3 mg/kg,维库溴铵0.15 mg/kg。诱导后气管插管行机械通气,潮气量8 mL/kg,呼吸频率12次/分,吸呼比为1∶2。静吸复合维持麻醉,术中间断静脉注射芬太尼和维库溴铵。在全身麻醉低温心肺转流下手术。全部患者均采用STOCKERT-Ⅲ型心肺转流机,西京膜式氧合器,无血预充,4∶1氧合血冷晶体停搏液间断灌注。CPB过程中所有患者肝素用量为3 mg/kg,预充液中10 mg/L,激活凝血时间(ACT)维持在480~600 s,转流完毕用鱼精蛋白中和体内残余肝素,比例为1∶1。
A组不予乌司他丁处理;B组予乌司他丁注射剂(批号为03050407,每支10万U,广东天普生化医药股份有限公司)2万U/kg,于麻醉后、升主动脉阻断前10 min自中心静脉输入;C组予乌司他丁2万U/kg,于升主动脉阻断后加入CPB预充液中;D组先以乌司他丁1万U/kg于升主动脉阻断前10 min自中心静脉输入,后以乌司他丁1万U/kg于升主动脉阻断后加入预充液中。手术由心胸外科同一主任医师完成。
1.3 观察指标及检测
分别于CPB前(T1)、升主动脉开放5 min(T2)、CPB结束后30 min(T3)、CPB结束后4 h(T4)时抽取桡动脉血10 mL,以3 000 r/min离心10 min,取血浆注入无菌硅化塑料管,密封置-30℃冻存。术中定时测定活化凝血时间(ACT),红细胞比容(Hct);记录主动脉阻断时间、CPB时间等。肿瘤坏死因子-α(TNF-α)、白细胞介素(IL-6)试剂盒(武汉博士德生物有限公司,批号分别为 BA14901和 BA0562-2),超氧化物歧化酶(SOD)、丙二醛(MDA)测定试剂盒(南京建成生物工程研究所,批号为A001-2和A003-1),TM及vWF试剂盒(日本IBL公司,批号为32189和32167)。采用双抗夹心酶联免疫吸附(ELISA)法试验,具体参照说明书操作。采用免疫磁珠法分离和计数循环内皮细胞,检测外周CECs数量的变化。生物试剂采用抗鼠IgG磁珠(Dynal M-450,Norway)和鼠抗人 CD146单克隆抗体(Biocytex,Marseilles,France),具体参照规范操作方法[7]。CPB期间血液稀释对测定值的影响用以下公式校正:
校正值=测定值×转流前Hct/测定时Hct。
1.4 统计学处理
所有数据均采用SPSS 13.0统计软件分析。非正态分布资料用中位数表示,数据经对数转换后进行统计分析;其他计量资料用均数±标准差表示;组间比较采用单因素方差分析,计数资料采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
80例患者均无手术并发症,仅2例出现注射部位皮疹、瘙痒感,其余无药品不良反应。各组患者一般资料见表1。
表1 各组患者一般资料比较(s,n=20)
表1 各组患者一般资料比较(s,n=20)
组别A组B组C组D组男/女(例) 11/9 10/10 11/9 10/10体重(kg)55±10 58±8 54±12 56±10年龄(岁)42±8 44±10 42±12 43±9主动脉阻断时间(min)65±20 62±15 63±18 60±22 CPB时间(min)85±15 88±12 90±15 84±18
2.2 血浆TNF- 及IL-6浓度
与T1比较,各组血浆TNF-α及IL-6浓度在T2~T4点明显升高,差异有统计学意义(P<0.05)。与A组比较,B,C,D组 TNF-α浓度于 T2~T3点,IL-6浓度于 T2~T4点均明显降低,差异有统计学意义(P<0.05)。与 B组比较,C组 TNF-α浓度于 T2~T3点明显降低,差异有统计学意义(P<0.05)。见表2。
2.3 血浆SOD及MDA浓度
与T1比较,各组SOD血浆浓度在T2~T4点明显降低,而MDA血浆浓度在T2~T4点明显升高,差异有统计学意义(P<0.05)。与A组比较,各组SOD血浆浓度在T2~T4点明显升高,各组MDA血浆浓度在T2~T3点明显降低,差异有统计学意义(P<0.05)。B,C,D组之间差异无统计学意义(P>0.05)。见表2。
2.4 血浆TM及vWF浓度
各组血浆TM及vWF浓度与T1比较,在T2~T4点均明显升高,差异有统计学意义(P<0.05)。TM浓度:B,C,D组在T2~T3点,B组T4点较A组明显降低,差异有统计学意义(P<0.05)。vWF浓度:B组在 T2、T4点,C组在T2~T3点,D组在T2~T4点较A组明显降低,差异有统计学意义(P<0.05)。B,C,D组之间差异无统计学意义(P>0.05)。见表2。
2.5 CECs
各组CECs在T1无统计学差异,与T1比较,各组患者CECs均明显增多,差异有统计学意义(P<0.05)。与A组比较,B,C,D组于T3点明显减少,差异有统计学意义(P<0.05)。见表2。
表2 各组血浆炎症因子、氧自由基、内皮细胞损伤标志物指标比较(s,n=20)
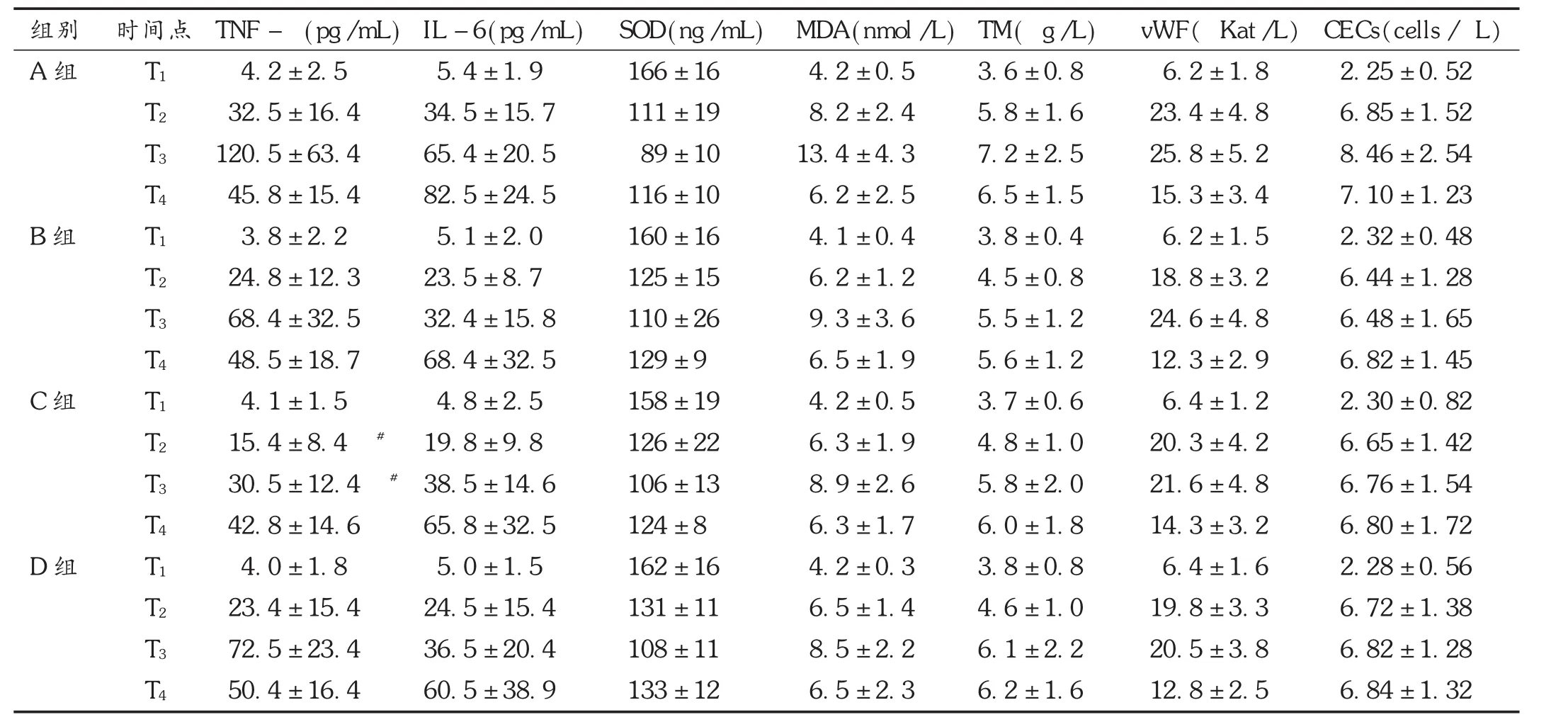
表2 各组血浆炎症因子、氧自由基、内皮细胞损伤标志物指标比较(s,n=20)
注:与本组T1比较, P<0.05;与A组同时点比较, P<0.05;与B组同时点比较,#P<0.05。
组别A组B组C组D组CECs(cells/ L)2.25±0.52 6.85±1.52 8.46±2.54 7.10±1.23 2.32±0.48 6.44±1.28 6.48±1.65 6.82±1.45 2.30±0.82 6.65±1.42 6.76±1.54 6.80±1.72 2.28±0.56 6.72±1.38 6.82±1.28 6.84±1.32时间点T1 T2 T3 T4 T1 T2 T3 T4 T1 T2 T3 T4 T1 T2 T3 T4 TNF- (pg/mL) 4.2±2.5 32.5±16.4 120.5±63.4 45.8±15.4 3.8±2.2 24.8±12.3 68.4±32.5 48.5±18.7 4.1±1.5 15.4±8.4#30.5±12.4#42.8±14.6 4.0±1.8 23.4±15.4 72.5±23.4 50.4±16.4 IL-6(pg/mL) 5.4±1.9 34.5±15.7 65.4±20.5 82.5±24.5 5.1±2.0 23.5±8.7 32.4±15.8 68.4±32.5 4.8±2.5 19.8±9.8 38.5±14.6 65.8±32.5 5.0±1.5 24.5±15.4 36.5±20.4 60.5±38.9 SOD(ng/mL) 166±16 111±19 89±10 116±10 160±16 125±15 110±26 129±9 158±19 126±22 106±13 124±8 162±16 131±11 108±11 133±12 MDA(nmol/L) 4.2±0.5 8.2±2.4 13.4±4.3 6.2±2.5 4.1±0.4 6.2±1.2 9.3±3.6 6.5±1.9 4.2±0.5 6.3±1.9 8.9±2.6 6.3±1.7 4.2±0.3 6.5±1.4 8.5±2.2 6.5±2.3 TM( g/L) 3.6±0.8 5.8±1.6 7.2±2.5 6.5±1.5 3.8±0.4 4.5±0.8 5.5±1.2 5.6±1.2 3.7±0.6 4.8±1.0 5.8±2.0 6.0±1.8 3.8±0.8 4.6±1.0 6.1±2.2 6.2±1.6 vWF( Kat/L)6.2±1.8 23.4±4.8 25.8±5.2 15.3±3.4 6.2±1.5 18.8±3.2 24.6±4.8 12.3±2.9 6.4±1.2 20.3±4.2 21.6±4.8 14.3±3.2 6.4±1.6 19.8±3.3 20.5±3.8 12.8±2.5
3 讨论
CPB和主动脉阻断可导致围术期的炎症反应及术后重要器官功能损伤,主要是由于CPB管道、循环的体液和细胞因子激活中性粒细胞和补体导致系统炎症反应。血浆炎症因子(TNF-α及IL-6)水平可以反映系统炎症反应的程度[8]。CPB心内直视手术过程中同样会产生大量氧自由基,可导致缺血-再灌注损伤。SOD和MDA是反映氧自由基水平的标志性指标。SOD是体内清除氧自由基的一种特异酶,其活性变化可反映体内清除氧自由基、抗氧化的能力。MDA是一种相当稳定的脂质过氧化产物,其血清水平的高低间接反映机体受氧自由基攻击的严重程度[9]。
本研究结果表明,经CPB后TNF-α,IL-6水平明显升高,机体炎症反应程度也随之提升,经乌司他丁预处理、后处理、联合处理后TNF-α,IL-6,MDA水平较对照组明显降低,而SOD水平明显升高,提示乌司他丁可抑制炎症反应、对抗氧自由基,这与文献[10]结果相符。
Song等[11]研究发现,乌司他丁预处理可以改善术后重要器官功能,而对术中TNF-α及IL-6水平无影响。这可能是由于乌司他丁预处理剂量(5 000 U/kg)较小,半衰期为33 min,不能覆盖整个CPB过程。本研究中T2,T3,T4均已超过其半衰期,可能是乌司他丁预处理和后处理都启动了内源性保护机制,进而保护SOD活性,增强清除氧自由基的能力,同时降低MDA在外周血的水平。
炎症免疫反应和氧自由基作为VEC损伤的2大主要因素[12]。VEC从组织血管表面脱落至外周血液中,成为CECs。Wittwer等[3]认为,较低的CECs数量反映VEC的完整性,而TM是细胞表面的凝血酶受体,主要表达于血管内皮细胞的膜表面。当机体VEC损伤时,TM从VEC表面脱落入血,引起血浆 TM水平升高。VEC是vWF的主要来源,vWF的主要功能是促进血小板与血管壁的黏附,从而促进血栓的形成,当CPB所致的VEC损伤活化,使vWF大量释放。
本研究结果表明,经乌司他丁处理后血浆TM及vWF浓度、CECs数量均明显降低,提示乌司他丁具有保护血管内皮细胞的作用。另外,本研究中探讨了不同给药时机对血管内皮保护作用的影响,仅在对于抑制TNF-α水平,后处理较预处理略强,提示后处理和预处理均可有效保护血管内皮细胞。这与 Cai等[13]报道一致。但与文献[14]报道缺血预处理和后处理存在协同效应来发挥器官保护作用的结果不相符。这可能由于本研究观测点仅限于手术开始到CPB后4 h,未对内源性的保护机制作进一步跟踪观察。
综上所述,乌司他丁预处理和后处理均对体外循环患者血管内皮细胞均具有一定的保护作用,其可能通过抑制炎症因子和氧自由基发挥作用。
[1]顾春虎,王云雅,易定华,等.体外循环对血管内皮细胞的急性损伤[J].心脏杂志,2007,19(1):82-87.
[2]Lee HZ,Yeh FT,Wu CH.The effect of elevated extracellular glucose on adherens junction proteins in cultured rat heart endothelial cells[J].Life Sci,2004,74(17):2 085-2 096.
[3]Wittwer T,Choi YH,Neef K,et al.Off-pump or minimized onpump coronary surgery-initialexperience with Circulating Endothelial Cells(CEC)as a supersensitive marker of tissue damage[J].Cardiothoracic Surg,2011,6:142.
[4]陈力勇,葛衡江,刘怀琼.体外循环对血管内皮细胞损伤/活化的临床研究[J].中华麻醉学杂志,2000,20(6):325-328.
[5]雷淑芬,周晓霞,魏以新.乌司他丁降低急性重症胰腺炎并发肺损伤的临床研究[J].中国药业,2010,19(11):85-86.
[6]祁行毅,胡强夫,黄维勤.乌司他丁在体外循环下冠状动脉旁路移植术中对心肌的保护作用[J].医药导报,2010,29(4):477-479.
[7]Skrabal CA,Choi YH,Kaminski A,et al.Circulating endothelial cells demonstrate an attenuation of endothelial damage by minimizing the extracorporeal circulation[J].Thorac Cardiovasc Surg,2006,132:291-296.
[8]Laffey JG,Boylan JF,Cheng DC.The systemic inflammatory response to cardiac surgery:implications for the anesthesiologist[J].Anesthesiology,2002,97(1):215-252.
[9]Liu JX,Li XZ,Ma XB,et al.Cardio-protective effects of Corocalm on acute myocardial ischemia/reperfusion injury in rats[J]. Chin J Integr Med,2006,12(3):199-202.
[10]李永领,朱烈烈,张 荣,等.乌司他丁对多发伤并发急性肺挫伤患者细胞因子的影响[J].医药导报,2008,27(7):804-806.
[11]Song J,Park J,Kim J-Y,et al.Effect of ulinastatin on perioperative organ function and systemic inflammatory reaction during cardiac surgery:a randomized double-blinded study[J].Korean J Anesthesiol,2013,64(4):334-340.
[12]Liu J,Zhang XY.Vascular endothelial cell injury and repair mechanisms[J].Clinical Rehabilitative Tissue Engineer Research,2009,13(50):9 997-10 000.
[13]Cai M,Li Y,Xu Y,et al.Endothalial NOS activity and myocardial oxygen metabolism define the salvageable ischemic time window for ischemic postconditioning[J].Am J Physiol Heart Circ Physiol,2011,300(3):H1 069-H1 077.
[14]Ye TM,Gao Q,Li YF,et al.Cardioprotective effect of ischemic postconditioning and preconditing against prolonged ischemia and reperfusion induced injury in isolated rat heart[J].Zhejiang Da Xue Xue Bao Yi Xue Ban,2007,36(1):35-40.
Protective Effects of Differert Conditionings of Ulinastatin on Vascular Endothelial Cells during Cardiopulmonary Bypass
Yang Peng,Hou Jun,Chen Chun,Tang Heqing,Ke Qibin,Lin Lei
(The First College of Clinical Medical Science,Three Gorges University,Yichang,Hubei,China 443003)
Objective To investigate the protective effect and mechanisms of ulinastatin on vascular endothelial cells during cardiopulmonary bypass.M ethods Eighty patients undergoing mitral valve and aortic valve replacement under CPB were randomly divided into 4 groups,20 cases in each group:Group A(control);Group B(pre-conditioning),Ulinastatin 20 000U/kg was injected to central vein after anesthesia and the aorta block before 10 minutes;Group C (post-conditioning),Ulinastatin 20 000 U/kg was added to CPB pre liquid after ascending aorta block;Group D (co-conditioning),Ulinastatin 10 000 U/kg was injected to central vein before ascending aorta block firstly,then the left was added to CPB pre liquid after ascending aorta block.Blood samples were taken before CPB(T1 baseline),5 min after aortic unclamping(T2),30 min(T3)and 4h(T4)after termination of CPB for determination of plasma concentrations ofTNF-α,IL-6,SOD and MDA.CECs were isolated and counted by using dynabeads coated with the specific antibody of CD146.ELISA was used to detect the levels of plasma TM and vWF.Results Compared with group A,the concentration of TNF-α at T2-3 and IL-6 at T2-4 were significantly lower in group B,C and D and the plasma concentration of SOD was significantly increased at T2-4 and MDA was significantly lower at T2-3 in group B,C and D.Compared to group A,the plasma TM concentration were significantly lower at T2-3 in group B,C,D and at T4 in group B than in group A.The plasma vWF concentration were significantly lower at T2,4 in group B,T2~3 in group C,T2-4 in group D as compared with group A.The number of CECs at T3 in group B,C and D was significantly decreased than that in group A.Conclusion Ulinastatin pre-conditioning and post-conditioning has certain protective effects on vascular endothelial cells during cardiopulmonary bypass in patients undergoing open heart surgery, which may relies on inhibiting the inflammatory factors and oxygen free radicals.
trypsin inhibitors;cardiopulmonary bypass;vascular endothelial cells;cardiopulmonary bypass;ulinastatin
R969.4;R972
A
1006-4931(2016)05-0046-04
杨鹏(1982-),男,湖北荆州人,主治医师,硕士研究生,研究方向为临床麻醉,(电子信箱)88452338@qq.com。
2015-07-28;
2015-10-01)
——体外循环质量控制的基石

