维生素D缺乏与神经精神疾病的关系研究进展
熊小平,庞海玲
(重庆市黔江区中心医院,重庆 409099)
维生素D缺乏与神经精神疾病的关系研究进展
熊小平,庞海玲
(重庆市黔江区中心医院,重庆 409099)
维生素D是一种类固醇激素,在机体钙磷代谢及骨成生中起重要作用。维生素D缺乏可引发佝偻病等疾病。近年来研究发现,维生素D缺乏与神经精神疾病关系密切,如痴呆、帕金森病、多发性硬化、癫痫及精神分裂症等。该文对维生素缺乏与上述几种疾病的关系进行了综述。
维生素D;神经精神疾病;痴呆;帕金森病;多发性硬化
维生素D缺乏最初主要发现于佝偻病,随后又发现其在老年人群中引发病理性骨折,其主要原因为缺乏日照或食物摄入不足。维生素D除了维持钙磷及骨骼系统的平衡外,还可调节很多组织细胞的功能,约3%的人/大鼠基因均受骨化三醇的调控。而在肾外,至少有10个组织能表达1-α-羟化酶(CYP2781),用于转化维生素D为活性状态,因此这种活性激素可以自分泌及旁分泌形式存在。目前认为,维生素D缺乏与肌肉无力、癌症、免疫性疾病、心血管疾病、代谢性疾病及部分神经系统疾病相关[1]。现将其对神经精神疾病的影响作如下综述。
1 维生素D的缺乏
维生素D是一种脂溶性维生素,存在于极少数食物(如鱼肝油)中,因此主要来源于皮肤合成。维生素D在体内主要以两种形式存在,即维生素D3及维生素D2。维生素D3形成于皮肤受紫外线照射后,维生素D2则来源于不同种类食物(如牛奶、鱼肝油等)在肠道中吸收。两者均在肝脏代谢转化成25-羟维生素D,其血浆半衰期为2~3周,为维生素D血液循环的主要形式,并在肝脏中储存。
维生素D在骨骼及肝脏中均有生物活性,但其生物活性不及1,25-二羟维生素D3(骨化三醇)的1%,后者为25-羟维生素D在肾脏转化合成,半衰期4~6 h。骨化三醇可与细胞核内的维生素D受体(VDR)结合,调节基因的表达。VDR广泛分布于有核细胞,为二类类固醇激素受体成员,类似于维甲酸及甲状腺激素受体。其主要功能为促进钙磷吸收,直接抑制甲状旁腺激素的释放,调节成骨细胞功能,允许甲状旁腺诱导的破骨作用及骨的吸收。
一般认为,维生素D缺乏与早产、深色皮肤色素沉着、居住在高纬度地区、肥胖、吸收不良及老年有关。美国国家健康及营养调查研究(NHANES)显示,2005年至2006年,41.6%≥20岁的成人 25-羟维生素 D血清质量浓度低于20 ng/mL(50 nmol/L);非白色人种、无高等学历、肥胖、低密度脂蛋白(HDL)、健康状况较差、每天不进食牛奶为低维生素D的独立危险因素;全球范围内,低维生素 D分布广泛,南亚及中东地区低于10 ng/mL(25 nmol/L)的人群较其他地区多[2]。我国北京、上海地区维生素D缺乏的中老年人约69.2%,西南地区高达80%~90%的人群血清25-羟维生素D水平可低于30 ng/mL(75 nmol/L)[3-4]。
目前,理想的25-羟维生素D血液浓度目前尚存争议,尚无基于正常人群及种族的正常值。临床认为,理想的25-羟维生素D的血清质量浓度为20~40 ng/mL (50~100 nmol/L)或30~50 ng/mL(75~125 nmol/L)。因此,其一般范围为30~40 ng/mL(75~100 nmol/L)。美国医学研究所(IOM)认为,低于20 ng/mL(50 nmol/L)为维生素降低,而美国内分泌协会(ENDO)则定为低于30 ng/mL(75 nmol/L);另外一些研究认为,25-羟维生素D(血液质量浓度)>50 ng/mL(125 nmol/L)对骨折患者有利,且能减少癌症风险及死亡率;而25-羟维生素D血清质量浓度<4.4 ng/mL(11 nmol/L)时,可导致1,25-二羟维生素D的合成减少,继发性引起甲状旁腺激素(PTH)水平增高[5]。
2010年,IOM发布了各年龄段钙及维生素D食物摄取量(见表1)。食物摄取维生素D作为维生素的补充,1至70岁的推荐食物摄取量为600 IU/d(15 mg/d);大于70岁的老人为800 IU/d(20 mg/d);妊娠期及哺乳期妇女为600 IU/d(15 mg/d);长期不能户外活动的老人,可能需要更多的维生素D食物补充;小于1岁婴儿食物摄取量为400 IU/d(10 mg/d);非母乳喂养的孩子可能需要更多的补充。该推荐食物摄取量以骨骼系统的标准制订,对于骨骼系统以外疾病的使用量不一定适用[6]。
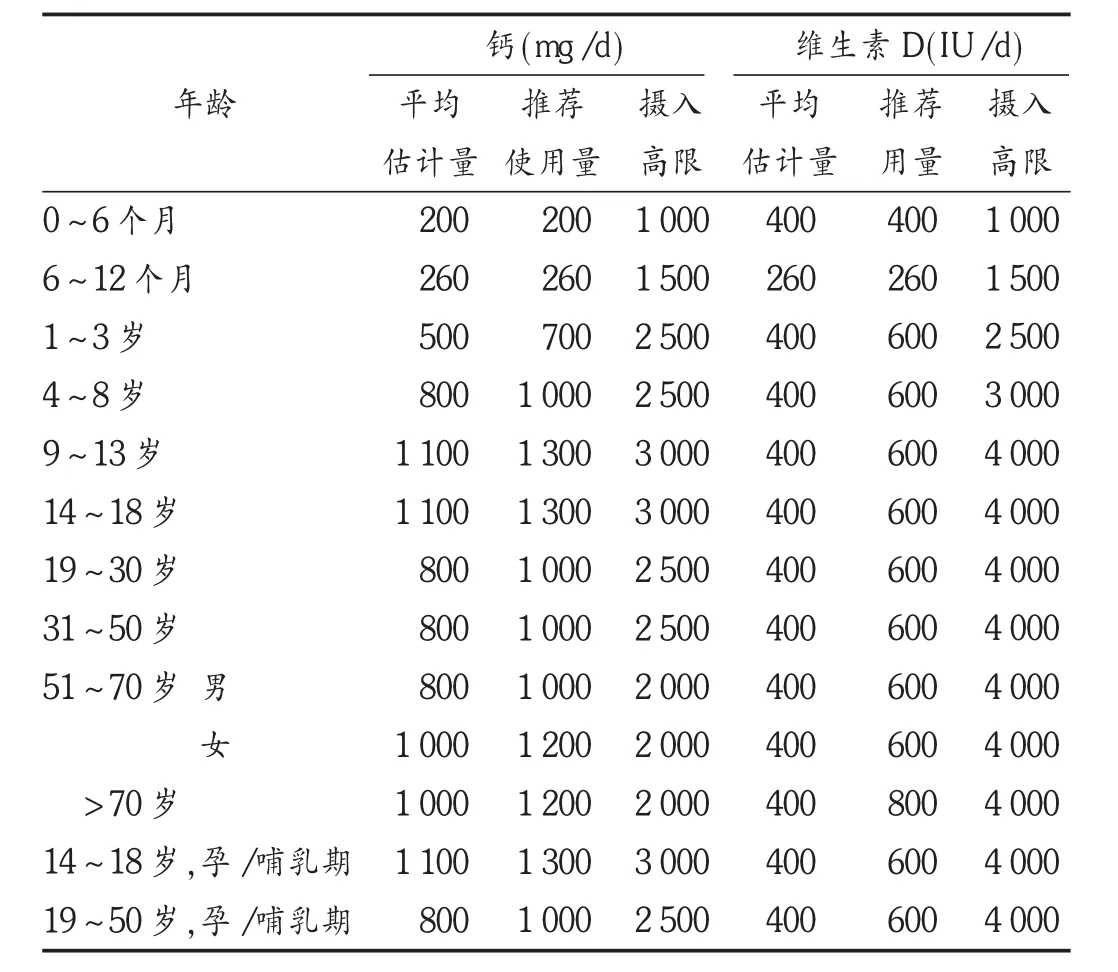
表1 各年龄段钙及维生素D的食物摄取量
2 对中枢神经系统的作用
大脑的发育与功能维持需要一些神经甾体,如甲状腺激素、糖皮质激素及雄激素。近年来通过脑脊液研究发现,维生素D也属于神经甾体。其衍生物在脑脊液中被发现,且能通过血脑屏障,这与之前已知的神经甾体很相似[5]。这些衍生物包括 25-羟维生素 D3、骨化三醇、24,25-二羟维生素D3,而这些代谢产物的衍生物在黑质及下丘脑中有较高表达。这两个区域均与运动有关,且是神经系统与内分泌系统的纽带。这些衍生物在该区域的出现,提示这一区域能利用维生素D合成这些产物。除了维生素D的代谢衍生物,其受体蛋白也在大脑中发现,主要集中在小脑、丘脑、下丘脑、基底节及海马,密度最高的结构为黑质,黑质与多巴胺的生成有关。另一个有意义的分布为下丘脑(视上核及室旁核)及额前叶的外颗粒细胞层。VDR同时也在海马CA1区及CA2区发现,但密度较小[7]。
维生素D3是一种有活性的类固醇酶,其在中枢神经系统的作用可能如下:首先,通过调控神经营养蛋白及有丝分裂,促进神经细胞的分化与成熟,因而具有神经营养功能;在体内,维生素D可能增加神经生长因子(GNF)、神经胶质细胞源性营养因子(GDNF)及神经营养蛋白3(TN3)的合成,减少神经营养蛋白4(TN4)的合成。同时,促进低亲和力的P75NTR受体合成,在小鼠海马细胞培养中出现了剂量依赖性的神经元生长,而神经生长因子参与维持神经元的生长发育。在小鼠胚胎及新生小鼠的研究中,低维生素D的小鼠其神经营养因子减少,有丝分裂增加,凋亡减少。另外,维生素D具有调节乙酰胆碱、多巴胺、5-羟色胺及γ-氨基丁酸等神经递质的作用[8]。
3 与神经精神疾病的关系
维生素D缺乏症与一些神经精神疾病相关,如老年性痴呆(AD)、帕金森病(PD)等,虽具体作用机制不清,但可能与神经元调亡有关。维生素D缺乏可引发细胞色素C表达减少,神经细胞周期减少而引发凋亡。细胞色素C可提高前凋亡因子的活性。另一种机制认为,与类似于神经生长因子的神经营养因子有关,神经营养因子可促进神经元的发育分化,维持成熟神经细胞的生长。
1)痴呆
AD是一种神经变性疾病,以记忆缺失及部分脑执行功能缺失为特征。AD的特点为皮质功能(如语言及运动技能)缺失,伴有大脑皮质和海马球广泛萎缩及脑室腔扩大。维生素D受体及1-α-羟化酶均在大脑内发现。在体内,活性维生素D可刺激巨噬细胞吞噬、清除淀粉样斑块,减少淀粉样蛋白诱导的细胞毒作用及皮质细胞的凋亡。高维生素D水平人群AD发病率明显下降,AD患者海马CA1区和CA2区VDR明显减少[7]。海马为边缘系统的一部分,具有记忆及空间定向的功能。特异性VDR单倍体可能与AD的发生有关,而这些在海马上的单倍体缺失可能阻止该部位某些功能如记忆等[9]。
在一项基于一般人群的组群研究中,包括了既往无痴呆、脑卒中的1 658例老年人,平均随访5.6年后有117例出现痴呆,其中102例为AD。采用考克斯比例风险模型分析发现,相对于维生素D充足的人群,维生素D严重缺乏(<25 nmol/L)及维生素D缺乏(≥25 nmol/L到<50 nmol/L)的人群痴呆多元校正风险率分别为2.25(95%CI:1.23~4.13)及 1.53 (95%CI:1.06~2.69);而 AD上述两类人群的多元校正风险率分别为2.22(95%CI:1.02~4.83)及 1.69 (95%CI:1.06~2.69)。提示维生素D缺乏可增加患者发生 AD、血管性痴呆的风险[10]。而另一项包含10 186人的研究提示,随访30年后也出现了类似结果。Afzal等[11]认为,维生素D具有神经保护作用,维生素D水平>50 nmol/L可减少痴呆的风险。
2)帕金森病
帕金森病是一种以运动障碍为特征的神经变性疾病,伴随有黑质区多巴胺神经元的丢失。在帕金森动物模型中,维生素D具有神经保护作用,可减少多巴胺神经细胞的丢失。其作用机制可能为:通过调节电压相关的钙通道,维持神经细胞内钙稳态,或调节钙相关胞浆蛋白如小清蛋白、钙结合蛋白合成。研究表明,维生素D缺乏在帕金森病的发生中扮演重要角色。有报道称,补充维生素D可减轻帕金森病的症状。另外,维生素D可调节谷胱甘肽转化酶的活性,促进合成谷胱甘肽,从而清除自由基及超氧化物,减少神经损伤。VDR基因敲除小鼠表现出与帕金森病相似的运动障碍。另一个作用机制为:维生素D缺乏可使Nurr1基因表达减少,该基因调节多巴胺神经元的发育,其表达减少可损伤多巴胺神经元的生长,减少多巴胺在基底节的聚集;而Nurr1基因敲除鼠表现为活动减少且出生后很快死去[12]。
3)多发性硬化
多发性硬化(MS)为中枢神经系统的脱髓鞘疾病,是一种自身免疫性疾病。髓鞘的功能为促进神经信号较快的传播,一旦损伤会引起信号传播功能障碍,从而引发运动功能缺失。具有调节免疫的生物活性维生素D为骨化三醇及其细胞核内受体VDR。动物研究发现,骨化三醇可减少 Th1淋巴细胞的反应,抑制干扰素-γ (IFN-γ),白细胞介素 -2(IL-2),肿瘤坏死因子-α (TNF-α),同时促进 Th2淋巴细胞的反应;还可增加IL10的表达,引起抗原提呈细胞转化及减少CD4+T细胞炎症增殖。在体内,携带有骨化三醇的T细胞不能产生CD40(一种复合突触刺激分子信号),抵制记忆T细胞的激活[13-14]。在实验性自身免疫性脑炎(EAE)大鼠中发现,1,25-二羟维生素D3能抑制自身免疫过程,而维生素D缺乏则增强了自身免疫的损伤,这一抑制作用在VDR基因敲除鼠中则消失。流行病学研究发现,48% ~71%多发性硬化患者血清25-羟维生素D3水平低于 20 ng/mL。在美国,血清维生素 D3水平低于20 ng/mL的青少年多发性硬化发病风险增加41%。另外,在一项包含77例多发性硬化患者及95例正常人的研究中发现,多发性硬化患者VDR基因型AA及A等位基因更普遍,提示其为多发性硬化的危险因子。蛋白激酶C(PKC)家族基因rs908742inPRKCZ及rs3783785inPRKCH不同等位基因的多态性与多发性硬化的复发有关。另外,两个内源性维生素D相关基因rs1993116inCYP2RI及rs7404928inPRKCB多态性与低水平的25-羟维生素D3相关[15]。多发性硬化发病率在高纬度地区较高,同时高维生素D在南部及西部地区比北部地区较高。基于这些相关性及其他研究,高维生素D的摄取可能减少多发性硬化的风险。
4)癫痫
癫痫为神经元异常放电,为一种患者反复抽搐的状态。1974年Christiansen研究发现,补充维生素D可减少癫痫的发作;维生素D可调节促癫痫及抗癫痫因子;维生素D可降低白细胞介素-6水平,而其为促癫痫因子;可提高神经营养因子水平,神经胶质细胞源性的生长因子GDNF及TN3,均为抗癫痫因子。维生素D缺乏会导致促癫痫因子不能降低,抗癫痫因子水平不能提高,从而致癫痫活动阈降低,维生素D也可促进钙与蛋白质的结合而起抗癫痫作用[7]。
5)精神分裂症
精神分裂症为以感知综合障碍及思维混乱为特征的神经精神性疾病,基因及发育异常与其相关。维生素D与胎儿期脑的发育有关,在胎儿期维生素D缺乏可引起神经营养因子NGF及GDNF水平减少。NGF可促进神经元转化,GDNF为胶质细胞源性神经营养因子,与多巴胺神经元的存活及分化有关[16]。
4 展望
目前发现,维生素D及其受体广泛分布于中枢神经系统,补充维生素D能减轻一些神经精神疾病的症状,但其主要功能及在中枢神经系统扮演的角色尚不清楚。特别是在神经变性性疾病如老年性痴呆,功能障碍性疾病如帕金森,神经免疫性疾病如多发性硬化,维生素D缺乏或维生素D受体功能障碍对这些疾病的影响均需进一步研究以明确,特别是维生素D受体功能及其调控机制均有极高的研究价值。
[1]Bouillon R.Vitamin D:From Photosynthesis,Metabolism and Action to Clinical Applications[M].In:Endocrinology,Jameson JL,De Groot LJ(Eds),Saunders Elsevier,Philadelphia,2010:1 018-1 037.
[2]Forrest KY,Stuhldreher WL.Prevalence and correlates of vitamin D deficiency in US adults[J].Nutr Res,2011,31(1):48-54.
[3]汪 纯,刘玉娟,肖文金,等.上海地区健康成年人25-羟维生素D水平及其与骨密度的关系[J].上海医学,2011,34(3): 166-170.
[4]杜 伟,甘承文,郭海波,等.重庆某研究所体检人群中维生素D水平的调查研究[J].第三军医大学学报,2013,35(7): 676-678.
[5]Institute of Medicine.Report at a Glance,Report Brief:Dietary reference intakes for calcium and vitamin D[EB/OL].http://www.iu.edu/~nutrvmg/n331/VitDandCa%20DRIreportSumm 2010.pdf.
[6]Misra M,Pacaud D,Petryk A,et al.Vitamin D deficiency in children and its management:review of current knowledge and recommendations[J].Pediatrics,2008,122:398-417.
[7]Polívka J,Polívka J Jr,Peterka M,et al.Vitamin D and neurological diseases[J].Vnitr Lek,2012,58(5):393-395.
[8]CedricAnnweiler,Anne-MarieSchott,Gillesberrut,etal.VitaminD and ageing neurological issues[J].Neuropsychobiology,2010,62: 19-150.
[9]Gezen-ak D,Dursun E,Bilgic B,et al.Vitamin D Receptor Gene Haplotype Is Associated with Late-Onset Alzheimer′s Disease[J].Tohoku Journal of Experimental Medicine,2012,228(3):189-196.
[10]Littlejohns TJ,Henley WE,Lang IA,et al.Vitamin D and the risk of dementia and Alzheimer disease[J].Neurology,2014,83(10): 920-928.
[11]Afzal S,Bojesen SE,Nordestgaard BG.Reduced 25-hydroxyvitamin D and risk of Alzheimer′s disease and vascular dementia[J].Alzheimers Dement,2014,10(3):296-302.
[12]Vinh Quôc Luong K.,Thi Hoàng Nguyên L..Vitamin D and Parkinson′s disease[J].Journal of Neuroscience Research,2012,92(12):2 227-2 236.
[13]Adzemovic MZ,Zeitelhofer M,Hochmeister S,et al.Efficacy of vitamin D in treating multiple sclerosis like neuroinflammation depends on develop mental stage[J].Exp Neurol,2013,249: 39-48.
[14]Drozdeko G,Scheel T,Jilek S,et al.Impaired T cell activation and cytokine production by calcitriol-primed human B cells[J].Clin Exp Immunol,2014,178:364-372.
[15]Rui Lin,Bruce V Taylor,Steve Simpson Jr,et al.Novel modulating effects of PKC family genes on the relationship between serum vitamin D and relapse in multiple sclerosis[J].J Neurol Neurosurg Psychiatry,2014,85:399-404.
[16]Picchioni MM,Murray RM.Schizophrenia[J].Current,2007,335:91-95.
Vitamin D Deficiency and Neuropyschiatric Disorders
Xiong Xiaoping,Pang Hailing
(Qianjiang Central Hospital,Chongqing,China 409099)
Vitamin D is a secosteroid hormones that is typically associated with phosphocalcic homeostasis and osteogenesis.Vitamin D is related to rickets and other diseases.Recently some studies demonstrated that vitamin D deficiency played important role in many neuropsychiatric disorders such as dementia,Parkinson′s disease,multiple sclerosis,epilepsy,schiaophrenia,In this article,we will review the relationship of Vitamin D deficiency and the above diseases.
vitamin;D neuropsychiatric disorders;dementia;Parkinson′s disease;multiple sclerosis
R363;R977.2+4
A
1006-4931(2016)05-0001-04
熊小平,男,副主任医师,主要从事临床精神科工作,(电子信箱)hanse188@163.com;庞海玲,女,副主任护师,主要从事临床精神科工作,本文通讯作者,(电子信箱)282764589@qq.com。
2015-07-28)
重庆市卫生局科研项目,项目编号:2011-2-546。

