术前调强放疗对四肢软组织肉瘤细胞增殖和凋亡的影响
周 洋, 谢鹏鸣, 许素玲, 周 梅, 白靖平
(新疆医科大学附属肿瘤医院1骨与软组织科,2放疗中心,3病理科, 乌鲁木齐 830011)
术前调强放疗对四肢软组织肉瘤细胞增殖和凋亡的影响
周洋1, 谢鹏鸣1, 许素玲2, 周梅3, 白靖平1
(新疆医科大学附属肿瘤医院1骨与软组织科,2放疗中心,3病理科, 乌鲁木齐830011)
摘要:目的探讨术前调强放射治疗(IMRT)对四肢软组织肉瘤细胞增殖与凋亡的影响。方法选取新疆医科大学附属肿瘤医院骨与软组织科2012年1月-2013年12月术前IMRT+手术的软组织肉瘤患者23例。收集每例患者的活检及手术后石蜡组织块,自身IMRT前、后对照。采用免疫组织化学染色检测Ki-67的表达,用增殖指数(PI)表示;应用TUNEL法测定肿瘤细胞凋亡,用凋亡指数(AI)表示。比较IMRT前、后及不同临床分期对PI、AI和AI/PI的影响。结果IMRT后PI明显低于IMRT前(P<0.05);IMRT后AI明显高于IMRT前(P<0.05);IMRT后AI/PI明显高于IMRT前(P<0.05);IMRT前Ⅲ期患者的PI和AI明显高于Ⅱb期,IMRT后Ⅲ期患者的PI低于Ⅱb期,AI高于Ⅱb期,差异均有统计学意义(P均<0.05);调强放疗后Ⅱb期和Ⅲ期的AI/PI与调强放疗前比较差异均有统计学意义(P均<0.05),但IMRT前和IMRT后不同临床分期AI/PI比较差异无统计学意义。结论IMRT可以诱导软组织肉瘤细胞的凋亡,抑制软组织肉瘤细胞的增殖。AI/PI在IMRT前、后的变化可以评价术前放疗的疗效。
关键词:调强放疗; 软组织肉瘤; 增殖指数; 凋亡指数; Ki-67
目前临床上四肢软组织肉瘤(STS)的主要治疗手段为手术治疗,随着治疗理念和外科技术的不断进步,保肢手术的适应证逐渐放宽。由于辅助治疗技术的发展,使得局部晚期的STS患者经过辅助放化疗的干预,保肢率有较大提高。研究发现,术前放疗在软组织肉瘤的治疗中的疗效已得到肯定,术后伤口并发症发生率高[1-3]。有关精确放疗在STS中的应用报道较少。本研究采用调强放疗(IMRT)技术对四肢STS患者进行术前放疗,检测IMRT前、后STS组织Ki-67的表达(PI,增殖指数)和凋亡情况(AI,凋亡指数),旨在探讨术前IMRT对软组织肉瘤细胞增殖和凋亡的影响,为软组织肉瘤IMRT更进一步的基础研究、术前IMRT疗效判定和疾病预后的评估提供客观依据。
1材料与方法
1.1一般资料选择新疆医科大学附属肿瘤医院骨与软组织科2012年1月-2013年12月收治的局部晚期四肢STS患者23例。纳入标准:(1)病理诊断明确为四肢软组织肉瘤的初治患者;(2)美国癌症分期联合委员会(AJCC)软组织肉瘤分期为Ⅱb~Ⅲ期者;(3)影像学评估无安全外科边界(毗邻重要血管、神经及骨骼等组织,局部晚期)者;(4)无放疗禁忌证;(5)自愿接受术前放疗者。排除合并严重慢性疾病、其他恶性肿瘤、依从性差、既往有放疗史及放疗区域皮肤异常的患者。23例局部晚期四肢STS患者术前IMRT后均行肿瘤R0切除。其中男性13例,女性10例,中位年龄34.5岁;原发部位:小腿5例,大腿7例,上臂6例,肩胛区1例,踝关节区1例,膝关节区1例,臀部2例;AJCC临床分期:Ⅱb期11例,Ⅲ期12例;病理类型:滑膜肉瘤5例,尤文氏肉瘤3例,多形性肉瘤(恶性纤维组织细胞瘤)2例,原始神经外胚层肿瘤(PNET)2例,上皮样肉瘤2例,恶性神经鞘瘤2例,纤维肉瘤4例,脂肪肉瘤3例。收集23例患者IMRT前穿刺活检肿瘤石蜡组织块和IMRT后手术大体标本肿瘤石蜡组织块,进行自身IMRT前、后对照。
1.2主要试剂即用型鼠抗人Ki-67单克隆抗体(ZM-0165)、PV超敏试剂盒、DAB试剂盒(北京中杉金桥生物技术有限公司),TUNEL细胞凋亡检测试剂盒(武汉博士德生物工程有限公司)。
1.3方法每个蜡块连续切片4张,厚度4 μm,采用免疫组织化学(PV二步法)检测Ki-67的表达,应用TUNEL法检测原位细胞凋亡,免疫组化阴性对照由PBS代替一抗,原位细胞凋亡检测阴性对照用PBS代替标记液,以试剂公司提供的阳性对照片作为阳性对照。
1.4结果判定
1.4.1免疫组化法检测Ki-67的表达Ki-67阳性表达可见肿瘤细胞核有棕黄色颗粒,随机计数10个高倍(40×10倍)视野,每个视野连续计数100个细胞的阳性细胞数,其平均数记为Ki-67增殖指数(Proliferation index,PI)[4]。
1.4.2TUNEL法检测原位细胞凋亡凋亡细胞:荧光显微镜下细胞核中有黄绿色颗粒者;普通显微镜下细胞核中有棕黄色颗粒者。随机计数10个高倍(40×10倍)视野,每个视野连续计数100个细胞的阳性细胞数,其平均数记为凋亡指数(Apoptosis index,AI)[5]。
1.5统计学处理采用SPSS18.0软件包进行数据处理,所测计量资料数据以均数±标准差(-x±s)表示,采用配对资料的符号秩和检验比较IMRT前、后的差异,采用t检验进行均数的比较,检验水准α=0.05。
2结果
2.1调强放疗前、后PI、AI和AI/PI的比较调强放疗后的Ki-67蛋白阳性细胞数少于调强放疗前(图1A、1B);调强放疗前PI为(63.02±17.93),调强放疗后PI为(36.56±18.47),调强放疗后PI明显低于调强放疗前,差异有统计学意义(Z=-3.361,P=0.001)。调强放疗后凋亡细胞数量高于调强放疗前(图2A~2D);调强放疗前AI为(24.25±6.34),调强放疗后AI为(35.07±13.71),调强放疗后AI明显高于调强放疗前,差异有统计学意义(Z=-2.840,P=0.005)。调强放疗前AI/PI为(0.433±0.205),调强放疗后AI/PI为(1.262±0.779),调强放疗后AI/PI明显高于调强放疗前,差异有统计学意义(Z=-3.367,P=0.005)。
2.2临床分期对调强放疗前后PI、AI和AI/PI的影响调强放疗前Ⅲ期患者的PI和AI明显高于Ⅱb期,调强放疗后Ⅲ期患者的PI低于Ⅱb期患者,AI高于Ⅱb期患者,差异均有统计学意义(P均<0.05);调强放疗后Ⅱb期和Ⅲ期的AI/PI与调强放疗前比较差异均有统计学意义(P均<0.05),但IMRT前和IMRT后不同临床分期AI/PI比较差异无统计学意义,见表1。
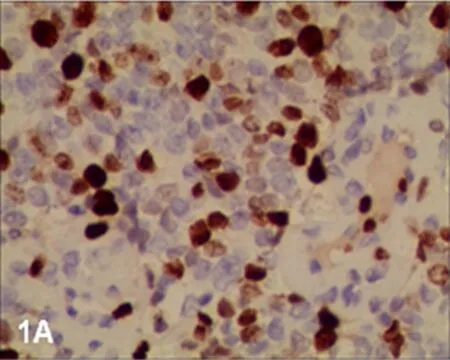
图1AIMRT前Ki-67蛋白的表达(IHC×400)

图1B IMRT 后Ki-67 蛋白的表达(IHC×400)
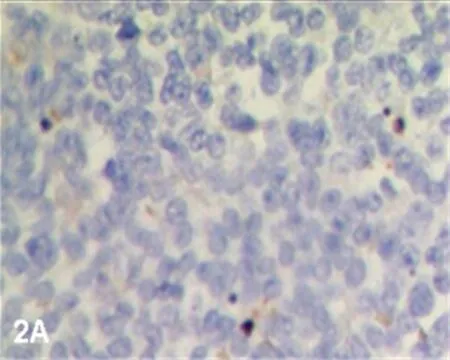
图2AIMRT前(TUNEL法 光镜×400)
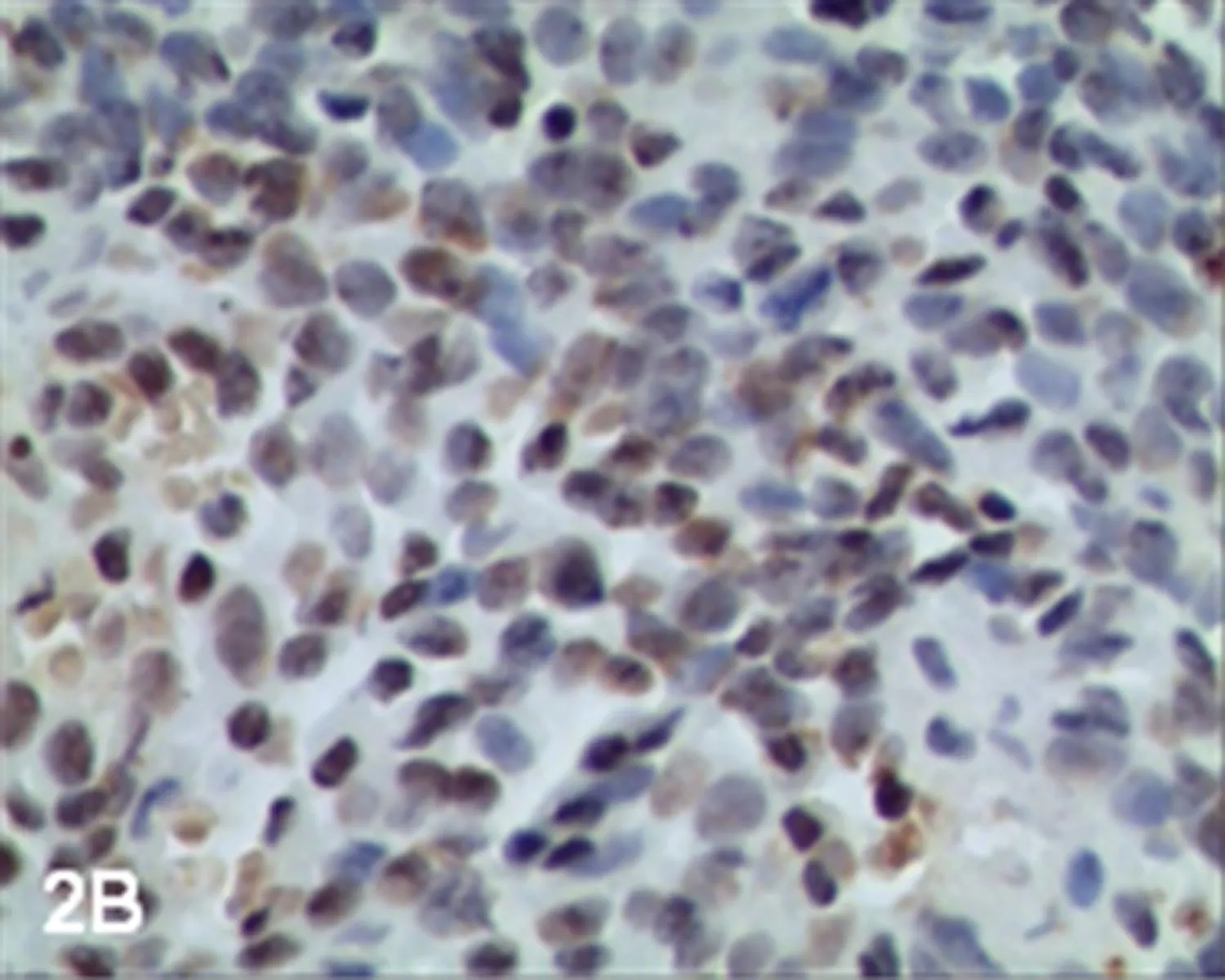
图2BIMRT后(TUNEL法 光镜×400)
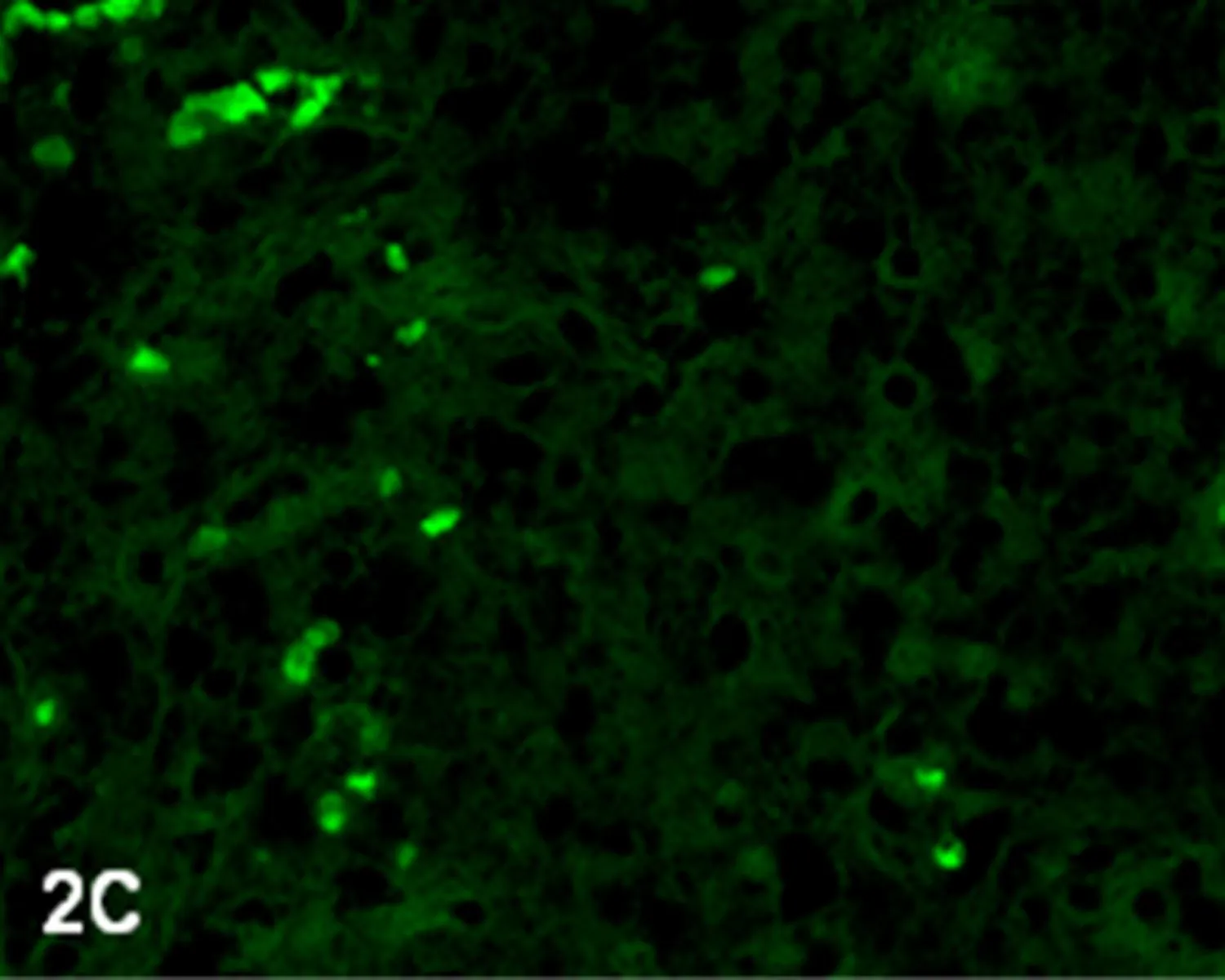
图2CIMRT前(TUNEL法 荧光显微镜×400)
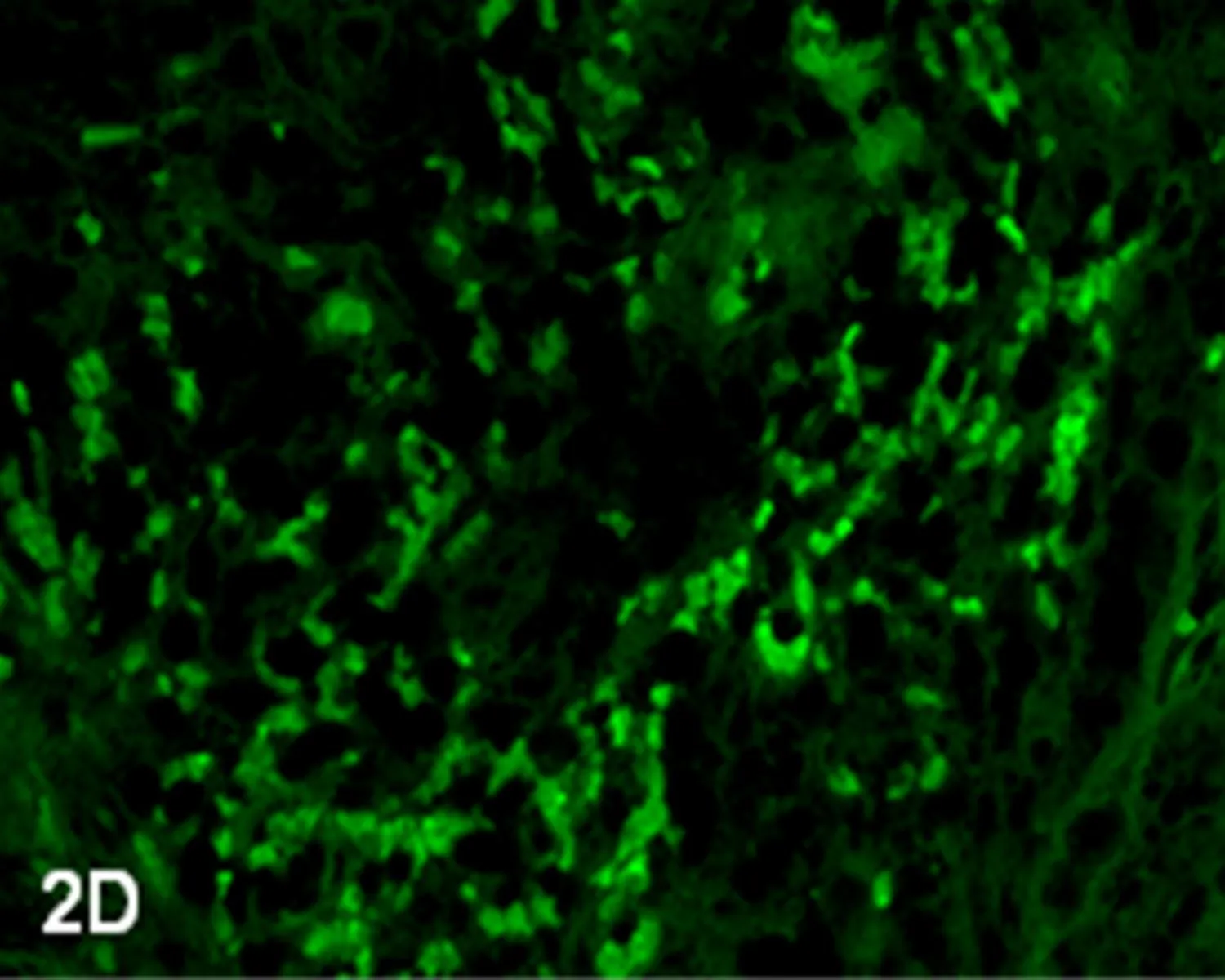
图2DIMRT后(TUNEL法 荧光显微镜×400)

表1 不同临床分期IMRT前、后PI、AI和AI/PI的比较(-x±s)
注:与Ⅱb期比较,*P<0.05;与IMRT前比较,△P<0.05。
3讨论
软组织肉瘤是起源于间叶组织、发生在骨骼肌等软组织的一类原发性恶性肿瘤。传统治疗方式多为截肢或局部切除。尽管截肢能获得较好的局部控制,但手术后生活质量明显下降。因肿瘤紧邻血管神经束,为了保留患肢功能,局部切除后常无法保证切缘阴性或小切缘,故单纯局部切除因受局部解剖因素的限制,难以达到广泛切除的边界,复发率高。软组织肉瘤的复发率高与切缘阳性率高直接相关[6-7]。
术前放疗用于保肢手术的辅助治疗效果已得到肯定[8]。术前放疗还可以杀灭“反应区”内的“卫星灶”,减少手术操作可能造成的肿瘤播散或种植,在提高保肢率的同时可取得较高的局部控制率。目前关于软组织肉瘤术前放疗多为常规放疗,疗程长,放疗后纤维化及术后切口并发症发生率高。本研究将IMRT技术用于软组织肉瘤术前放疗,可降低术前放疗的毒性反应,同时保证疗效。
Ki-67能可靠地反映细胞的增殖活性,有利于恶性肿瘤治疗方法的选择和治疗效果的评估。Ki-67表达越高,肿瘤对放射线照射越敏感[9]。以Ki-67表达变化来评估新辅助放疗对肿瘤细胞增殖的影响,在其他肿瘤的研究中已有相关报道。Andrade等[10]报道新辅助放化疗后,直肠癌组织中以Ki-67标记的肿瘤增殖指数明显下降下降。Hafeez等[11]研究表明Ki-67的表达是早期乳腺癌患者保乳术后的预后因素之一,治疗后Ki-67表达越高,预后越差,反之,预后越好。
软组织肉瘤病理分级对临床分期影响较大,Ⅱb期与Ⅲ期病理分级分别为G2和G3,其余分期指标基本一致。本研究表明,尤文氏肉瘤、滑膜肉瘤及多形性肉瘤(Ⅲ期)等的Ki-67表达较高,增殖指数越高,放射敏感性好,疗效好;相反,脂肪肉瘤、纤维肉瘤及恶性神经鞘瘤(Ⅱb期)等的Ki-67表达相对较低,增殖指数较低,这与软组织肉瘤生物学行为相符。本组患者IMRT后Ki-67的表达(增殖指数)较IMRT前明显下降(P<0.05),Ⅱb期和Ⅲ期患者在IMRT前、后增殖指数的差异有统计学意义(P<0.05),说明术前IMRT能降低软组织肉瘤细胞增殖活性,抑制肿瘤细胞的生长。Ki-67标记的增殖指数能较好地反映术前IMRT的敏感性,术前IMRT后增殖指数的降低可能提示软组织肉瘤患者较好的预后。
细胞凋亡是有别于细胞坏死的一种细胞死亡形式,是一种程序化过程。近年来的研究表明,细胞凋亡与肿瘤的发生、发展、疗效及预后密切相关,已成为肿瘤研究的热点[12]。放射线可以诱导细胞凋亡[13],达到控制或消灭肿瘤的目的,放疗后如果肿瘤组织凋亡指数(AI) 明显上调,说明肿瘤细胞对放疗敏感,疗效及预后相对较好。
刘福坤等[14]研究术前辅助放疗对直肠癌细胞增殖和凋亡的影响,结果显示:新辅助放疗后直肠癌细胞的凋亡指数高于治疗前,差异有统计学意义,提出放疗主要通过促进癌细胞凋亡产生治疗作用。
本研究结果显示:恶性程度较高的软组织肉瘤,如尤文氏肉瘤、滑膜肉瘤和多形性肉瘤等Ⅲ期患者经术前IMRT后,肿瘤细胞凋亡指数较治疗前明显升高(P<0.05);脂肪肉瘤、纤维肉瘤和恶性神经鞘瘤等Ⅱb期患者IMRT后凋亡指数也有增高,差异也有统计学意义(P<0.05),但变化程度不如尤文氏肉瘤等显著,这与此类肿瘤对放射线敏感程度较高有关。本研究结果显示:IMRT后凋亡指数较治疗前明显升高,说明IMRT可不同程度地诱导软组织肉瘤细胞的凋亡,从而可以通过治疗前、后的凋亡情况评价软组织肉瘤新辅助放疗的疗效。
肿瘤细胞的增殖与凋亡是评价治疗敏感程度和疾病预后的重要指标。放射线是通过诱导细胞凋亡,抑制细胞增殖来清除肿瘤细胞,因此术前IMRT疗效应以凋亡和增殖的综合因素评价。本研究采用AI/PI作为判定术前IMRT疗效的指标,结果显示IMRT前和IMRT后不同临床分期AI/PI比较差异无统计学意义,认为AI/PI更能客观、准确、稳定地评估软组织肉瘤新辅助放疗的疗效。AI、PI及AI/PI可否作为软组织肉瘤预后判断的指标,还需长期随访,分析其与复发、转移等临床特征的关系,进一步深入研究。
参考文献:
[1]Dagan R, Indelicato DJ, McGee L, et al. The significance of a marginal excision after preoperative radiation therapy for soft tissue sarcoma of the extremity[J]. Cancer, 2012,118(12):3199-3207.
[2]Riad S, Biau D, Holt GE, et al. The clinical and functional outcome for patients with radiation-induced soft tissue sarcoma[J]. Cancer, 2012,118(10):2682-2692.
[3]Sampath S, Schultheiss TE, Hitchcock YJ, et al. Preoperative versus postoperative radiotherapy in soft tissue sarcoma: multi-institutional analysis of 821 patients[J]. Int J Radiat Oncol Biol Phys, 2011, 81(2):498-505.
[4]付文娟, 李琪佳, 甘洪全, 等. TRAIL、Ki-67蛋白在人骨肉瘤中表达及其与肿瘤细胞增殖和凋亡的关系[J].中国肿瘤临床,2011,38(1):20-23.
[5]夏文彬, 孙燕, 赵秀兰, 等. 细胞增殖微血管密度及临床病理学参数对滑膜肉瘤复发的影响[J].中国肿瘤临床,2010,37(4):201-204.
[6]Sugiura H, Nishida Y, Nakashima H, et al. Surgical procedures and prognostic factors for local recurrence of soft tissue sarcomas[J]. J Orthop Sci, 2014, 19(1):141-149.
[7]Alamanda VK, Crosby SN, Archer KR, et al. Predictors and clinical significance of local recurrence in extremity soft tissue sarcoma[J]. Acta Oncol, 2013, 52(4):793-802.
[8]Townley WA, Mah E, O'Neill AC, et al. Reconstruction of sarcoma defects following preoperative radiation: free tissue transfer is safe and reliable[J]. J Plast Reconstr Aesthet Surg, 2013,66(11):1575-1579.
[9]Freudlsperger C, Freier K, Hoffmann J, et al. Ki-67 expression predicts radiosensitivity in oral squamous cell carcinoma[J]. Int J Oral Maxillofac Surg, 2012,41(8):965-969.
[10]Andrade NR, Oshima CTF, Gomes TS, et al. Imunoexpression of Ki-67 and p53 in rectal cancer tissue after treatment with neoadjuvant chemoradiation[J].J Gastrointestinal Cancer, 2011,42(1): 34-39.
[11]Hafeez F, Neboori HJ, Harigopal M, et al. Is Ki-67 expression prognostic for local relapse in early-stage breast cancer patients treated with breast conservation therapy(BCT)?[J]. Int J Radiat Oncol Biol Phys,2013, 87(2):344-348.
[12]董广璐, 张淑云, 邢丽娜,等. 宫颈癌放疗前后肿瘤细胞凋亡及其相关基因的变化[J]. 中国肿瘤临床,2004,31(19):1098-1100.
[13]Zhao L, Bode AM, Cao Y, et al. Regulatory mechanisms and clinical perspectives of miRNA in tumor radiosensitivity[J]. Carcinogenesis, 2012, 33(11):2220-2227.
[14]刘福坤, 陈彻, 祁晓平,等. 术前辅助放疗对直肠癌细胞增殖和凋亡的影响[J]. 中华胃肠外科杂志, 2005, 8(1):71-73.
(本文编辑王艳)
The effect of prepoperative intensity modulated radiation therapy on cell
proliferation and apoptosis in the limb soft tissue sarcoma
ZHOU Yang1, XIE Pengming1, XU Suling2, ZHOU Mei3, BAI Jingping1
(1DepartmentofBoneandSoftTissueOncology,2DepartmentofRadiationOncology,
3DepartmentofPathology,theAffiliatedTumorHospital,XinjiangMedicalUniversity,
Urumqi830011,China)
Abstract:ObjectiveTo investigate the effect of preoperative intensity-modulated radiation therapy (IMRT) on proliferation and apoptosis in limbs soft tissue sarcoma. MethodsThe 23 limbs soft tissue sarcoma patients in treatment of preoperative IMRT + surgery between January 2012 and December 2013 in department of Bone and soft tissue oncology of the affiliated tumor hospital in Xinjiang Medical University were selected and analyzed by self-contrast study. The expression of Ki-67 was detected by immunohistochemical technique, indicated with the proliferation index (PI) and apoptosis index (AI) was detected by TUNEL. ResultsPI after IMRT was significantly lower than that before IMRT (P<0.05); AI after IMRT was significantly higher than that before IMRT (P<0.05); AI/PI after IMRT was significantly higher than that before IMRT (P<0.05). Before IMRT, PI and AI in stage Ⅲ were significantly higher than stage Ⅱb; after IMRT, PI in stage Ⅲ was below than that in stage Ⅱb, while AI in stage Ⅲ was higher than that in stage Ⅱb, in which the differences were statistically significant (P<0.05); in clinical staging Ⅱb and Ⅲ, the differences of AI/PI before and after IMRT were statistically significant (P<0.05); before and after IMRT, the differences of AI/PI in different clinical stages were not statistically significant (P>0.05). ConclusionIMRT can induce apoptosis of soft tissue sarcoma cells and inhibit the proliferation, and AI/PI ratio can evaluate the effect of preoperative IMRT in limbs soft tissue sarcoma.
Keywords:intensity-modulated radiation therapy; soft tissue sarcomas; proliferation index; apoptosis index; Ki-67
通信作者:姚华,男,教授,博士生导师,研究方向:健康管理,E-mail:535052988@qq.com。
作者简介:王育珊(1983-),女,卫生事业管理主管医师,硕士,研究方向:健康管理。
基金项目:新疆维吾尔自治区科技计划项目(201517102)
[收稿日期:2015-04-20]
doi:10.3969/j.issn.1009-5551.2016.01.017
中图分类号:R738.6
文献标识码:A
文章编号:1009-5551(2016)01-0077-04

