米托蒽醌通过活性氧诱导大鼠肝癌RH35细胞凋亡的研究
张亚宏,甘 莹,齐建国,王建红
(河南大学,天然药物与免疫工程重点实验室,开封475004)
米托蒽醌通过活性氧诱导大鼠肝癌RH35细胞凋亡的研究
张亚宏,甘 莹,齐建国*,王建红*
(河南大学,天然药物与免疫工程重点实验室,开封475004)
摘 要:试验旨在探讨米托蒽醌(mitoxantrone,MTN)对大鼠肝癌RH35细胞毒性及其作用机制。以MTT法检测MTN的细胞毒性,显微镜观察细胞形态变化,流式细胞仪检测细胞凋亡率及细胞中活性氧(reactive oxygen species,ROS)的产生,Western blotting检测相关蛋白的表达。结果显示,MTN时间和剂量依赖性地抑制RH35细胞的生长;15μmol/L MTN作用于细胞24、48h后可使细胞皱缩、变圆,并出芽形成明显的凋亡小体,且其可时间依赖性地诱导凋亡细胞比率的增加及ROS的产生;ROS清除剂NAC可以极显著降低MTN诱导的RH35细胞的ROS的产生和凋亡率(P<0.01);15mmol/L NAC可以下调MTN诱导的caspase-3、Bax及CytC表达增加,上调MTN诱导的Bcl-2表达降低。结果提示,MTN通过增加细胞内ROS而诱导RH35细胞发生凋亡。
关键词:米托蒽醌;凋亡;RH35细胞;活性氧
肝癌是中国仅次于胃癌、食道癌的第三大常见恶性肿瘤,其恶性程度高,发展迅速,早期症状不明显,往往造成根治性手术治疗困难[1-2]。药物治疗仍是目前肝癌治疗的重要方法,但是肝癌细胞对化疗药物具有不敏感性[3],因此,阐明药物的抗肝癌机制对肝癌的治疗至关重要。米托蒽醌(mitoxantrone,MTN)是蒽醌类细胞周期非特异性广谱抗肿瘤药物,心脏毒性较小,临床上主要用于治疗恶性淋巴瘤、乳腺癌和急性白血病,对肺癌、黑色素瘤、卵巢癌等也有一定的疗效[4-5]。临床研究表明,MTN对肝癌具有良好的疗效,但是其具体机制还不甚明了[6-7]。凋亡是很多化疗药物杀伤肿瘤细胞的有效机制[8],研究表明,MTN可以诱导多种肿瘤细胞发生凋亡,进而达到杀伤肿瘤细胞的效果。齐美颖等[9]发现MTN可以激活内、外源性凋亡通路诱导人骨髓瘤细胞RPMI8226凋亡;王炜等[10]阐明MTN通过抑制PI3K/Akt信号通路诱导人鼻咽癌CNE-2细胞发生凋亡;魏建勋等[11]发现MTN通过抑制Mcl-1再抑制人卵巢癌COC1细胞增殖诱导其凋亡;Kostrzewa-Nowak等[12]发现MTN可以诱导人白血病HL60细胞及其耐药细胞HL60/DOX发生凋亡。本研究选用大鼠肝癌RH35细胞为研究对象,研究MTN对该肿瘤细胞凋亡诱导作用并探讨其机制,为其在抗肝癌中的应用提供理论依据。
1 材料与方法
1.1材料
大鼠肝癌RH35细胞系购自武汉博士德生物工程有限公司。MTN购自中国药品生物制品检定所;甲基噻唑蓝(MTT)、二甲基亚砜(DMSO)、N-乙酰半胱氨酸(N-acetylcysteine,NAC)和2,7-二氯荧光黄双乙酸盐(DCF-DA)均购自美国Sigma公司;caspase-3、Bax、Bcl-2、CytC及β-actin的单克隆抗体均购自Santa Cruz Biotechnology公司;辣根过氧化酶标记的羊抗兔、羊抗鼠二抗均购自武汉博士德生物工程有限公司;RPMI 1640培养基和胰蛋白酶均购自美国Gibco公司;胎牛血清购自北京元亨圣马生物试剂公司;Annexin V-FITC/PI凋亡检测试剂盒购自碧云天生物技术研究所。
1.2细胞培养
大鼠肝癌RH35细胞单层接种在含10%胎牛血清的RPMI 1640培养液中,在37℃、5%CO2培养箱中培养,每2~3d传代一次。
1.3MTT检测细胞生长抑制
取对数生长期的RH35细胞,以每孔1.0×104个细胞接种于96孔板,每孔100μL,培养24h后,加入不同浓度(1、5、10、30、50μmol/L)的MTN。每组设置3个重复,同时设置阴性对照。置于培养箱中继续培养12、24及48h后,每孔加入MTT(5g/L)10μL再培养3h后,弃上清液,每孔加入150μL DMSO溶解,于酶标仪下测定各孔吸光值(A492nm值),根据以下公式计算抑制率:
抑制率(%)=[A492nm(阴性)-A492nm(给药)]/[A492nm(阴性)-A492nm(空白)]×100%
1.4细胞形态学观察
取对数生长期的RH35细胞,以每孔5.0×105个细胞接种于6孔板中,培养24h后加入15μmol/L MTN,置于培养箱中继续培养24、48h后,用倒置显微镜观察细胞形态并拍照。
1.5流式细胞仪检测细胞凋亡率和细胞内活性氧
取对数生长期的RH35细胞,以每瓶1×106个细胞分瓶,培养24h后,加入15μmol/L MTN,置于培养箱中继续培养12、24、36及48h;或加入5mmol/L NAC作用1h后加入15μmol/L MTN,继续培养24h。收集细胞,用PBS清洗1次,根据Annexin V-FITC/PI染色试剂盒说明操作后,流式细胞仪分析,计算细胞凋亡率;或加入5μmol/L DCF-DA染液,37℃孵育30min,于激发波长513nm、发射波长530nm下用流式细胞仪检测细胞内活性氧(ROS)水平。
1.6Western blotting分析
取对数生长期的RH35细胞,以每瓶1×106个细胞分瓶,培养24h后,加入5mmol/L NAC作用1h后加入15μmol/L MTN,继续培养24h。收集细胞,用100μL细胞裂解液冰浴裂解1h,15 000r/min离心5min,收集上清。加入5×上样缓冲液,沸水中煮沸3min,使蛋白质变性。Bio-Rad法进行蛋白定量后以12%SDS-PAGE凝胶电泳分离蛋白质。电泳后将蛋白转印至硝酸纤维素膜上,5%脱脂奶粉封闭后,一抗封闭过夜,再以辣根过氧化酶标记的二抗封闭液封闭2h,以二氨基联苯胺溶液显色,扫描记录。
1.7统计分析
试验数据用平均值±标准差表示。用SPSS 13.0软件中的One-Way ANOVA进行统计比较,P<0.05为差异显著性判断标准。
2 结果与分析
2.1MTN对RH35细胞的细胞毒性
MTN可时间和剂量依赖性地抑制RH35细胞生长。由图1可知,1~50μmol/L MTN对RH35细胞生长具有不同程度的抑制作用,且随着MTN浓度增强,作用时间延长,其对RH35的毒性也在增强。其在12、24和48h的IC50值分别为22.46、14.92和10.1μmol/L。在24h时,15μmol/L MTN可诱导明显的生长抑制,因此,选用其为以下研究的浓度。
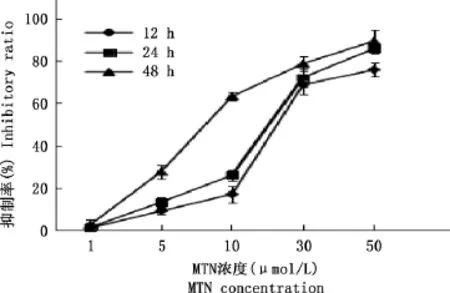
图1 MTN对RH35细胞的细胞毒性Fig.1 Cytotoxic effects of MTN on RH35cells
2.2MTN诱导RH35细胞凋亡
显微镜下发现,正常对照组细胞形态完整,细胞连接紧密,无死亡细胞(图2A),而15μmol/L MTN作用于细胞24、48h后,细胞发生明显的形态学变化,细胞皱缩、变圆,并出芽形成明显的凋亡小体(图2B、2C)。此外,流式细胞术结果提示,15μmol/L MTN作用于细胞12、24、36及48h后,凋亡细胞比率(早期凋亡细胞+晚期凋亡细胞)呈时间依赖性增加,表明MTN可以时间依赖性地诱导RH35细胞发生凋亡(图3)。
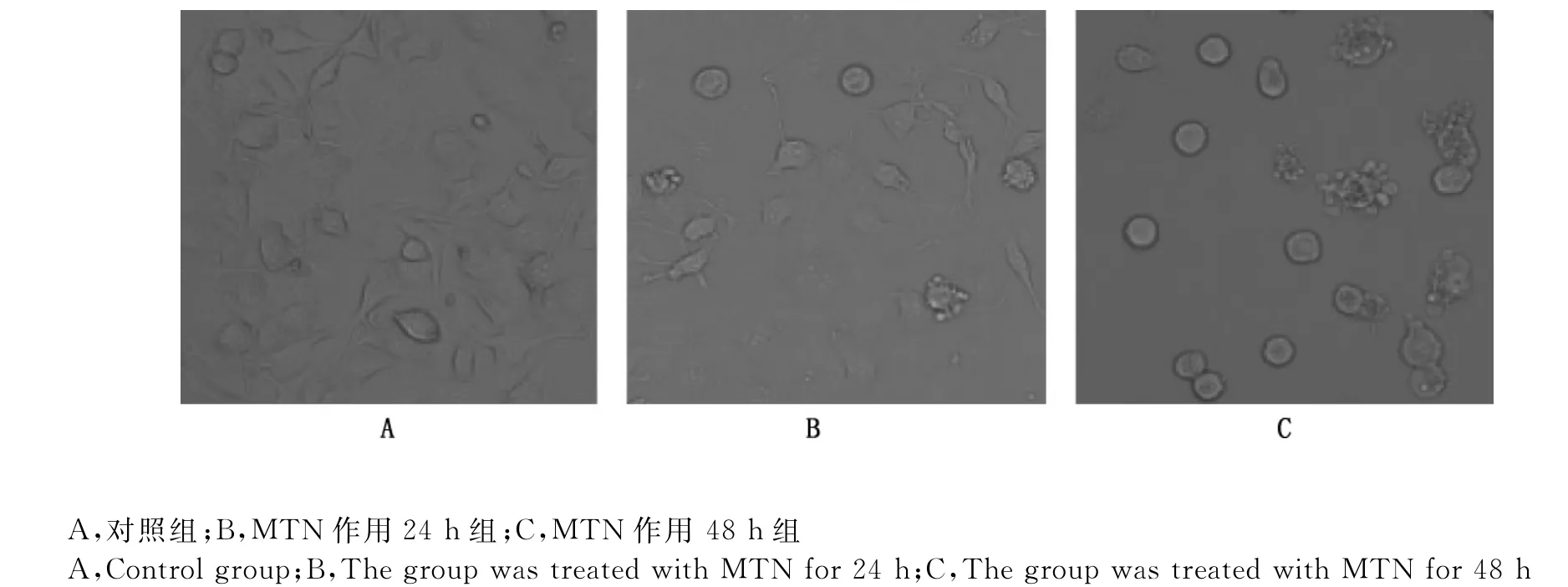
图2 MTN诱导RH35细胞形态学变化(200×)Fig.2 MTN induced morphologic changes in RH35cells(200×)
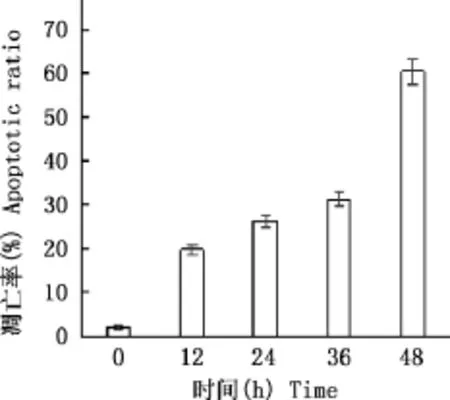
图3 MTN时间依赖性诱导RH35细胞凋亡Fig.3 MTN time-dependently induced apoptosis in RH35cells
2.3MTN诱导RH35细胞内ROS的产生
由图4可知,15μmol/L MTN作用于细胞0h细胞ROS水平为1.53%,而作用12、24、36及48h后ROS水平分别为16.69%、25.25%、38.03%、48.17%。结果表明,MTN可时间依赖性的增加细胞内ROS的水平。
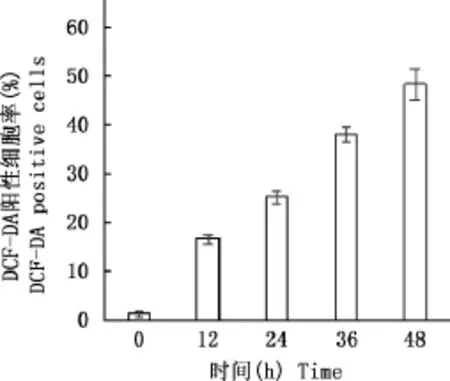
图4 MTN时间依赖性诱导RH35细胞内ROS的产生Fig.4 MTN time-dependently induced intracellular ROS generation in RH35cells
2.4NAC对MTN诱导的RH35细胞内ROS的影响
由图5可知,NAC为ROS清除剂,加入5mmol/L NAC后,15μmol/L MTN作用细胞24h ROS水平由26.57%下降为10.60%,表明NAC可以极显著降低ROS的水平(P<0.01)。
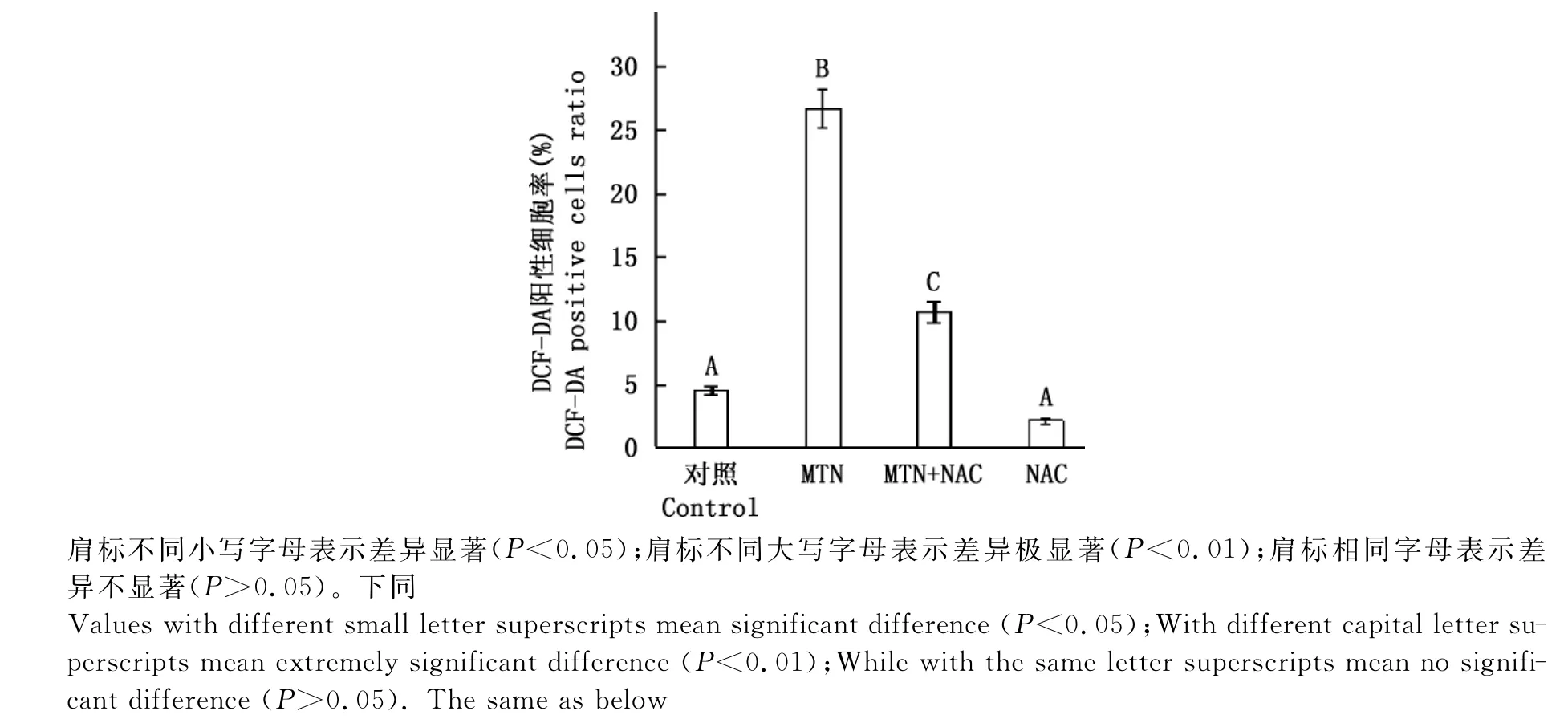
图5 NAC对MTN诱导的RH35细胞内ROS的影响Fig.5 Effect of NAC on MTN-induced ROS in RH35cells
2.5NAC对MTN诱导的RH35细胞凋亡的影响
由图6可知,15μmol/L MTN作用细胞24h凋亡率为33.56%,加入NAC后,其细胞凋亡率降为17.10%,表明NAC可以极显著降低MTN诱导的细胞凋亡(P<0.01)。
2.6NAC对MTN诱导的RH35细胞凋亡相关蛋白表达的影响
由图7可知,15μmol/L MTN作用细胞24h后,caspase-3前体表达下降而活性形式表达增加,促凋亡蛋白Bax及CytC表达增加,抑凋亡蛋白Bcl-2表达下降;加入NAC后,可以明显逆转上述蛋白的变化,即MTN诱导的caspase-3的活化明显下调,促凋亡蛋白Bax的增加及抑凋亡蛋白Bcl-2的下降均被抑制,进一步表明NAC可以抑制MTN诱导的细胞凋亡。
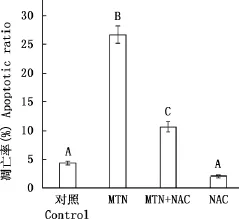
图6 NAC对MTN诱导的RH35细胞凋亡的影响Fig.6 Effect of NAC on MTN-induced apoptosis in RH35cells
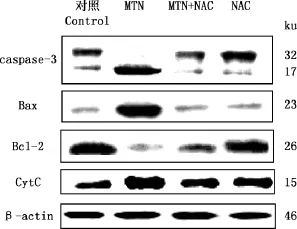
图7 NAC对MTN诱导的RH35细胞凋亡相关蛋白表达的影响Fig.7 Effect of NAC on MTN-induced expressions of apoptosis related proteins in RH35cells
3 讨 论
蒽环类药物是最有效的抗肿瘤药物,临床上常用的阿霉素、多柔比星、MTN均是以蒽环结构为母环的,具有良好的疗效。临床研究表明,MTN对肝癌具有良好的疗效[6-7],但是其作用机制尚不明确,研究其抗肝癌机制,有利于该类化合物的结构优化,为开发新药奠定基础,并有利于指导MTN的临床用药。
细胞凋亡又称细胞程序性死亡,是在特定基因调控下细胞主动的死亡过程,其受细胞内外多种信号刺激的调控,是维持细胞内环境稳定的重要机制[13-14]。MTN时间、剂量依赖性地抑制RH35细胞生长,倒置显微镜下观察到其可以使细胞浮起、变圆,并出芽形成凋亡小体。Annexin V-FITC/PI双染阳性细胞与Annexin V-FITC阳性细胞相加所成的细胞凋亡率也随着MTN加入时间的延长而增加,提示MTN诱导RH35细胞发生了凋亡。细胞凋亡的过程中,很多蛋白家族参与了凋亡的调控,其中caspase家族为一类与凋亡密切相关的酶类,其在凋亡过程中发挥着重要的作用,而caspase-3则被认为是凋亡的标志之一[15-16];Bcl-2家族蛋白及CytC是线粒体途径凋亡的重要参与因子,Bcl-2家族促/抗凋亡蛋白的平衡决定着细胞凋亡的进程[17]。加入MTN后,caspase-3被激活而其前体procaspase-3表达量减少。MTN可以诱导促凋亡蛋白Bax表达增加,抑凋亡蛋白Bcl-2表达下降,并可以促进CytC的释放。这些凋亡相关蛋白的变化进一步证明MTN诱导RH35细胞发生了凋亡。
ROS在细胞的各种生命进程中都发挥着重要的作用,其可作为第二信使调节与细胞增殖、分化、凋亡等相关的信号转导通路[18-20]。研究表明,蒽环类药物阿霉素诱导肿瘤细胞死亡的主要机制是诱导ROS的产生进而损坏线粒体而诱导肿瘤细胞凋亡[21]。Xie等[22]发现黄连素可以通过诱导ROS的产生调节Bcl-2家族促/抗凋亡蛋白的比率进而诱导人乳腺癌MCF-7及MDA-MB-231细胞凋亡。此外,Arnold等[23]亦证实MTN可以通过增加ROS的水平诱导人红细胞程序性死亡(eryptosis,红细胞凋亡)。本研究结果发现,MTN可以诱导ROS的产生,清除了ROS后,MTN所引起的凋亡被抑制,而由MTN引起的凋亡相关蛋白表达的变化均被逆转,证明ROS在MTN诱导凋亡中发挥着重要的作用,其介导了MTN诱导的凋亡,即MTN通过诱导RH35细胞ROS的产生而诱导凋亡。而在此过程中MTN如何诱导ROS的产生及其他信号转导通路是否参与凋亡的调控还需进一步研究。
4 结 论
本研究结果表明,MTN对大鼠RH35细胞具有较强的细胞毒性,其是通过诱导RH35细胞内ROS的产生,进而诱导细胞凋亡来实现的。
参考文献:
[1] Scoparo C T,Valdameri G,Worfel P R,et al.Dual properties of hispidulin:Antiproliferative effects on HepG2cancer cells and selective inhibition of ABCG2 transport activity[J].MolCellBiochem,2015,409(1-2):123-133.
[2] Bruix J,Sherman M.Management of hepatocellular carcinoma:An update[J].Hepatology,2011,53(3):1020-1022.
[3] Duffy A,Greten T.Developing better treatments in hepatocellular carcinoma[J].ExpertRevGastroenterolHepatol,2010,4(5):551-560.
[4] Im A,Amjad A,Agha M,et al.Mitoxantrone and etoposide for the treatment of acute myeloid leukemia patients in first relapse[J].OncelRes,2016,24(2):73-80.
[5] Evison B J,Sleebs B E,Watson K G,et al.Mitoxantrone,more than just another topoisomeraseⅡpoison[J].MedResRev,2016,36(2):248-299.
[6] Suzuki E,Furuse J,Ikeda M,et al.A phaseⅠ/Ⅱstudy of combined chemotherapy with mitoxantrone and uracil/tegafur for advanced hepatocellular carcinoma[J].JpnJClinOncol,2011,4(3):328-333.
[7] 吴敬波,范 娟,张建文,等.注射用盐酸米托蒽醌毫微球治疗原发性肝癌临床试验[J].泸州医学院学报,2000,23(4):288-290.
[8] Abraha A M,Ketema E B.Apoptotic pathways as a therapeutic target for colorectal cancer treatment[J].WorldJGastrointestOncol,2016,8(8):583-591.
[9] 齐美颖,刘 心,刘保兰,等.米托蒽醌对人骨髓瘤细胞RPMI8226增殖与凋亡的影响[J].中国实验血液学杂志,2014,22(6):1633-1639.
[10] 王 炜,刘星言,程小广,等.盐酸米托蒽醌通过PI3K途径诱导人鼻咽癌CNE-2细胞凋亡[J].现代肿瘤医学,2015,23(2):153-156.
[11] 魏建勋,马文君,李红梅.米托蒽醌对人卵巢癌COC1细胞增殖与凋亡的影响及其作用机制[J].基层医学论坛,2014,18(31):4185-4188.
[12] Kostrzewa-Nowak D,Tarasiuk J.Bioreductive activation of mitoxantrone by NADPH cytochrome P450 reductase does not change its apoptotic stimuli properties in regard to sensitive and multidrug resistant leukaemia HL60cells[J].EurJPharmacol,2013,721(1-3):141-150.
[13] 张 文,王建光,李金莲,等.牛磺鹅去氧胆酸对小鼠巨噬细胞系RAW264.7细胞凋亡的影响[J].中国畜牧兽医,2016,43(7):1674-1680.
[14] Vanden B T,Kaiser W J,Bertrand M J.Molecular crosstalk between apoptosis,necroptosis,and survival signaling[J].MolCellOncol,2015,2(4):e975093.
[15] Savitskaya M A,Onishchenko G E.Mechanisms of apoptosis[J].Biochemistry,2015,80(11):1393-1405.
[16] 田 杰,任配友,李 锐,等.土槿皮乙酸通过P53和caspase蛋白抑制人乳腺癌细胞MCF-7生长机制研究[J].中国畜牧兽医,2014,41(5):155-157.
[17] Gross A.Bcl-2family proteins as regulators of mitochondria metabolism[J].BiochimBiophysActa,2016,1857(8):1243-1246.
[18] Feng X,Yu W,Zhou F,et al.A novel small molecule compound diaporine inhibits breast cancer cell proliferation via promoting ROS generation[J].BiomedPharmacother,2016,83(8):1038-1047.
[19] Angsutararux P,Luanpitpong S,Issaragrisil S.Chemotherapy-induced cardiotoxicity:Overview of the roles of oxidative stress[J].OxidMedCellLongev,2015,2015:795602.
[20] Chu N,Yao G,Liu Y,et al.Newly synthesized bisbenzimidazole compound 8induces apoptosis,autophagy and reactive oxygen species generation in HeLa cells[J].BioorgMedChemLett,2016,26(17):4367-4371.
[21] Aryal B,Rao V A.Deficiency in cardiolipin reduces doxorubicin-induced oxidative stress and mitochondrial damage in human B-lymphocytes[J].PLosOne,2016,11(7):e0158376.
[22] Xie J,Xu Y,Huang X,et al.Berberine-induced apoptosis in human breast cancer cells is mediated by reactive oxygen species generation and mitochondrialrelated apoptotic pathway[J].TumourBiol,2015,36(2):1279-1288.
[23] Arnold M,Bissinger R,Lang F.Mitoxantroneinduced suicidal erythricyte death[J].CellPhysiol Biochem,2014,34(5):1756-1767.
(责任编辑 晋大鹏)
中图分类号:Q813.5
文献标识码:A
文章编号:1671-7236(2016)12-3245-06
doi:10.16431/j.cnki.1671-7236.2016.12.024
收稿日期:2016-08-26
基金项目:国家自然科学基金(U1404819);河南省自然科学基金(132300410228)
作者简介:张亚宏(1982-),女,山东济宁人,博士,副教授,研究方向:毒理学与肿瘤药理学,E-mail:zhangyahong_131@163.com
通信作者:*齐建国(1985-),男,辽宁沈阳人,博士,副教授,研究方向:毒理学与药物化学,E-mail:qijianguo@henu.edu.cn王建红(1971-),男,河南许昌人,博士,教授,研究方向:毒理学与药物化学,E-mail:jhworg@126.com
Mitoxantrone Induced Apoptosis through ROS in Rat Hepatama RH35Cell Line
ZHANG Ya-hong,GAN Ying,QI Jian-guo*,WANG Jian-hong*
(KeyLaboratoryofNaturalMedicineandImmuno-engineering,HenanUniversity,Kaifeng475004,China)
Abstract:The assay was aimed to study the cytotoxicity and mechanisms of mitoxantrone(MTN)in rat hepatama cell line RH35.MTT assay was performed to assess the cytotoxicity of MTN,and microscope was used to observe cellular morphologic changes.Apoptotic ratio and intracellular ROS generation were measured by flow cytometric analysis.The protein expression was examined by Western blotting analysis.The results showed that MTN inhibited RH35cell growth in a timeand concentration-dependent manner.The morphologic changes were observed in the cells,including cell shrinkage,membrane blebbing and apoptotic bodies when treated with 15μmol/L MTN for 24and 48h.And MTN also induced the increase of apoptotic ratio and generation of ROS in a time dependent manner.In addition,the intracellular ROS generation ratio and the apoptotic ratio of MTN treated group were extremely decreased by the ROS scavenger NAC(P<0.01).The pretreatment of RH35cells with 15mmol/L NAC thoroughly reversed the MTN-induced enhancement of caspase-3,Bax and CytC level and attenuation of Bcl-2level.In conclusion,MTN induced apoptosis in RH35cells through increasing the generation of ROS.
Key words:mitoxantrone;apoptosis;RH35cell;ROS

