厦门地区遗传性耳聋流行病学调查
王旭东洪拥军陈艺文黄秋英李庆阁
1厦门大学生命科学学院,分子诊断教育部工程中心(厦门361102)
2厦门大学附属中山医院耳鼻喉科(厦门361004)
·临床研究·
厦门地区遗传性耳聋流行病学调查
王旭东1洪拥军2陈艺文1黄秋英1李庆阁1
1厦门大学生命科学学院,分子诊断教育部工程中心(厦门361102)
2厦门大学附属中山医院耳鼻喉科(厦门361004)
目的调查厦门地区遗传性耳聋的发生率及热点基因突变,探讨在厦门地区开展遗传性耳聋检测的必要性和意义。方法采集2015年12月至2016年2月厦门市中山医院就诊的132名耳聋患者唾液并提取DNA,应用探针熔解曲线技术检测4个常见耳聋基因的20个突变位点,包括GJB2(c.35delG,c.167delT,c.176-191del16bp,c.235delC, c.299-300delAT)、GJB3(c.538 C>T,c.547 G>A)、SLC26A4(c.749 T>C,c.754 T>C,c.919-2 A>G,c.1174 A>T,c.1226 G>A, c.1229 C>T,c.1707+5 G>A,c.1975 G>C,c.2027 T>A,c.2162 C>T,c.2168 A>G)和线粒体DNA 12S rRNA(m.1494 C>T, m.1555 A>G)。结果132名耳聋患者中,共检测出耳聋基因异常者42例(31.8%),其中22例携带GJB2基因突变,16例携带SLC26A4基因突变,4例携带线粒体基因m.1555A>G均质性突变。在这些基因异常的患者中,GJB2基因的c.235delC(15.9%,21/132)及SLC26A4基因的c.919-2A>G(10.6%,14/132)为厦门地区的两大热点突变。结论厦门地区耳聋患者中常见耳聋基因突变以GJB2基因突变、SLC26A4基因突变为主。因此,该地区应将遗传性耳聋检测纳入遗传咨询、产前诊断及新生儿筛查,尤其是新生儿药物性耳聋和PDS综合征等迟发性耳聋的基因检测,从而有效的降低耳聋的发生。
耳聋;基因;熔解曲线;流行病学
Funding:This study was supported by the Science and Technology Project of Xiamen City(No.3502Z20143010).
Competing Interests:The authors have declared that no competing interests exist.
耳聋是一种人类最常见的感觉神经系统缺陷,是一种严重影响人类生活质量的常见先天性疾病[1-3]。根据中国残疾人联合网站统计,我国听力残疾者有2100万人,占残疾人总数的33.51%,且每年约有2-3万新生聋儿出生,其中约50-60%的聋儿是由于遗传因素引起的[4]。大量的流行病学调查研究显示[1,5-9],我国遗传性耳聋的常见致病基因为GJB2、SLC26A4、线粒体12S rRNA。此外,耳聋基因的突变类型及突变频率在不同地区和不同种族存在一定差异。因此,明确耳聋的分子病因,实行早期干预和治疗是降低耳聋发生的关键所在。为了解厦门地区耳聋人群的常见分子病因学特点,本研究采用基于实时荧光PCR的探针熔解曲线技术,对厦门大学附属中山医院的132例耳聋患者的唾液标本进行GJB2、GJB3、SLC26A4和线粒体DNA 12S rRNA 4个基因 20 个 位 点 (GJB2:c.35delG,c.167delT, c.176-191del16bp, c.235delC, c.299-300delAT; GJB3:c.538 C>T,c.547 G>A;mtDNA:m.1494 C>T, m.1555 A>G;SLC26A4:c.749 T>C,c.754 T>C, c.919-2 A>G,c.1174 A>T,c.1226 G>A,c.1229 C>T, c.1707+5 G>A,c.1975 G>C,c.2027 T>A,c.2162 C>T, c.2168 A>G)的检测,并进行相关数据的统计分析,从而探索在厦门地区开展高危人群及新生儿的遗传性耳聋检测的必要性和意义。
1 对象与方法
1.1 研究对象
厦门大学附属中山医院提供的132名耳聋患者均被诊断为中度或者重度感音神经性耳聋患者,均来自厦门市周边地区,均为汉族。男、女分别为53.8%(71/132)和46.2%(61/132),男女比例为1.16:1,年龄0-60岁,平均年龄17.8岁。132例耳聋患者中语前聋、语后聋分别为103例、29例。厦门大学附属中山医院对132名耳聋患者进行了ABR和ASSR检查,其中121名患者进行纯音测听检查。本研究听力检测方法视患者配合程度选取听觉行为反应测听、游戏测听及纯音测听,以较好耳500、1000、2000、4000 Hz平均纯音听阈判定其听力残疾等级[10]。在132例耳聋患者中,极重度听力损伤患者117例(88.64%,其中92例已接受人工耳蜗植入手术),重度听力损伤12例(9.10%),中度听力损伤3例(2.27%)。此外,132名耳聋患者均行颞骨CT检查,结果显示正常者114例,大前庭导水管者14例,Mon⁃dini畸形3例,共腔畸形1例。该研究通过厦门大学附属中山医院伦理审查委员会审查,所有研究对象(或者监护人)均签署知情同意书。
1.2 病史资料采集
通过访谈调查基本情况,内容如下:(1)一般情况:登记时间、姓名、性别、年龄、民族、籍贯、出生年月、家庭地址和联系方式等。(2)耳聋的发病时间、发病原因、耳聋以前是否会说话、耳聋病情进展及伴随症状等。(3)个人史:头部外伤史、耳毒性药物服用史及环境噪声史等。(4)母亲妊娠期情况:传染病史、耳毒性药物应用史及生产情况。
1.3 方法
1.3.1 唾液DNA的提取
所有唾液标本均采用唾液收集器(厦门致善生物科技有限公司)进行样本收集,并采用厦门致善生物科技有限公司Lab-Aid 820全自动核酸提取仪及配套的磁珠法核酸提取试剂盒进行核酸提取。利用ND-1000-UV-VIS波长紫外/可见光扫描分光光度计(NanoDrop,美国)对基因组DNA的提取质量和浓度进行检测,并将DNA的终浓度调节为10 ng/μL,直接使用或置于-20℃冰箱中保存备用。DNA样本的A260nm/A280nm比值应在1.6~2.0之间,A260nm/ A230nm比值需≥2.0。
1.3.2 遗传性耳聋基因检测
遗传性耳聋基因检测试剂盒(荧光PCR熔解曲线法)由厦门致善生物科技有限公司提供,每份标本需通过四个PCR反应体系进行检测,每个反应体系内含有相应的引物和检测探针及PCR的基本组成成分,根据靶序列与探针杂交后熔点的变化检测相应的基因突变,可同时检测4个耳聋基因的20种突变类型,分别是GJB2:c.35delG,c.167delT,c.176-191del16bp, c.235delC,c.299-300delAT;GJB3:c.538 C>T,c.547 G>A;mtDNA:m.1494 C>T,m.1555 A>G;SLC26A4: c.749 T>C,c.754 T>C,c.919-2 A>G,c.1174 A>T, c.1226 G>A,c.1229 C>T,c.1707+5 G>A,c.1975 G>C,c.2027 T>A,c.2162 C>T,c.2168 A>G)。具体检测流程如下:将5 μL浓度为10 ng/μL的待测DNA标本直接加到含PCR反应液的管中,短暂离心后,转移至实时荧光PCR仪(BIO-RAD,CFX 96)上进行PCR扩增及熔解曲线分析。PCR扩增和熔解曲线分析的运行程序为:95℃预变性5 min;Touchdown循环:95℃变性15 s,65℃退火15 s,每次循环减1℃,76℃延伸20 s,循环10次;PCR扩增循环:95℃变性15 s,55℃退火15 s,76℃延伸20 s,循环50次;95℃变性1 min,35℃退火3 min,熔解曲线分析(45℃-85℃,每0.4℃采集FAM(羟基荧光素)、HEX(六氯荧光素)、ROX(羟基-Ⅹ-罗丹明荧光素)和CY5(吲哚二羟菁荧光素)通道荧光信号)。参照试剂盒说明书进行样本基因型判读。
1.3.3 Sanger测序验证
应用Sanger测序法对所有检测到基因突变的样本及其部分未检测到基因突变的样本进行相应片段的PCR扩增测序验证(测序由生工生物工程(上海)股份有限公司完成)。
2 结果
2.1 132例耳聋患者耳聋基因检测结果
如表1中所示,132例耳聋患者基因检出异常者42例,检出率为31.8%,其中GJB2基因突变检出率为16.7%(22/132),SLC26A4基因突变检出率为12.1%(16/132),mtDNA基因突变检出率为3.0%(4/ 132);野生型基因检测率为68.2%(90/132)。
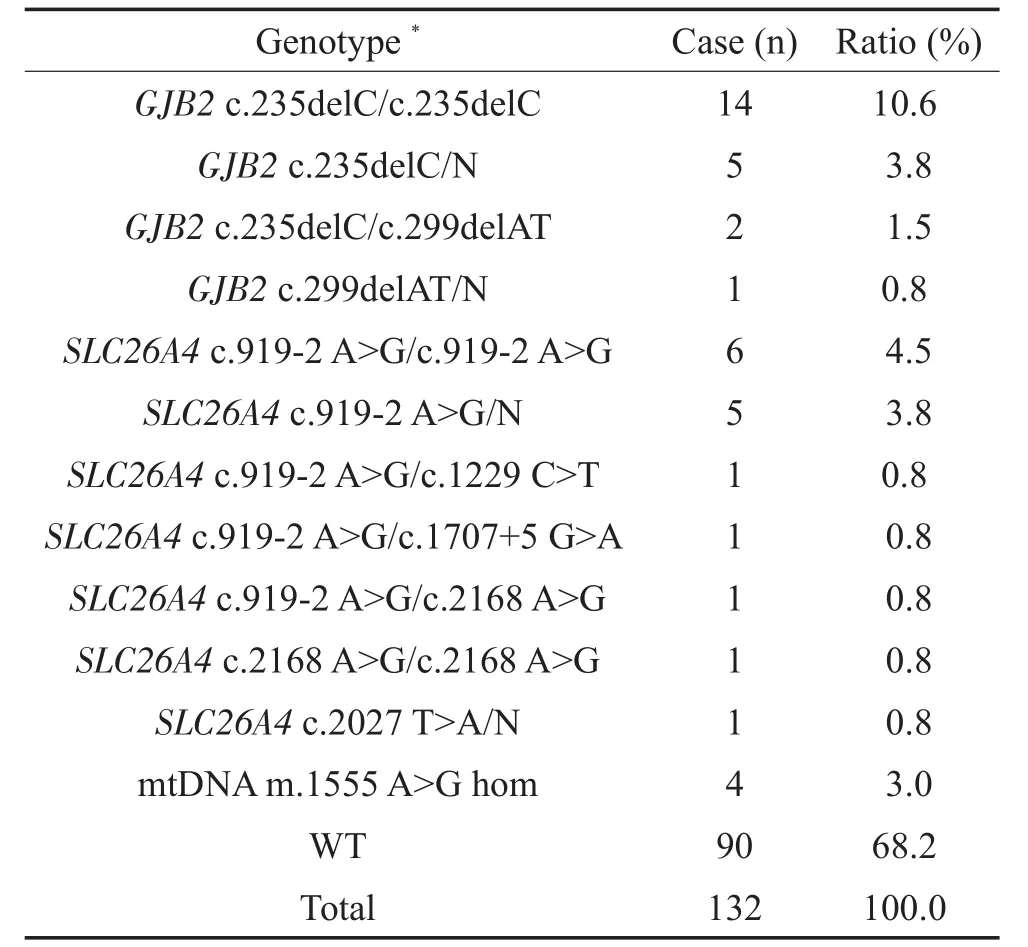
表1 132例耳聋患者基因检测结果Table 1 Genotype information of 132 hearing loss patients
2.2 GJB2基因突变检测结果
在132例耳聋患者中,c.235delC杂合突变、c.299delAT杂合突变、c.235delC纯合突变、c.235delC和c.299delAT复合杂合突变的检出率分别为3.8%(5/132)、0.8%(1/132)、10.6%(14/132)、1.5%(2/ 132);总确诊率(包括纯合突变及复合杂合突变)为12.1%(16/132),携带GJB2基因单等位基因突变的患者约占4.5%(6/132)。GJB2基因突变者发病年龄主要分布在婴幼儿时期,主要表现为先天性极重度感音神经性聋。
2.3 SLC26A4基因突变检测结果
在132例耳聋患者中,c.919-2 A>G杂合突变、c.2027 T>A杂合突变、c.919-2 A>G纯合突变、c.2168 A>G纯合突变、c.919-2 A>G和c.1229 C>T复合杂合突变、c.919-2 A>G和c.1707+5 G>A复合杂合突变、c.919-2 A>G和c.2168 A>G复合杂合突变的检测率分别为3.8%(5/132)、0.8%(1/132)、4.5%(6/ 132)、0.8%(1/132)、0.8%(1/132)、0.8%(1/132)、0.8%(1/132),总确诊率(包括纯合突变及复合杂合突变)为7.6%(10/132),携带SLC26A4基因单等位基因突变的患者约占4.5%(6/132)。16例耳聋患者携带SLC26A4基因突变,其基因型、氨基酸变化、颞骨CT、甲状腺B超、甲状腺功能检测结果(表2)。这些患者的高分辨率颞骨CT检查结果显示14例前庭导水管扩大,2例无内耳畸形。
2.4 线粒体DNA突变检测结果
在132例耳聋患者中,4例耳聋患者(3.0%,4/ 132)含有线粒体基因m.1555 A>G均质性突变,且发病年龄主要为幼年时期。其中1个患者有明确氨基糖苷类抗生素应用史,其用药是由于幼时高烧用药,但是具体药物不详(见表3)。
3 讨论
耳聋是一种最常见的出生性缺陷遗传病,研究表明耳聋患者约有50-60%是由于遗传因素导致的,其中约80%为常染色体隐性遗传,10%-20%为常染色体显性遗传,其余为伴X染色体和线粒体遗传[4]。在我国常见的遗传性耳聋致病基因主要为GJB2、SLC26A4、线粒体12S rRNA。本研究旨在通过对厦门地区耳聋患者的基本病史信息收集及初步耳聋基因筛查,了解本地耳聋的发病特点、致病基因及突变类型,评估本地耳聋基因检测的热点基因突变,为本地区大规模遗传性耳聋的新生儿筛查项目提供理论依据。
本组132例耳聋患者中,有42例患者被检出具有GJB2、SLC26A4、mtDNA基因突变,其中30例患者具有双等位基因突变(纯合或复合杂合突变),12例患者具有单杂合基因突变,突变发现率31.8%。但是,对于102例只发现单一突变或未发现基因突变的患者,可能存在一些本检测试剂未能覆盖的耳聋致病基因或者罕见基因突变类型,这也正是由于耳聋的高度遗传异质性所致。到目前为止,已发现与耳聋有关的基因达100多个,基因突变类型呈现高度的种族差异性(The Connexin-deafness homepage:http://www.crg.es/deafness)。对于未发现突变的患者,后续研究需要借助遗传病家谱分析和高通量测序等技术来对其分子病因进行进一步的确诊。
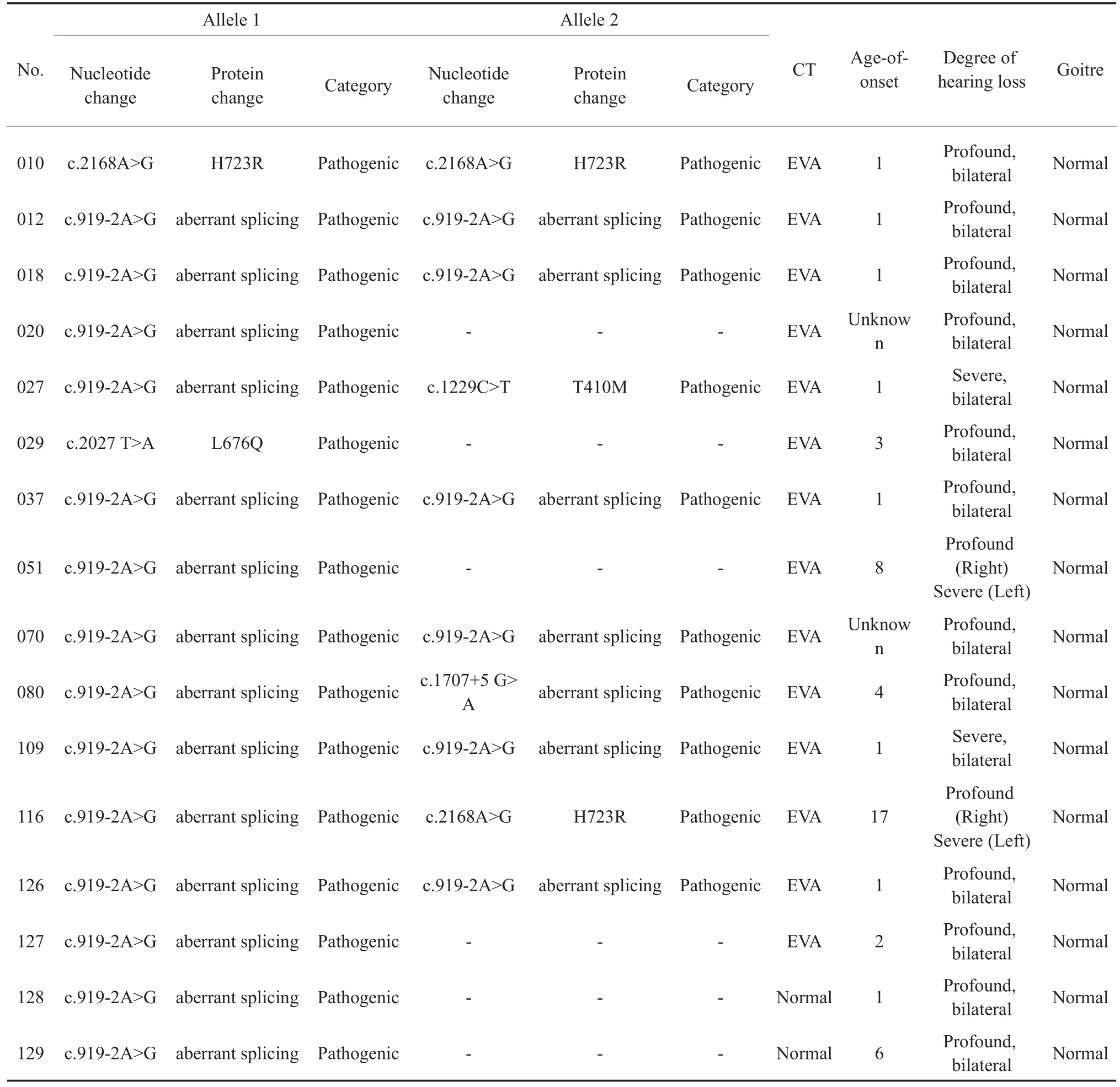
表2 厦门市16例耳聋患者SLC26A4基因型与表型Table 2 Genotype and clinical phenotype associated with SLC26A4 gene in 16 patients
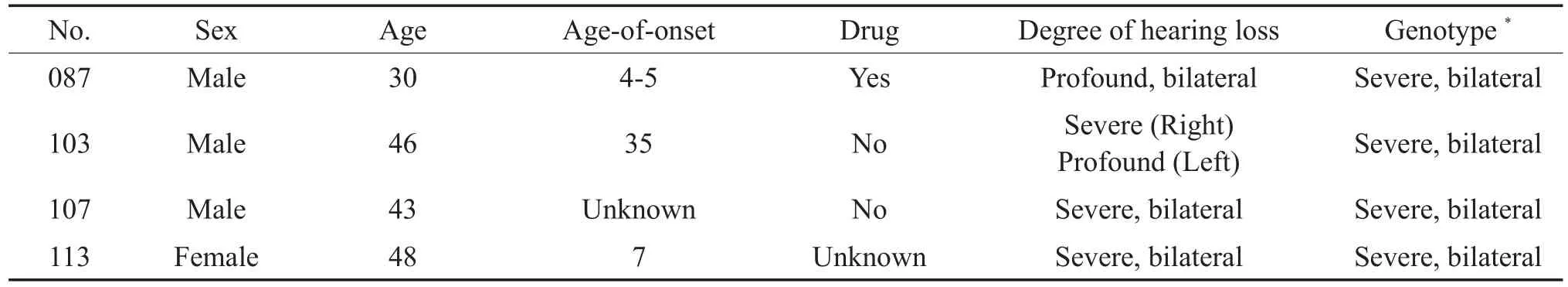
表3 4例氨基糖苷类药物性耳聋患者结果分析Table 3 Analysis of 4 aminoglycoside-induced hearing loss patients
GJB2基因是最常见的致聋基因,其遗传方式为常染色体隐性遗传,据报道GJB2基因中最常见的突变类型为c.235delC[5,11]。在本次研究中,GJB2基因阳性检出率为16.7%(22/132),为本地最常见的耳聋致病基因。其中c.235delC突变的检出率为15.9%(21/ 132),据文献报道我国不同地区GJB2基因c.235delC突变频率为6.59%-25.18%[12],因此该突变也是本地区GJB2基因的一个热点突变。在本次研究中,GJB2基因突变的耳聋患者主要表现为先天性听力丧失,且均表现为双侧极重度感音神经性聋。22例GJB2基因突变的患者中,6例患者只检测到一个基因突变,按照常染色体隐性遗传模式,这些杂合子患者应该在GJB2基因仍存在另一个未检测到的基因突变。因此,本研究中GJB2基因确诊患者的发病年龄主要集中在婴幼儿时期,且极重度听力损失所占比例较大。提示要重视遗传性耳聋的分子诊断,对GJB2基因热点突变加强监控并早期给予相应的干预治疗措施,尤其是遗传咨询、产前诊断和新生儿的筛查,从而最大程度减少耳聋悲剧的发生。
SLC26A4基因是第二常见的致病基因,属于常染色体隐性遗传,该基因突变引起的耳聋患者一般表现为前庭导水管扩大[7,13]。SLC26A4基因突变具有显著的异质性,该基因的突变类型多样化,且不同种族人群的基因突变图谱各不相同[14]。其中c.919-2 A>G突变为亚洲人群最常见的一种突变类型[15]。在本次研究中,该基因最常见的突变类型为c.919-2 A>G,检测率高达10.6%(14/132)。本次研究中,4例携带SLC26A4单等位基因突变的耳聋患者均表现为前庭水管扩大。按照常染色体隐性遗传模式,这些SLC26A4基因杂合子的患者很有可能在该基因存在另一个较为罕见的致病突变。2例携带SLC26A4单等位基因突变耳聋患者的颞骨CT结果显示无内耳畸形,因此这两名患者只是SLC26A4基因突变的携带者,其耳聋病症可能是其他因素导致。SLC26A4基因突变的耳聋患者的发病年龄主要集中在婴幼儿时期,常表现为出生时有较好的听力残余或正常的听力,很容易被人忽视。因此,应对该基因进行及时的检测,可以指导患者在日常生活中避免因剧烈运动或者头部受到撞击等环境因素引发运动性耳聋,同时也可以指导患者及时进行电子耳蜗的植入手术实现聋而不哑,减轻社会和家庭的经济负担,提高患者的生活质量。
线粒体基因mtDNA的遗传方式遵循母系遗传。在线粒体基因中,m.1555A>G是耳聋的一个热点突变,其主要与氨基糖甙类药物引发的耳聋有关[16]。携带mtDNA基因突变的患者对氨基糖苷类抗生素极为敏感,仅常规剂量并在短时间内用药便会导致听力损失[17]。本研究中4例患者携带m.1555A>G均质性突变,其中一例有明确的耳聋前用药史。因此,加强对线粒体基因A1555G和C1494T突变的筛查,指导抗生素的合理使用,从而避免“一针致聋”悲剧的发生。
区域性耳聋基因筛查对本地区的耳聋基因热点突变筛查及其遗传咨询和疾病防控具有十分重要的意义。本研究表明常见致聋基因在厦门耳聋患者中具有较高的检出率,建议将遗传性耳聋基因检测纳入医院新生儿的筛查项目中,从而为本地区大范围耳聋基因筛查和临床诊断提供重要的理论依据,为耳聋分子病因学的诊断、早发现早治疗、降低厦门地区耳聋的发生提供有力保障。
本次研究使用的遗传性耳聋检测试剂是一种基于荧光PCR熔解曲线的新型技术,它是一种闭关操作的均相实时PCR检测体系,无需繁琐的PCR后处理步骤,可以很大程度上避免PCR污染对检测结果造成的影响,从而保证检测结果的准确性。同时该检测试剂可以实现4个常见耳聋致病基因的20种突变的同时检测,检测位点覆盖广,结果易于判读。此外,本研究首次采用唾液标本作为流行病学调查的基因检测材料。研究表明,从唾液和外周血提取的基因组DNA在基因检测中具有相同的效果,完全可以满足基因检测的需求[18]。与血液取样相比,它具有以下优点:1)无创取样,避免了采血的疼痛和感染风险;2)取样方便,不需要专业的医护人员,可以很大程度上节约人力和物力;3)使用范围广,适用于婴儿、老人以及一些特殊人群(如精神类疾病患者等);4)样本可以稳定存储,长期存储的样本也可以提取完整的基因组DNA用于基因检测。因此,这种无创取样方式将在大规模的分子流行病学和遗传病的调查研究方面具有巨大的应用潜力。
1 Ouyang XM,Yan D,Yuan HJ,et al.The genetic bases for non-syn⁃dromic hearing loss among Chinese[J].Journal of human genetics, 2009,54(3):131-140.
2 Morton N.Genetic epidemiology of hearing impairment[J].Annals of the New York Academy of Sciences,1991,630(1):16-31.
3 Smith RJ,Bale Jr JF,White KR.Sensorineural hearing loss in chil⁃dren[J].The Lancet,2005,365(9462):879-890.
4 刘学忠,欧阳小梅,Yan D,等.中国人群遗传性耳聋研究进展[J].中华耳科学杂志,2006,4(2):81-89.
Liu XZ,Ouyang XM,Yan D,et al.The Genetic Deafness in Chinese Population[J].Chinese Journal of Otology,2006,4(2):81-89.
5 Liu Y,Ke X,Qi Y,et al.Connexin26 gene(GJB2):prevalence of mu⁃tations in the Chinese population[J].Journal of human genetics, 2002,47(12):0688-0690.
6 Wang QJ,Zhao YL,Rao SQ,et al.A distinct spectrum of SLC26A4 mutations in patients with enlarged vestibular aqueduct in China[J]. Clinical genetics,2007,72(3):245-254.
7 Dai P,Li Q,Huang D,et al.SLC26A4 c.919-2A>G varies among Chinese ethnic groups as a cause of hearing loss[J].Genetics in Med⁃icine,2008,10(8):586-592.
8 Guo YF,Liu XW,Guan J,et al.GJB2,SLC26A4 and mitochondrial DNA A1555G mutations in prelingual deafness in Northern Chinese subjects[J].Acta oto-laryngologica,2008,128(3):297-303.
9 戴朴,刘新,于飞,等.18个省市聋校学生非综合征性聋病分子流行病学研究(Ⅰ)—GJB2 235delC和线粒体DNA 12SrRNA A1555G突变筛查报告[J].中华耳科学杂志,2006,4(1):1-5.
Dai P,Liu X,Yu F,et al.Molecular etiology of patients with nonsyn⁃dromic hearing loss from deaf-mute schools in 18 provinces of Chi⁃na[J].Chinese Journal of Otology,2006,4(1):1-5.
10 孙喜斌,李兴启,张华.中国第二次残疾人抽样调查听力残疾标准介绍[J].听力学及言语疾病杂志,2006,14(06):447-448.
Sun XB,Li XQ,Zhang H.The introduction of the hearing disability standards of the second sample survey for the disabled people in Chi⁃na[J].Journal of Audiology and Speech Pathology,2006,14(06): 447-448.
11 于飞,韩东一,戴朴,等.1190例非综合征性耳聋患者GJB2基因突变序列分析[J].中华医学杂志,2007,87(40):2814-2819.
Yu F,Han DY,Dai P,et al.Mutation of GJB2 gene in nonsyndromic hearing impairment patients:analysis of 1190 cases[J].National Medical Journal of China,2007,87(40):2814-2819.
12 于飞,戴朴,韩东一,等.中国部分地区非综合征型耳聋患者GJB2基因233~235delC突变频率分析[J].中国耳鼻咽喉头颈外科,2006,13(4):223-226.
Yu F,Dai P,Han DY,et al.233~235delC mutation analysis of GJB2 gene in nonsyndromic hearing impairment patients from China[J]. Chinese Archives of Otolaryngology-Head and Neck Surgery,2006, 13(4):223-226.
13 戴朴,韩东一,冯勃,等.大前庭水管综合征的基因诊断和SLC26A4基因突变分析[J].中国耳鼻咽喉头颈外科,2006,13(5): 303-307.
Dai P,Han DY,Feng B,et al.Genetic testing for the enlarged vestib⁃ular aqueduct syndrome and mutation analysis of the SLC26A4 gene [J].Chinese Archives of Otolaryngology-Head and Neck Surgery, 2006,13(5):303-307.
14 李伍高,严提珍,曾定元,等.大前庭水管综合征家系特征与SLC26A4基因分析[J].中华耳科学杂志,2016,14(2):234-239.
Li WG,Yan TZ,Zeng DY,et al.Clinical features and gene analysis in a large Chinese family with large vestibular aqueduct syndrome [J].Chinese Journal of Otology,2016,14(2):234-239.
15 Dai P,Stewart AK,Chebib F,et al.Distinct and novel SLC26A4/ Pendrin mutations in Chinese and US patients with nonsyndromic hearing loss[J].Physiological genomics,2009,38(3):281-290.
16 刘新,戴朴,黄德亮,等.线粒体DNAA1555G突变大规模筛查及其预防意义探讨[J].中华医学杂志,2006,86(19):1318-1322.
Liu X,Dai P,Huang DL,et al.Large-scale screening of mtDNA A1555G mutation in China and its significance in prevention of ami⁃noglycoside antibiotic induced deafness[J].National Medical Jour⁃nal of China,2006,86(19):1318-1322.
17 Xing G,Chen Z,Cao X.Mitochondrial rRNA and tRNA and hearing function[J].Cell research,2007,17(3):227-239.
18 Abraham J E,Maranian M J,Spiteri I,et al.Saliva samples are a via⁃ble alternative to blood samples as a source of DNA for high through⁃put genotyping[J].Bmc Medical Genomics,2012,5(1):19.
Epidemiological survey of hereditary hearing loss in Xiamen
WANG Xudong1,HONG Yongjun2,CHEN Yiwen1,HUANG Qiuying1,LI Qingge1
1 Engineering Research Center of Molecular Diagnostics,Ministry of Education,School of Life Sciences,Xiamen University, Xiamen,Fujian,361102,China;
2 Department of Otorhinolaryngology,Zhongshan Hospital of Xiamen,Xiamen,Fujian,361004,China. Corresponding author:HUANG Qiuying Email:hqying@xmu.edu.cn
ObjectiveTo investigate the incidence of hereditary hearing loss and hot-spot mutations in Xiamen area,as well as the importance and significance of deafness gene detection.MethodsFrom December 2015 to February 2016,saliva samples were collected from 132 hearing loss patients at Zhongshan Hospital of Xiamen.After genomic DNA extraction, multicolor fluorescence melting curve analysis was used to test for 20 mutations of four causative genes,including GJB2 (c.35delG,c.167delT,c.176-191del16bp,c.235delC,c.299-300delAT),GJB3(c.538 C>T,c.547 G>A),SLC26A4(c.749 T>C,c.754 T>C,c.919-2 A>G,c.1174 A>T,c.1226 G>A,c.1229 C>T,c.1707+5 G>A,c.1975 G>C,c.2027 T>A,c.2162 C>T, c.2168 A>G)and mitochondrial DNA 12S rRNA(m.1494 C>T,m.1555 A>G).ResultsIn this study,42 of the 132 cases (31.8%)were found to carry at least one causative mutation,of which 22 had GJB2 mutations,16 had SLC26A4 mutations, and 4 had mtDNA m.1555A>G mutation.The two hotspot mutations in this group were c.235delC(21/132,15.9%)in the GJB2 gene and c.919-2 A>G(14/132,10.6%)in the SLC26A4 gene.Conclusion The GJB2 and SLC26A4 genes are the two common causative genes in Xiamen area.Therefore,hereditary deafness gene test should be included in prenatal diagnosisand neonatal screening in Xiamen to reduce the incidence of deafness,especially late-onset neonatal ototoxicity hearing loss and PDS.
hearing loss;gene;melting curve analysis;epidemiology
R764.43
A
1672-2922(2016)06-753-6
2016-06-29审核人:翟所强)
10.3969/j.issn.1672-2922.2016.06.011
厦门市科技计划项目(3502Z20143010)
王旭东,博士研究生,研究方向:分子诊断学王旭东和洪拥军为并列第一作者
黄秋英,Email:hqying@xmu.edu.cn

