遗传性耳聋基因对噪声反应的研究
杨淑芝蔡群峰董有毅杨卫平2,胡博华
1解放军总医院第一附属医院耳鼻咽喉科(北京100048)
2解放军总医院耳鼻咽喉头颈外科,耳鼻咽喉研究所(北京100853)
3美国纽约州立布法罗大学听力耳聋中心(美国14214)
·噪声性聋专辑·
遗传性耳聋基因对噪声反应的研究
杨淑芝1,3蔡群峰3董有毅3杨卫平2,3胡博华3
1解放军总医院第一附属医院耳鼻咽喉科(北京100048)
2解放军总医院耳鼻咽喉头颈外科,耳鼻咽喉研究所(北京100853)
3美国纽约州立布法罗大学听力耳聋中心(美国14214)
目的探讨噪声性聋小鼠动物模型中遗传性耳聋相关基因表达的变化,以了解这些基因是否参与耳蜗对噪声的反应。方法根据已知的人类耳聋基因挑选出92个同类小鼠基因,检查这些基因对噪声损伤的反应。8只小鼠(雌雄各半,4周龄)接受持续噪声暴露(1-7kHz,120dB SPL)1小时,造成耳蜗的急性声损伤。ABR检测听力变化,荧光染色原位观察耳蜗毛细胞损伤情况,qRT-PCR检测耳聋基因表达变化。结果在92个检测基因中,86个基因在耳蜗组织中表达。噪声暴露后ABR检测显示所有检测频率的ABR阈值明显提高(P<0.001)。免疫荧光染色原位观察结果显示噪声暴露后耳蜗底转外毛细胞缺失。qRT-PCR检测显示共有6个基因的表达差异具有统计学意义(P<0.05),其中表达下调的基因有4个,分别是Col4a5、P2rx2、Tmc1、Tprn,表达上调的基因有2个,分别是Ndp和Smpx。这些基因参与多种细胞功能。结论噪声性聋是一个复杂的退化过程,除环境因素外,多种耳聋基因参与其发病。
噪声性聋,遗传性聋,基因,小鼠,mRNA表达
This research was supported by NIDCD National Institute on.Deafness and Other Communication Disorders 1R01DC010154 to BH Hu
Declaration of interest:The authors report no conflicts of interest.
噪声性聋是一种常见的职业性损害,其发病率在感音神经性耳聋中位居第二[1]。目前对其发病机制尚无明确定论,多数学者认为噪声性聋是一种复杂的疾病,环境和遗传因素共同参与其发病过程[2]。虽然人类定位的耳聋基因座位已超过200个,其中129个基因被克隆,但截止到目前为止,仅有数个耳聋基因(KCNE1、KCNQ4、CAT、PCDH15、MYH14、GJB2、HSP70和Pjvk)被发现与噪声易感性相关[3-7],还有许多易感基因有待进一步被鉴定出来。本研究根据已知的人类遗传性耳聋基因的功能及其在耳蜗中的表达情况,选取有关基因进行研究,分析噪声暴露后这些基因表达的变化情况,以了解组织损伤机理。
1 材料和方法
1.1 实验动物
本实验选取C57BL/6J小鼠(8只,4周,雌雄各半,杰克逊实验室,美国)进行研究,所有的实验对象均进行基线听力评估,只有那些听力正常的小鼠才被选入本实验中,所有实验程序均符合美国纽约州立布法罗大学动物管理和使用委员会的伦理认证。
1.2 实验方法
所有实验动物均接受基线听力学评估,随机分配进入实验组和对照组。实验组小鼠接受稳态噪声暴露(1-7kHz,120dB SPL)1小时,造成耳蜗的急性声损伤。噪声暴露后1天进行听性脑干反应测试,评估噪声对耳蜗造成的损伤程度,然后处死动物获取耳蜗组织,进行后续实验研究。
1.2.1 噪声暴露:噪声信号由实时信号处理器产生(RP2.1,Tucker Davis Technologies,TDT,USA),该信号通过衰减器(PA5 TDT,USA)和放大器(Crown XLS 202,Harman International Company,USA)传至扬声器(NSD2005-8,Eminence,USA),扬声器位于实验动物头顶上方30cm处。应用声级计(LD-PCB,model 800B,APCB Piezotronics Division,Larson Davis,USA)、前置放大器(LD-PCB,model 825,Larson Davis,USA)和电容式微音器(Larson and Davis,LDL 2559,USA)校准该区域的噪声强度。
1.2.2 ABR检测:动物腹腔内注射氯胺酮(87mg/kg)和赛拉嗪(3mg/kg)混合物麻醉成功后,将动物置于加热毯上维持体温在37.5℃。记录电极置于动物颅顶皮下,参考电极和接地电极分别置于测试耳和对侧耳后皮下。刺激声为短纯音,刺激重复率21次/秒。带通滤波100~3000Hz。应用诱发电位检测系统(TDT,Tucker-Davis Technologies,USA)分别检测4、8、16、32KHz频率的反应阈值。
1.2.3 标本收集
1.2.3.1 用于转录分析耳蜗组织的收集:获取小鼠耳蜗底转柯蒂氏器(包括内、外毛细胞和支持细胞),每个标本包含1只小鼠的1只耳蜗组织。标本取材的方法如下:动物经深度CO2麻醉2分钟后处死,快速解剖出耳蜗,浸泡入冷却的Dulbecco’s PBS液中(DPBS,GIBCO,Life Technologies,USA),迅速去除耳蜗底转的骨壁,将其浸泡在RNA保护液(RNALater,Qiagen,USA)中,使用自行设计的显微器械小心仔细地在Deiters细胞和Hensen细胞之间剔除网状层,使之与基底膜分离,然后将分离的组织转移到装满新鲜的RNA保护液的小瓶皿中,洗掉粘在标本表面的碎片组织,将标本移至RNase-free的PCR小管中,储存在-80℃冰箱中待用。
1.2.3.2 用于耳蜗病理检查标本的收集:实验动物处死后,快速收集另外一侧耳蜗,浸入冷却的10mM PBS液中。用针尖刺破耳蜗的圆窗膜和卵圆窗膜,从圆窗轻轻注入10%福尔马林液固定标本4小时后,PBS液清洗。
1.3 荧光显微镜标本制作
本研究采用原位观察耳蜗的方法,了解噪声暴露后耳蜗毛细胞损伤情况。显微镜下去除蜗尖和外侧壁部分以充分暴露耳蜗底转基底膜。用Alexa Fluor 488 phalloidin(1:75,Applied Biosystems,USA,10 mM PBS稀释)、0.25%Triton X-100和1%小牛血清蛋白室温下孵育30分钟,PBS液漂洗后,置于培养皿中进行荧光显微镜下观察。
1.4 实时定量RT-PCR基因表达分析
1.4.1 总RNA提取:用RNeasy Mini试剂盒(Qiagen,USA)按照步骤提取耳蜗基底膜组织总RNA。总RNA的质量和数量用Nanodrop 1000分光光度计(Thermo Scientific,USA)进行测定。
1.4.2 cDNA合成:以每个实验个体的总RNA为模板进行逆转录反应。采用High-Capacity cDNA Re⁃verse Transcription试剂盒(Life Technologies,USA),按照步骤合成单链cDNA,于PCR仪(Eppendorf Mas⁃terCycler gradient,Germany)42℃15 min,95℃2 min。
1.4.3 Custom TaqMan® Gene Expression Assays设计:自行设计包含92个遗传性耳聋基因和3个内参基因的PCR array(Applied Biosystems,USA),应用TaqMan®Gene Expression MasterMix,用 ABI 7900HT荧 光 定 量 PCR仪(Applied Biosystems 7900HT Real-Time PCR System,USA)进行实时定量RT-PCR分析。软件SDS 2.4自动输出数据。
1.4.4 数据分析:采用Ct值描述耳聋目的基因在柯蒂氏器的表达情况。具体计算方法参见2-ΔΔCt方法,每个目的基因的Ct值与3个内参基因(Rplp1、Hprt、Actb)的平均值进行归一化得出∆Ct值,然后通过比较目的基因噪声暴露前后的变化得出∆∆Ct值[8],详见下面的计算公式。

ΔCt噪声组=实验组目的基因Ct值-实验组内参基因Ct值
ΔCt对照组=对照组目的基因Ct值-对照组内参基因Ct值
1.5 统计学方法
应用GraphPad Prism 5.0(La Jolla,CA,USA)软件ANOVA方差分析或Student’s t-test进行统计学分析,P<0.05认为具有统计学意义。
2 结果
2.1 噪声暴露造成的听力损害
暴露前和噪声暴露后1天,分别进行ABR检测,了解噪声暴露对实验动物听力功能的影响,共检测4只小鼠8只耳。结果显示噪声暴露后所有检测频率的ABR阈值均明显提高,4个频率的平均阈值由38.9±18.9 dB SPL提高至86.8±10.4 dB SPL,平均阈移为47.8 dB,统计学分析差异具有明显统计学意义(P<0.001)。见表1和图1所示。
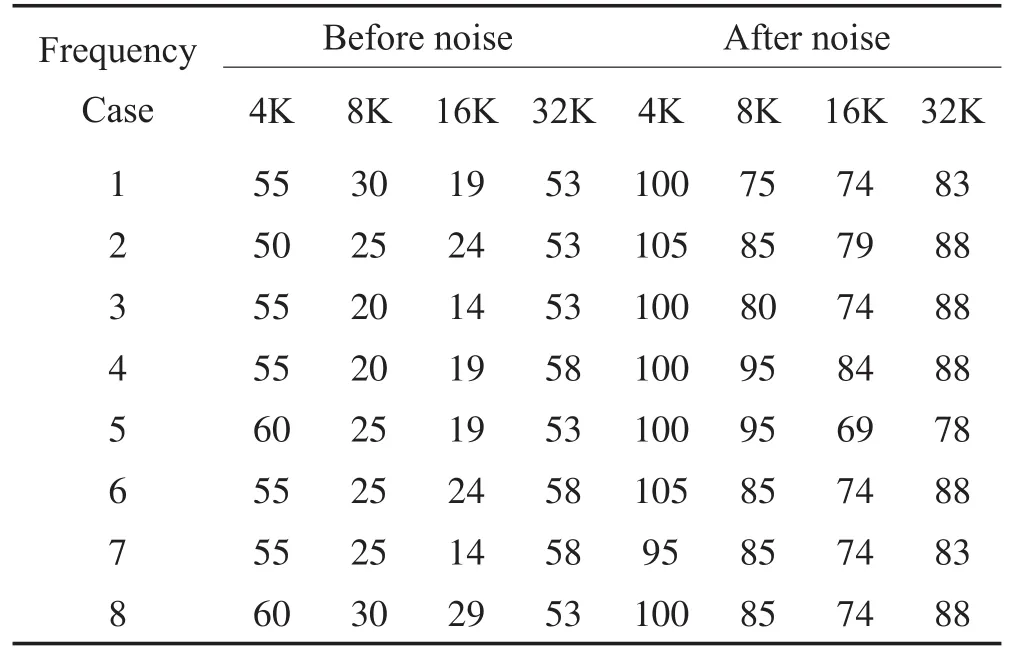
表1 爆震前、后各频率ABR阈值Table 1 TheABR thresholds at 4 frequencies pre-and after noise exposure
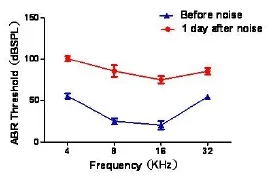
图1 噪声暴露前、后脑干诱发电位阈值检测结果。噪声爆震造成4个检测频率的阈值明显提高Fig.1 Variations of the ABR thresholds after noise exposure at 4 detected frequencies.The thresholds of 4 frequencies improved significantly after noise exposure.
2 噪声暴露造成耳蜗毛细胞损害
采用荧光显微镜观察噪声爆震后耳蜗底转基底膜毛细胞形态学的变化,为减少解剖因素造成人为的组织损伤,采用本课题组建立的原位观察方法进行观察。数码相机连续记录多层面图片(SPOT RT,Color Diagnostic Instruments Incorporation,USA),应用Adobe Photoshop CS6软件自动合成视图。肉眼观察图片中表皮板染色,外毛细胞区染色缺失被记为缺失。如图2中所显示,与正常对照相比较,噪声暴露后耳蜗底转外毛细胞缺失明显增多。
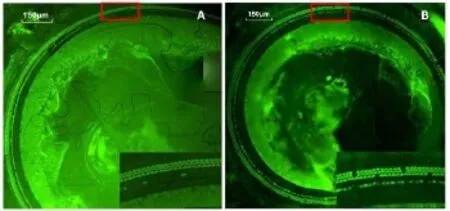
图2 耳蜗底转基底膜毛细胞检查结果(400X)。绿色荧光为Alexa Fluor 488 phalloidin染色,显示毛细胞表皮扳。A示正常对照耳蜗,B示噪声暴露耳蜗,噪声暴露导致三排外毛细胞明显缺失。Fig.2 Fluorescence microscopic views of hair cells in the basal turn of the cochlea(400X).Green fluorescence is hair cells’surface plate stained withAlexa Fluor 488 phalloidin.A)Control cochlea.B)Cochlea after noise exposed,shows that the three rows of outer hair cells are obviously missing after noise exposure.
3 遗传性耳聋基因qRT-PCR Array设计
搜索遗传性耳聋基因网站(Hereditary hearing loss homepage),共检索到已克隆的129个耳聋基因,根据耳聋基因在耳蜗中表达的部位及基因的功能,选取92个耳聋基因进行研究,见表2。
4 噪声暴露后耳聋基因表达的变化
本实验qRT-PCR结果显示噪声暴露前、后共有6个基因均未检测到表达(3个标本中至少2个以上表达才被判断为有表达),分别是Gjb3、Dspp、Ucn、Diap3、Myo1a和Ush2a基因。2个基因,Tecta和Col11a2噪声暴露后表达消失,但没有统计学意义。
在92个被检测的基因中有84个在噪声暴露前、后均表达,根据P<0.05的标准,共有6个基因的表达差异具有统计学意义,其中噪声暴露后基因表达下调的基因有4个,分别是Col4a5、P2rx2、Tmc1、Tprn,表达上调的基因有2个,分别是Ndp和Smpx;表达变化的基因中,差异倍数>1.5的基因均为表达上调的2个基因,分别是Ndp和Smpx(见表3)。
5 与RNA-Sequencing(RNA-seq)结果比较分析
与本课题组已经完成的RNA-Seq数据进行比对分析发现,纳入研究的耳聋基因在噪声暴露前共有12个基因运用RNA-Seq技术在耳蜗柯蒂氏器中未检测到表达,包括Gjb3、Dspp、Ush2a、Tecta、Tnc、Coch、Col4a6、Kcnq4、Myo1a、Myo3a、Sema3e和Ucn;接受噪声暴露后Coch基因表达升高、Sema3e基因出现少量表达外,其它基因亦无明确表达。噪声暴露前Cdh23和Myo15基因出现少量表达,噪声暴露后表达完全消失。两组实验方法揭示耳蜗柯蒂氏器中Gjb3、Dspp、Ucn、Myo1a和Ush2a基因噪声暴露前后均不表达(见图3)。
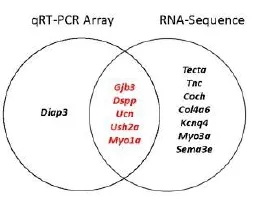
图3 qRT-PCR Array与RNA-Sequence比对分析发现,噪声暴露前、后两种检测方法共有5个基因均不表达,红色颜色标识。Fig.3 Comparison the results between qRT-PCR Array and RNA-Sequence.5 common genes are not detected by both qRT-PCR Array and RNA-Sequence methods pre-and after noise exposure(Marked in red)
6 讨论
本研究采用候选基因策略,选取部分人类遗传性耳聋基因,研究其在噪声爆震诱发的小鼠耳蜗损伤动物模型上的表达变化情况,以期发现噪声相关的耳聋易感基因。截止到目前为止,人类定位的耳聋基因座位已超过200个,其中129个基因被克隆,预测与耳聋相关的基因大约有500~600个。这些基因中,仅KCNE1、KCNQ4、CAT、PCDH15、MYH14、HSP70和Pjvk基因与噪声性聋的易感性相关得到学者的共识,还有许多噪声性耳聋易感基因有待进一步被鉴定出来。
不论是冷害还是冻害,葡萄的受害程度除了和当时的温度下降幅度有关以外,还和葡萄自身的健康水平、所处的生长状态及其生长位置有关。越是衰弱的植株,受冻后受到的伤害越大;越是处于生长顺畅阶段的植株或器官,受伤越严重;处于坡底部的植株会比处于坡顶端的植株受伤更重,处于坡中部的植株往往受伤最轻。
既往研究表明噪声引起以外毛细胞改变为主的细胞变化,表现为细胞体变形、肿胀、细胞质均质化,细胞核位移、核固缩、核碎裂、核溶解、细胞消失、数量减少,内毛细胞损伤很轻甚至无损伤[9,10]。故本实验在进行qRT-PCR array设计时,首选那些在内外毛细胞中表达的基因作为研究对象,同时结合基因的功能进行设计。表达于内、外毛细胞的耳聋基因共有25个,分别是Myo7a、Myo15a、Tmc1、Otof、Cdh23、Gipc3、Strc、Pcdh15、Rdx、Triobp、Cldn14、Myo3a、Whrn、Espn、Myo6、Ildr1、Loxhd1、Kcnq4、Myh14、Wfs1、Pou4f3、Myh9、Actg1、Ccdc50、Tjp2基因。Slc26a5基因仅表达于内毛细胞,Serpinb6基因仅表达于外毛细胞。
爆震后耳蜗螺旋神经节细胞也同样受到损伤,表现为细胞数减少,减少的神经节细胞主要发生在耳蜗毛细胞大量缺失最明显的部位,表达于螺旋神经节的Slc26a4、Tmprss3、Pcdh15、Kcnq4、Wfs1、Myh9基因亦纳入研究。强噪声暴露后还可以引起支持细胞(Deiters细胞和内、外柱细胞)的缺失,Gjb2、Gjb6、Tmprss3、Cldn14、Myh14、Tjp2、Tmpr基因均表达于支持细胞。
本研究通过噪声爆震造成小鼠耳蜗急性声创伤,引起ABR阈值明显提高,4个频率的平均阈值由38.9 ±18.9 dB SPL提高至86.8±10.4 dB SPL,平均产生47.8 dB阈移。形态学观察发现耳蜗底转基底膜毛细胞缺失明显,为声创伤后听力下降提供病理学依据。为探讨分子病因学机制,收集耳蜗底转基底膜进行候选遗传性耳聋基因qRT-PCR array分析,揭示共有6个基因的表达差异具有统计学意义,其中噪声暴露后基因表达下调的基因有4个,分别是Col4a5、P2rx2、Tmc1、Tprn;表达上调的基因有2个,分别是Ndp和Smpx;表达变化的基因中,差异倍数>1.5的基因均为表达上调的2个基因,分别是Ndp和Smpx。
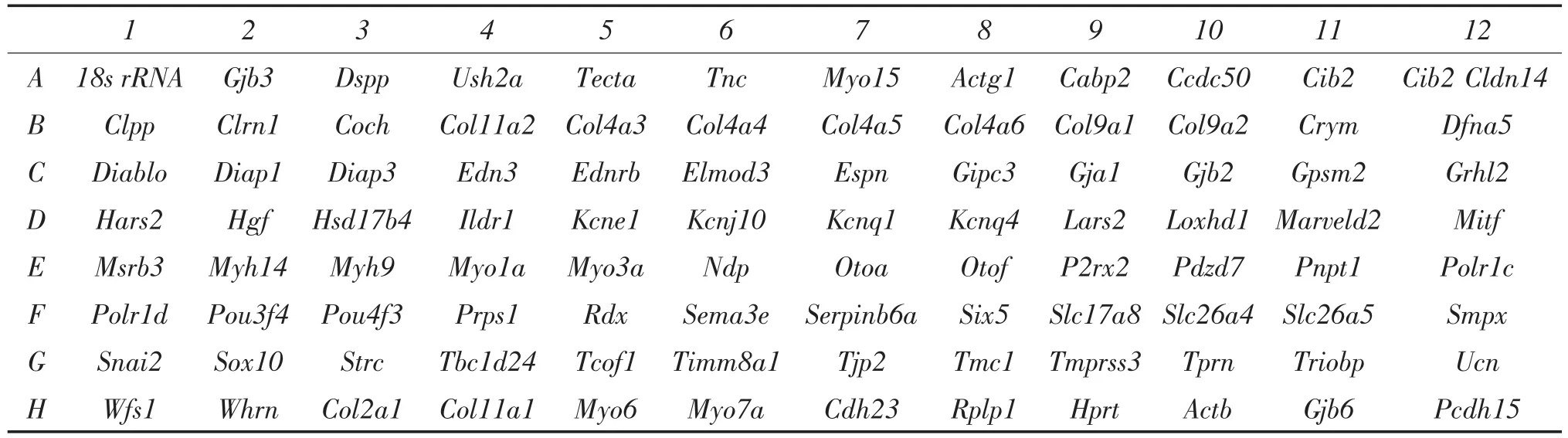
表2 96孔板qRT-PCR Array遗传性耳聋基因分布图Table 2 Arrangement of the hereditary hearing loss genes studied in customized qRT-PCRArray in 96 wells
Col4a5基因(collagen type IV alpha 5 chain),又称Ⅳ型胶原α5链,编码6种IV型胶原其中的一种,是基底膜重要的组成成分。该基因突变与X连锁的Alport综合征有关(Alport syndrome)。该综合征是一种主要表现为血尿、肾功能进行性减退,常伴有感音神经性耳聋和眼部异常的遗传性综合征型耳聋。该基因需要与Col4a6基因头对头相接,以便共享一个启动子。在耳蜗组织,α5(Ⅳ)链表达在整个柯蒂氏器基底膜和螺旋韧带[11]。基因突变后,相应的编码产物表达异常或缺失,从而不能构建正常的Ⅳ型胶原网状结构,导致基底膜损伤,出现听力下降的症状。本实验证实噪声爆震后小鼠耳蜗基底膜中Col4a5的表达下降,可能影响基底膜的完整性,从而影响基底膜与螺旋韧带的连接,导致机械能的传导受累。
Tmc1基因(transmembrane channel-like 1)编码一种跨膜蛋白,是维持耳蜗毛细胞正常功能所必须的蛋白。该基因突变即可引起常染色显性遗传性聋(DFNA36),也可引起常染色体隐性遗传性聋(DF⁃NB7和DFNB11)。Tmc1和Tmc2定位于更短一些的静纤毛的顶端,是机-电换能转导的位置[12]。近期研究表明Tmc1与机-电换能器(mechanoelectrical trans⁃ducer,MET)Ca2+通道有关,人DFNA36耳聋小鼠动物模型Beethoven携带Tmc1基因突变p.Met412Lys,该突变影响MET离子通道孔,降低Ca2+离子的通透性和其与渗透阻断剂-双氢链霉素的结合力,从而补偿因Ca2+离子内流减少而造成的影响[13]。本研究发现噪声爆震后Tmc1表达下降,可能使细胞内Ca2+离子浓度明显降低,从而影响机-电换能效率。
P2rx2基因(purinergic receptor P2X,ligand-gat⁃ ed ion channel,2,嘌呤受体P2X,配体门控离子通道2)编码的P2X2受体广泛分布在耳蜗柯蒂氏器的毛细胞、前庭膜上皮细胞以及螺旋神经节[14],维持耳蜗内淋巴电位(EP,~+100 mV)以及毛细胞跨膜电位(这种电位差为声音转导的驱动力)。EP和毛细胞跨膜电位因P2X2样ATP-门控非选择性阳离子通道被激活而复位[15]。近期通过对P2RX2-null的小鼠模型噪声暴露后不呈现短暂阈移现象的研究,揭示随着噪声强度增加,释放入耳蜗分隔内ATP的增加,从而激活P2X2受体,降低声音的转导和毛细胞间的突触传递[16]。在一个中国6代DFNA41耳聋大家系检测到P2RX2基因c.178G>T(p.V60L)杂合突变,患者表现渐进性听力下降。家系内部接受噪声暴露的年轻人的听力下降幅度明显大于那些未接受过噪声暴露的患者,推测可能携带P2RX2基因p.V60L突变的患者对噪声更加敏感[17]。P2RX2基因可列为噪声易感基因的候选基因。本研究亦揭示噪声暴露后P2RX2基因表达下调。
Ndp和Smpx基因是本研究发现的噪声爆震后表达上调的基因,并且差异倍数>1.5。Ndp基因突变可导致Norrie病,该病是一种X连锁的遗传性疾病,表现出生时视网膜的纤维增殖和血管改变,导致婴幼儿各种不同程度的视力损害,大多数男性患者合并感音神经性耳聋。该基因编码的蛋白Norrin是多种受体的配体,参与Wnt和Wnt依赖的信号系统,它在眼睛和内耳血管发育的过程中发挥重要作用。在发育和成熟的耳蜗,Ndp在血管纹与螺旋神经节之间的毛细血管丛表达,推测Norrin在视网膜和耳蜗以外有发育和/或自身稳定功能[19]。在基因敲除的小鼠模型中,发现其视网膜血管生成障碍和深层毛细血管完全缺失,以及进行性的耳蜗血管丧失而致眼盲和耳聋[20]。本研究爆震后耳蜗组织中Ndp表达升高可能是组织修复的反应。
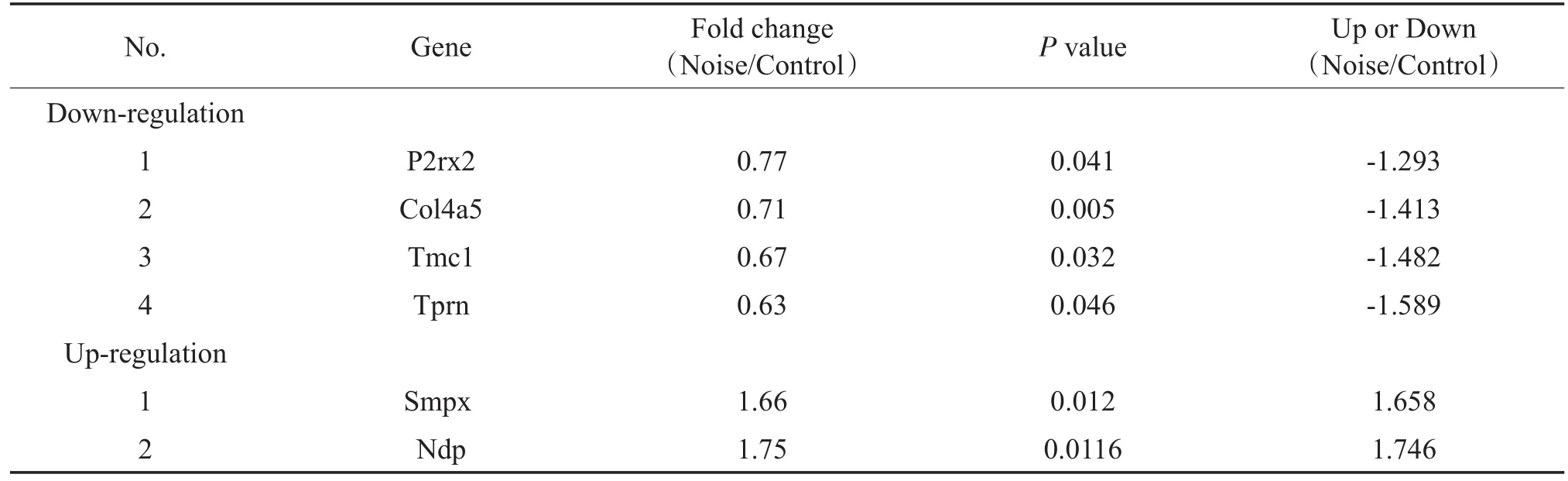
表3 噪声暴露后耳聋基因表达变化情况Table 3 Variations of gene expression after noise exposure
Smpx基因(small muscle protein,X-linked)编码X连锁小肌肉蛋白,其在心脏肌和骨骼肌等横纹肌中高表达,哺乳动物中SMPX高度保守,在骨骼肌受到被动伸展时SMPX表达上调[21]。显然Smpx基因并不是非综合征型耳聋的首先候选基因。但近期采用下一代测序技术在2个不相关的X连锁非综合征耳聋家系中检测到Smpx基因突变(p.Glu72X和P. Glu44ArgfsX37),两个突变均是明确的致病突变,采用RT-PCR技术在人类胚胎8周的内耳标本可明确扩增出SMPX mRNA序列并通过测序证实。通过RNA原位杂交技术在小鼠胚胎14.5天亦在内耳中亦发现有高表达。以上研究首次证实Smpx基因参与耳聋的发病[22,23]。目前SMPX蛋白的功能尚不明确,研究表明肌细胞膜骨架蛋白将肌细胞内的肌原纤维和细胞外的基质通过costameres区域连接起来,SMPX蛋白定位于这个区域,能够增加integrins的粘附功能,提示SMPX蛋白在机械转导过程中发挥间接作用[24]。
本实验通过在爆震小鼠模型进行常见耳聋基因的表达分析,发现噪声引起6个基因的表达发生变化,其中4个基因表达下调(Col4a5、P2rx2、Tmc1、Tprn);2个基因表达上调(Ndp和Smpx)。这些基因在噪声性耳聋的发病机制中可能发挥作用,对这些基因的进一步研究将有助于更好的了解噪声性耳聋的分子致病机制。
1 Konings A,Laer LV,Van Camp G.Genetic Studies on Noise-In⁃duced Hearing Loss[J].Ear Hear,2009,30(2):151-159.
2 Davis RR,Newlander JK,Ling X,et al.Genetic basis for susceptibil⁃ity to noise induced hearing loss in mice[J].Hear Res,2001,155: 82-90.
3 Van Laer L,Carlsson PI,Ottschytsch N,et al.The contribution of genes involved in potassium recycling in the inner ear to noise-in⁃duced hearing loss[J].Hum Mutat,2006,27:786-795.
4 Konings AA,van Laer L,Wiktorek-Smagur A,et al.Candidate gene association study for noise-induced hearing loss in two independent noise-exposed populations[J].Ann Hum Genet,2009,73:215-224.
5 Wang XW,Wang XJ,Song JS,et al.Influence of evoked HSP70 ex⁃pression on hearing function of the cochlea in guinea pigs[J].Acad J First Med Coll PLA,2002,22:922-924.
6 Van Eyken E,Van Laer L,Fransen E,et al.The contribution of GJB2(Connexin 26)35delG to age-related hearing impairment and noise-induced hearing loss[J].Otol Neurotol,2007,28:970-975.
7 Delmaghani S,Defourny J,Aghaie A,et al.Hypervulnerability to sound exposure through impaired adaptive proliferation of peroxi⁃somes[J].Cell,2015,163:894–906.
8 Livak KJ,Schmittgen TD:Analysis of relative gene expression data using real-time quantitative PCR and the 2(−Delta Delta C(T))meth⁃od[J].Methods,2001,25:402–408.
9 Lim DJ,Melnick W.Acoustic damage of the cochlea.A scanning and transmission electron microscopic observation[J].Arch Otolaryngol, 1971,94:294-305.
10 郭维维,刘会占,孙建和,等.强噪声暴露后耳蜗毛细胞的病理形态变化[J].中华耳科学杂志.2009,7(4):324-326.
Guo WW,Liu ZH,Sun JH,et al.Noise-induced morphological changes in the hair cell[J].Chinese Journal of Otology,2009,7(4): 324-326.Zehnder AF,Adams JC,Santi PA,et.al.Distribution of type IV collagen in the cochlea in Alport syndrome[J].Arch Otolar⁃yngol Head Neck Surg,2005,131(11):1007-1013.
11 Kurima K,Ebrahim S,Pan B,et.al.TMC1 and TMC2 localize at the site of mechanotransduction in mammalian inner ear hair cell stereo⁃cilia[J].Cell Rep,2015,12:1606–1617.
12 Corns LF,Johnson StL,Kros CJ,et al.Tmc1 Point Mutation Affects Ca2+Sensitivity and Block by Dihydrostreptomycin of the Mechano⁃electrical Transducer Current of Mouse Outer Hair Cells[J].J Neuro⁃sci,2016,36(2):336–349.
13 Housley GD,Kanjhan R,Raybould NP.et al.Expression of the P2X2 receptor subunit of the ATP-gated ion channel in the cochlea: Implications for sound transduction and auditory neurotransmis⁃sion[J].J Neurosci,1999,19(19):8377–8388.
14 Thorne PR,Muñoz DJ,Housley GD.Purinergic modulation of co⁃chlear partition resistance and its effect on the endocochlear poten⁃tial in the guinea pig.J Assoc Res Otolaryngol[J].2004,5(1):58–65.
15 Housley GD,Morton-Jones R,Vlajkovic SM et al.ATP-gated ion channels mediate adaptation to elevated sound levels[J].Proc Natl Acad Sci USA,2013,110(18):7494-7499.
16 Yan D,Zhu Y,Walsh T,et al.Mutation of the ATP-gated P2Xs re⁃ceptor leads to progressive hearing loss and increased susceptibility to noise[J].Proc Natl Acad Sci USA,2013,110(6):2228–2233.
17 Rehman AU,Morell RJ,Belyantseva IA,et al.Targeted capture and next-generation sequencing identifies C9orf75,encoding taperin,as the mutated gene in nonsyndromic deafness DFNB79[J].Am J Hum Genet,2010,86:378-388.
18 Ye X,Smallwood P,Nathans J.Expression of the Norrie disease gene(Ndp)in developing and adult mouse eye,ear,and brain.Gene Expr Patterns[J].2011,11(1-2):151–155.
19 Rehm HL,Zhang DS,Brown MC,et al.Vascular defects and sensori⁃neural deafness in a mouse model of Norrie disease[J].J Neurosci, 2002,22(11):4286-4292.
20 Kemp TJ,Sadusky TJ,Simon M,et al.Identification of a novel stretch-responsive skeletal muscle gene(Smpx)[J].Genomics,200, 72:260-271.
21 Schraders M,Haas SA,Weegerink NJD,et al.Next-generation se⁃quencing identifies mutations of SMPX,which encodes the small muscle protein,X-linked,as a cause of progressive hearing impair⁃ment[J].Am J Hum Genet,2011,88:628-634.
22 Huebner AK,Gandia M,Frommolt P,et al.Nonsense mutations in SMPX,encoding a protein responsive to physical force,result in X-chromosomal hearing loss.Am J Hum Genet[J].2011,88: 621-627.
23 Palmer S,Groves N,Schindeler A,Yeoh T,Biben C,et al.The small muscle-specific protein Csl modifies cell shape and promotes myo⁃cyte fusion in an insulin-like growth factor 1-dependent manner[J]. J Cell Biol,2001,153:985–998.
The responses of hereditary hearing loss genes to acoustic injury
YANG Shuzhi1,3,CAI Qunfeng3,DONG Youyi3,YANG Weiping2,3,HU Bohua3
1 Department of Otolaryngology,The First Affiliated Hospital to the Chinese PLA general Hospital,Beijing,100048,China
2 Department of Otolaryngology and Head&Neck Surgery,Institute of Otolaryngology,Chinese PLA General Hospital, Beijing,100853 China
3 Center for Hearing and Deafness,State University of New York at Buffalo,Buffalo,NY 14214,USA
ObjectiveTo determine the response of hereditary hearing loss genes to acoustic injury in mice.Methods Eight C57BL/6J mice(4 males and 4 females,4 weeks old)were randomly divided into a control and a noise group.The noise group subjects were exposed to a broadband noise at 120 dB SPL for 1 hour.ABR thresholds were measured and missing outer hair cells were quantified to determine the level of cochlear damage 1 day after noise exposure.qRT-PCR arrays were used to determine the expression levels of 92 genes that have been identified in human as hereditary hearing loss genes. Results ABR measurements showed a significant increase in threshold after the noise exposure(P<0.001)and pathological assessment revealed outer hair cell lesions in the basal turn of the cochlea.Gene expression analysis identified 6 genes that displayed significant expression changes.Among these genes,four(Col4a5,P2rx2,Tmc1,and Tprn)were down-regulated, and two(Ndp and Smpx)were up-regulated.These genes participate in various cellular functions.Conclusion Noise-induced cochlear damage is a complex degenerative process and multiple deafness genes are involved in its etiology.
Acoustic injury,Hereditary hearing loss,Gene,Mouse,mRNAexpression.
R764
A
1672-2922(2016)06-719-6
2016-09-03)
10.3969/j.issn.1672-2922.2016.06.005
美国国立卫生院耳聋和其他交流障碍国立研究所RO1项目(RO1DC010154 to BH Hu)
杨淑芝,博士,副教授,研究方向:耳聋的遗传学研究。
胡博华,Email:bhh@buffalo.edu

