仔猪副伤寒活疫苗合成培养基发酵工艺应用研究
朱良全, 孙晔,,刘延亭,蒋卉,彭小薇,陈祥,丁家波*
(1.中国兽医药品监察所,北京 100081;2.北京中海生物科技有限公司,北京 100081;3.江苏省人兽共患病学重点实验室,江苏扬州 225009)
仔猪副伤寒活疫苗合成培养基发酵工艺应用研究
朱良全1, 孙晔1,2,刘延亭2,蒋卉1,彭小薇1,陈祥3*,丁家波1*
(1.中国兽医药品监察所,北京 100081;2.北京中海生物科技有限公司,北京 100081;3.江苏省人兽共患病学重点实验室,江苏扬州 225009)
为确定仔猪副伤寒活疫苗合成培养基发酵参数,根据发酵过程中的关键技术,设计3种不同工艺,分别发酵培养21 h,每隔3 h取样进行活菌计数表明,培养15~21 h均可达细菌稳定期,工艺3培养菌数高于其余2种,其最适培养时间为18 h;将合成培养基以1%、2%和3%的接菌量按工艺3分别发酵18 h,发现3者培养菌数基本一致。进一步比较4批合成培养基和普通肉汤发酵18 h的培养效果,期间15、18 h抽样的合成培养基培养菌数分别比普通肉汤高12%和25%;发酵18 h的菌液对小鼠安全性及对兔的免疫原性,两者基本一致,接种小鼠均10/10健活,免疫攻毒兔均达4/5~5/5保护,对照攻毒兔5/5死亡。结果表明,发酵培养工艺3可行,可实现仔猪副伤寒活疫苗合成培养基高密度培养,且发酵菌体安全性及免疫原性良好。
合成培养基;发酵工艺;培养菌数;安全性;免疫原性
仔猪副伤寒(Paratyphus swine)又称猪沙门氏菌病(Swine salmonellosis),是由猪霍乱沙门氏菌(Salmonellacholeraesuis)引起的一种仔猪高热传染病,目前主要通过接种疫苗进行预防[1-3]。我国的仔猪副伤寒活疫苗毒力稳定、安全,在猪沙门氏菌病防控中发挥了重要作用[4]。但其制苗用菌液生产一直采用普通肉汤,该培养基主要成分牛肉汤受动物的种类、年龄、及肉源的新鲜与消化程度影响大,造成疫苗批次间的质量不稳定,很难建立标准化发酵工艺参数[5-6]。合成培养基替代天然培养基是发展的必然趋势,由于其成分相对确定、质量稳定、操作简便,易于在线检测、监控和及时调整,故成为国内外研究的热点[6]。合成培养基的配套发酵工艺是实现高细胞密度发酵培养的关键。由于具有较高的技术含量,一般为商业秘密或专利产品,相关正式报道较少。本课题组在成功研制出仔猪副伤寒活疫苗生产用合成培养基的前期基础上,对其发酵工艺进行研究,以期为指导该合成培养基科学应用提供实验依据,从而进一步为其他细菌类疫苗合成培养基及配套发酵工艺的研究提供借鉴。
1 材料
1.1 菌种 生产用菌种为猪霍乱沙门氏菌(CVCC79500株)(2006.8.29冻干,0.3 mL/支);检验用菌种为猪霍乱沙门氏菌(CVCC79102株)(2006.8.29冻干,0.3 mL/支),由中国兽医药品监察所鉴定、保管和供应。
1.2 培养基及试剂 仔猪副伤寒活疫苗合成培养基(批号为200801、200802、200803),由北京中海生物科技有限公司配制及提供。其主要成分:胰酪蛋白胨(批号VM732731-644), 购自MERCK公司;酵母浸粉(批号911948)购自OXOID公司;磷酸二氢钾、磷酸氢二钠、氯化钠、碳酸钠、葡萄糖等均为分析纯化学试剂,购自北京化学试剂公司。
普通肉汤( 批号为200811、200812、200813、200814)由哈药集团生物疫苗有限公司配制及提供。
1.3 30 L发酵罐 BIOF-2000型,上海高机生物工程有限公司。
1.4 动物 小鼠:ICR系,30~35日龄、体重18~22 g,清洁级;大耳白兔:体重1.5~2.0 kg,普通级。由中国兽医药品监察所实验动物组采购并提供。
2 方法
2.1 种子液制备 按《中华人民共和国兽用生物制品规程(2000版)》(以下简称《规程》[5])进行。
2.2 不同发酵工艺比较试验 将合成培养基按说明书用注射用水溶解成20000 mL后,输入30 L发酵罐中,116 ℃在线灭菌30 min。待其恢复室温后,按2%加入种子液,按表1设计的3种不同发酵工艺各发酵培养21 h,其培养3、6、9、12、15、18、21 h分别取样,按现行《中国兽药典》[7]方法进行活菌计数。

表1 发酵工艺及参数表
2.3 不同接菌量的比较试验 按2.2项方法将合成培养基无菌定量输入30 L发酵罐后,分别按1%、2%和3%加入种子液,按表1中获得最佳发酵工艺及参数,发酵培养18 h,其培养15、18 h分别取样,按现行《中国兽药典》[7]方法进行活菌计数。
2.4 同常规培养基比较试验结果
2.4.1 发酵培养活菌计数 按2.2项的量及方法将合成培养基和普通肉汤输入发酵罐后,按2%加入种子液,按表1中获得最佳发酵工艺及参数培养18 h,其培养15、18 h分别取样,按现行《中国兽药典》[7]方法进行活菌计数。合成培养基和普通肉汤各培养4批。
2.4.2 培养菌液的安全性试验 取每批合成培养基及普通肉汤培养18 h菌液各100 mL,进行活菌计数后,用生理盐水作适当稀释,按《规程》[5]用量,分别皮下注射体重18~22 g的小鼠10只,0.2 mL/只(含1×108CFU活菌),观察21 d,记录健活情况。
2.4.3 培养菌液的免疫原性试验 取2.4.2项培养菌液,根据其活菌计数结果,用生理盐水作适当稀释,按《规程》[5]用量,分别肌肉注射体重1.5~2.0 kg的家兔5只,1.0 mL/只(含25×108CFU活菌),30 d后,连同条件相同的不免疫对照家兔5只,各皮下注射经肉肝胃(膜)消化汤培养2代的猪霍乱沙门氏菌(CVCC79102株)2.0 mL(含3MLD的活菌),观察30 d,记录健活情况。
2.5 统计分析 使用SPSS数据分析软件包中的独立样本t-检验方法对数据进行分析。*,P<0.05,代表显著性差异,**,P<0.01 ,代表非常显著性差异。
3 结果与分析
3.1 不同发酵工艺参数 试验结果见图1。
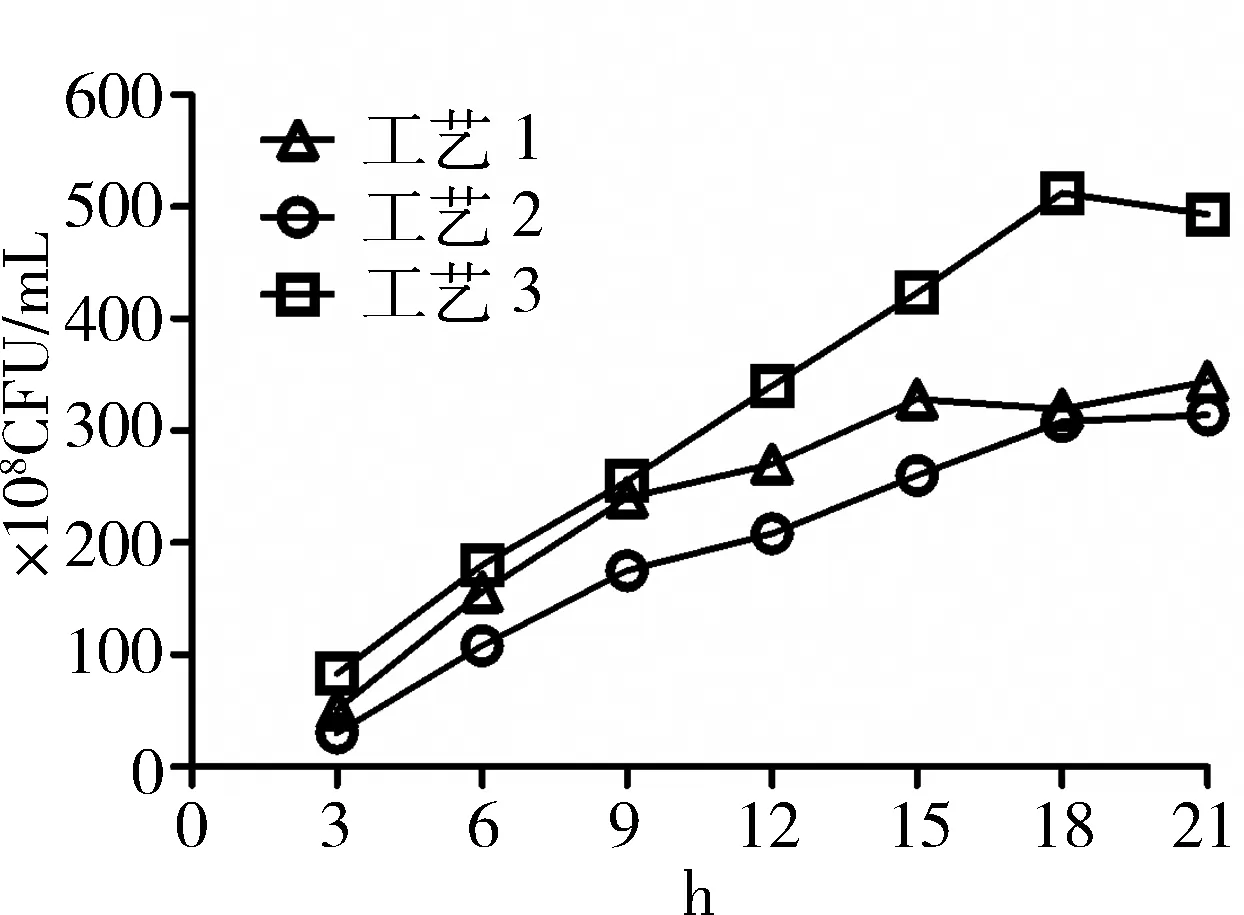
图1 3种不同发酵工艺培养菌数曲线图
从图1可以看出,合成培养基发酵培养15~21 h,3种不同发酵工艺可达到细菌生长的稳定期。工艺3发酵培养菌数高于其余2种,其最适发酵培养时间为18 h。
3.2 不同接种量活菌计数结果 由3.1项结果得出工艺3实现高密度发酵培养最好,进一步按照工艺3进行不同接菌量比较试验,结果见表2。

表2 不同接种量发酵培养菌数(单位:×108CFU/mL)
从表2看出,合成培养基采用1%~3%接菌量进行发酵,培养15、18 h各自培养菌数基本一致。
3.3 与常规培养基发酵试验比较结果 结果见表3,从表3结果及其统计分析看出,发酵培养15 h的4批合成培养基培养菌数平均值虽然高于普通肉汤12%,但差异不明显;而发酵培养18 h,两者差异明显(*,P<0.05)。
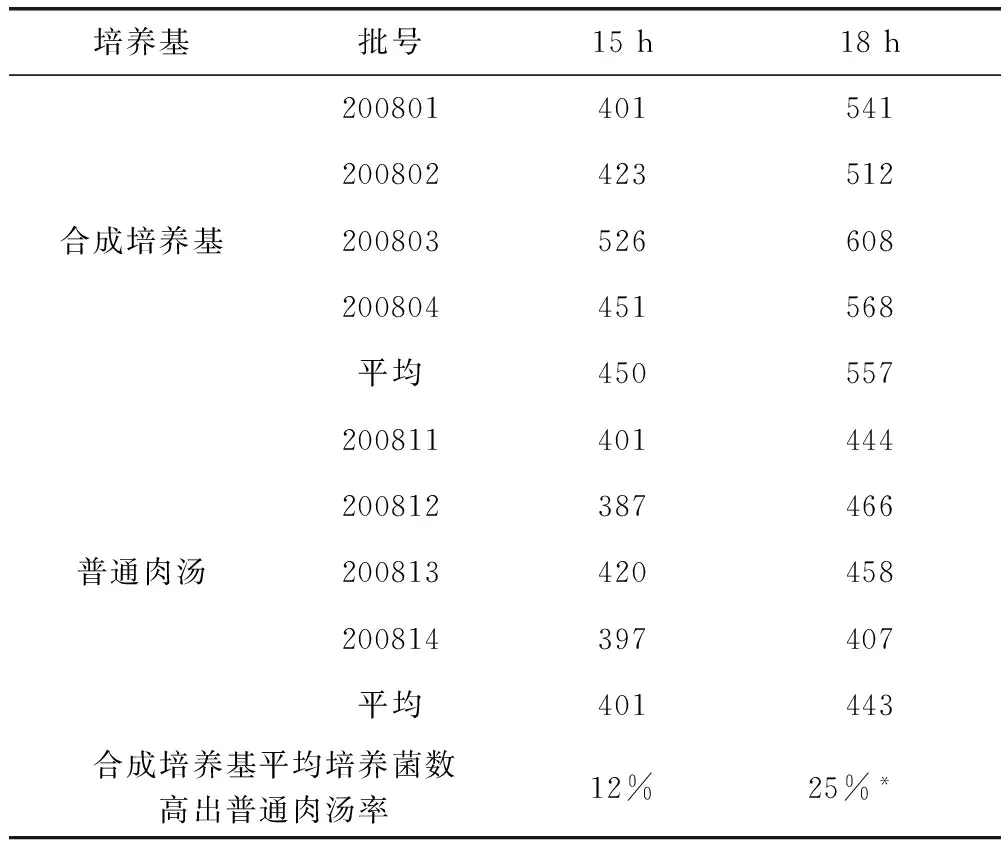
表3 合成培养基与普通肉汤发酵罐培养比较结果(单位:×108CFU/mL)
3.4 培养18 h的菌液对小鼠的安全性 结果见表4。
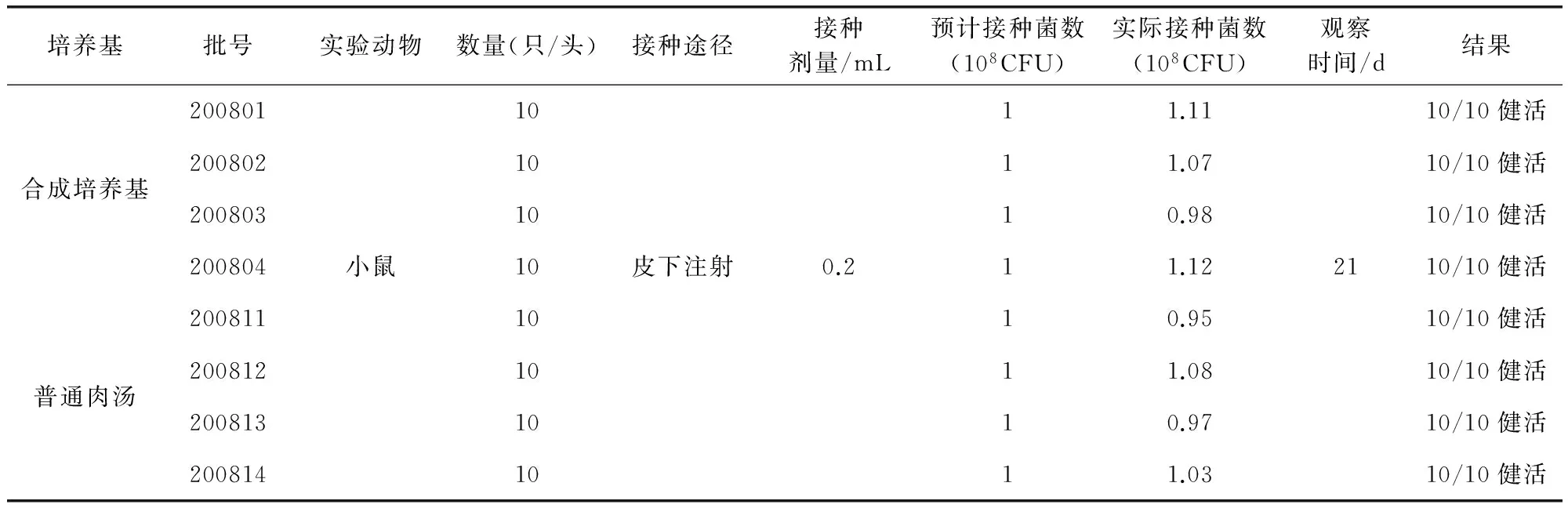
表4 培养菌体安全的安全性试验结果表
从表4可以看出,合成培养基培养的菌液对小鼠安全,与普通肉汤一致,均10/10健活。
3.5 培养18 h的菌体免疫原性 结果见表5。从表5结果可以看出,合成培养基培养的菌液免疫原性良好,其免疫攻毒效果与普通肉汤基本一致,免疫兔达4/5~5/5保护,对照5/5死亡。
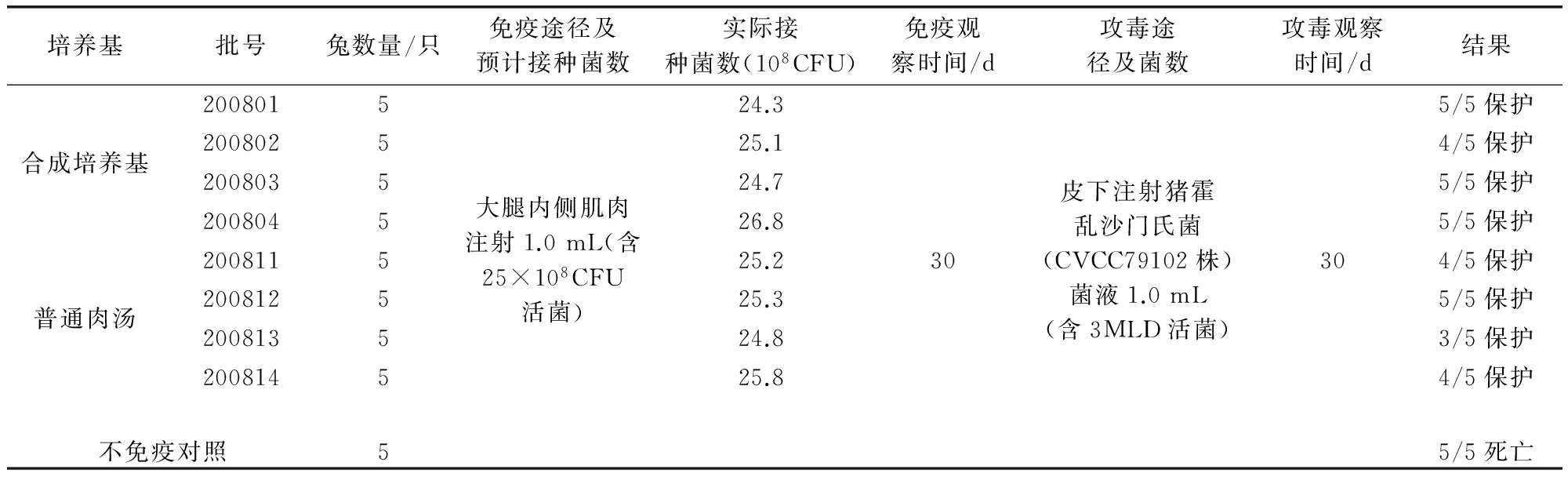
表5 培养菌体免疫原性试验结果表
注:①皮下攻毒菌数54CFU(约含3MLD),测毒时接种18CFU强毒菌液,接种兔分别在第9、11、12日各死1只;第14日死亡2只。②200802批合成培养基肌肉注射免疫攻毒4/5保护(攻毒后12日死亡1只);200811批普通肉汤免疫攻毒4/5保护(攻毒后20日死亡1只),200813批普通肉汤免疫攻毒3/5保护(攻毒后14、15日各死亡1只),200814普通肉汤免疫攻毒4/5保护(攻毒后16日死亡1只)。
4 讨论与小结
自兽用生物制品企业实行GMP以来,大规模发酵培养已广泛应用于成为兽用细菌类疫苗。发酵工艺本身是一个复杂的系统,它涉及到发酵罐类型,如通气搅拌式及气升式发酵罐等,以及具体发酵参数,如温度、溶氧、pH值等[8]。本试验中的通气搅拌式发酵罐在兽用生物制品企业应用较为普遍,其最大的特点通过搅拌桨和进气流量改变溶氧量和换气频率。研制成功的合成培养基解决了批次间稳定性问题,而发酵工艺是实现合成培养基高密度培养的重要途径。综合全文研究表明,研制的合成培养基采用工艺3,2%接种发酵培养18 h,适用于发酵培养猪霍乱沙门氏菌(CVCC79500株)。
在发酵工艺研究中,根据需氧菌营养代谢的特点设计了3种工艺参数,发现溶液pH值下降时采用不同类型碱性物质调节的效果差异比较大。如采用氢氧化钠,因其为强碱,瞬时调整pH值能力很强,导致培养基pH值短期调整幅度大,反而不利于菌体的繁殖。而碳酸钠为强碱弱酸盐,短时间调整能力弱,但促进菌数增殖能力不明显。赖氨酸为碱性氨基酸,既可调节pH值,又被菌体代谢,促进了菌体繁殖及稳定。
虽然普通肉汤起始pH值可高达7.6,但此发酵工艺能否适应普通肉汤,有待进一步研究。因为发酵工艺与培养基有很大关系,普通肉汤中主要成分含有大量嘌呤碱,营养成分复杂[6]。曾有学者报道,合成培养基培养菌液进行后续冻干,其冻干菌存率低于普通肉汤[9-10]。这样的结论有些偏颇,因为冻干菌存率主要涉及菌体状态、冻干保护剂及冻干工艺,与培养基影响不大[11]。曾选择处于对数生长末期或稳定前期的合成培养基培养菌液,采用耐热保护剂进行冻干,其冻干菌存率高达75%以上,且耐热性能良好(数据未发表,待另文表述),无论冻干菌存率还是耐老化性能均优于文献[9,11]报道的菌存率。
致谢:感谢哈药集团生物疫苗有限公司、山东绿都生物科技有限公司相关领导和同志们在试验中给予的大力支持和协助。
[1] 刘芹防,崔尚金.猪沙门氏菌病病原学、流行病学、诊断及防治进展[J].猪业科学,2009,12: 24-28.
[2] 陆承平.兽医微生物学(第四版)[M].北京:中国农业出版社,2007:107-113.
[3] 杨正时,房海.人及动物病原细菌学[M].石家庄:河北科学技术出版社,2003:497-544.
[4] 苏丹萍,张艳萍,贺东生.猪沙门氏菌病疫苗研究进展[J].猪业科学,2009, 12: 42-44。
[5] 农业部兽用生物制品规程委员会.《中华人民共和国兽用生物制品规程》(二〇〇〇版)[S].
[6] 陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社,1995:93-181.
[7] 中国兽药典委员会. 《中华人民共和国兽药典》三部(二〇一〇版)[S].
[8] 李寅,高海军,陈坚.高细胞密度发酵技术[M].北京:化学工业出版社,2006:6-340.
[9] 马振宇,张大鹏,刘欣,等.仔猪副伤寒活疫苗半合成培养基的配方筛选试验[J].中国兽药杂志,2005.39(4):11-13.
[10]崔水保,王红东,于亮明,等. 蛋白胨对仔猪副伤寒疫苗培养菌数和冻干后活菌率的影响[J]. 中国兽药杂志, 2003,37(2):44-45.
[11]华泽钊.冷冻干燥技术[M].北京:科学出版社,2006:1-205.
(编辑:侯向辉)
Study on the Application on the Fermentation Process for Production of Paratyphoid Live Vaccine in Synthetic Medium
ZHU Liang-quan1, SUN Ye1,2, LIU Yan-ting2,JIANG Hui1,PENG Xiao-wei1, CHEN Xiang3*, DING Jia-bo1*
(1.ChinaInstituteofVeterinaryDrugControl,Beijing100081,China;2.BeijingZhonghaiBiotechCo.,Ltd,Beijing100081,China;3.JiangsuKeyLaboratoryofZoonosis,YangzhouUniversity,Yangzhou,Jiangsu225009,China)
This study was carried out to identify the fermentation parameters for production of paratyphoid live vaccine in the synthetic medium. According to the key techniques of fermentation, three different fermentation processes were designed to produceSalmonellaentericaserovar Choleraesuis (S.choleraesuis) strain CVCC79500, and the samples were taken out for live bacteria counting every 3 h. The growth of strain CVCC79500 could reach its stationary phase after fermentation for 15~21 h. The obtained bacteria count was higher using the No.3 process than using the other two, and the optimal fermentation time was 18 h. The strain CVCC79500 was produced in synthetic medium via the No. 3 fermentation process for 18 h with different inoculation amount as 1%, 2% or 3%. The obtained bacteria count was similar with different inoculation amount at 15 h and 18 h. Further, we compared the production for the strain CVCC79500 for 18 h in either synthetic medium or common broth. The live bacteria count was measured at 15 h and 18 h as well. The average bacteria count was 12% and 25% higher in synthetic medium compared to in common broth at 15 h and 18 h, respectively. Finally, we investigated the safety and immunogenicity of the bacteria harvested at 18 h from both medium. Both culture were safe for immunized mice as the survival ratio (number of alive species / number of vaccinated species) of 100% (10/10). Also both culture showed the protective ratio (number of protected species / number of challenged species) of 80%~100% (4/5~5/5), with the mortality (number of died specied / number of challenged species) for non-vaccinated control of 5/5. Therefore, the No.3 fermentation process was workable and can achieve the high density cultivation of paratyphoid live vaccine in synthetic medium. The fermented bacteria were safe and had good immunogenicity.
synthetic medium;fermentation process;bacteria count;safety;immunogenicity
江苏省人畜共患病重点实验室(R1410);北京市科技新星计划项目(No. XX2013099)
朱良全,从事人畜共患病病原学、细菌类疫苗合成培养基及相关兽用生物制品研究。
陈祥。E-mail:chenxiang@yzu.edu.cn;丁家波。E-mail:dingjiabo@126.com
2015-12-19
A
1002-1280 (2016) 03-0016-05
S859.797

