3种支原体培养基对猪肺炎支原体CJ株培养效果的比较分析
候凤,李新苹,王钢,李盛东,袁科,王鹏江,李新平,李延涛,贺笋
(新疆天康畜牧生物技术股份有限公司,乌鲁木齐 830011)
3种支原体培养基对猪肺炎支原体CJ株培养效果的比较分析
候凤,李新苹,王钢,李盛东,袁科,王鹏江,李新平,李延涛,贺笋*
(新疆天康畜牧生物技术股份有限公司,乌鲁木齐 830011)
通过猪肺炎支原体CJ株接种3种猪肺炎支原体培养基后的生长活性研究发现,与其他2种培养基相比,接种改良Friis培养基培养2~3 d含菌量可达到1.0×109~10CCU/mL,具有生长迅速、含菌量高的特点,可用于猪肺炎支原体CJ株的培养。
猪肺炎支原体;培养基;生长时间;含菌量
猪支原体肺炎又称猪地方性流行肺炎,我国俗称猪气喘病[1],是由猪肺炎支原体引起的一种慢性、接触性、呼吸道传染病[2],可造成带菌病猪生长发育缓慢、生长率降低、饲料转化率降低以及饲料和人力的浪费。此外,猪肺炎支原体能够引起机体免疫抑制,致使其他疫苗免疫失败[3-4]。
目前,我国猪肺炎支原体的分离培养难度很大,传统的培养方式耗时长,并且滴度不高,是目前支原体疫苗规模化生产的技术瓶颈。现有的培养猪肺炎支原体的培养基主要有1975年报道的Friis培养基[5]、1975年江苏农科院发明的KM2培养基[6]、《中华人民共和国兽用生物制品规程》(二〇〇〇年版)[7]中提出的猪肺炎支原体培养基和2006年农业行业标准中提到的A26培养基。以上述传统培养基及培养工艺培养自行分离的猪肺炎支原体CJ株的共同缺点是生长速度较慢且含菌量较低(在1.0×107~8CCU/mL之间),从而影响疫苗的免疫效力。针对以上问题,本试验进行了改进猪肺炎支原体培养基配方的研究。
1 材料与方法
1.1 材料
1.1.1 菌种 猪肺炎支原体CJ株,由新疆天康畜牧生物技术股份有限公司分离鉴定、保管和供应。
1.1.2 改良Friis培养基商品化成分 猪血清,购自GIBCO公司;PPLO肉汤粉、BHI均购自BD公司;干酵母粉购自安琪公司;氯化钙、氯化钾、磷酸二氢钾、氯化镁、硫酸镁、氯化钠、磷酸氢二钠、酚红、青霉素均购自Sigma公司。
1.1.3 设备 恒温培养箱,购自上海智诚分析仪器制造有限公司。
1.2 方法
1.2.1 3种培养基的配制 改良Friis培养基的配制方法为称取PPLO肉汤粉4.0 g以及脑心浸液粉3.0 g,加入700 mL纯水中,待其溶解后加入30 mL10×汉克氏平衡盐溶液及200 U/mL青霉素,待其溶解后再加入30 mL酵母浸出液以及10 mL 0.25%酚红,最后与经灭补体处理过的200 mL猪血清混合,并调整pH值至7.6,并用0.2 μm滤膜无菌过滤并分装。其中,酵母浸出液需提前制备,取干酵母粉100 g,加去离子水1000 mL,混匀后,在36~38 ℃下发酵60 min后煮沸10 min,冷却后,再以8000 r/min离心20 min,收取上清液,过滤除菌后置2~8 ℃保存备用。同时按照《中华人民共和国兽用生物制品规程》附录[7]配制猪肺炎支原体培养基;参照ATCC方法配制ATCC 1699猪肺炎支原体培养基。随机挑选1~2瓶培养基按现行《中国兽药典》方法[8]进行无菌检验。
1.2.2 种子液培养 将猪肺炎支原体CJ株菌种按1∶10分别继代于以上3种培养基中,置于36~38 ℃恒温振荡培养箱中培养,待菌液pH值降低至6.7~6.8时收集菌液,进行含菌量的测定。
1.2.3 含菌量测定 取菌种依次10倍系列稀释,稀释度达到10-1、10-2、10-3……10-12。再设改良Friis培养基作对照,置36~38℃恒温振荡培养箱内培养14 d。每日观察记录培养物颜色变化和混浊度的变化,直至培养物pH值不再发生变化。最后发生颜色变化的稀释度即为该培养物的CCU(color changing units)滴度。
2 结果
2.1 培养试验 将猪肺炎支原体CJ株分别接种3种培养基,在相同条件下进行培养,其生长时间及含菌量的测定结果见表1。
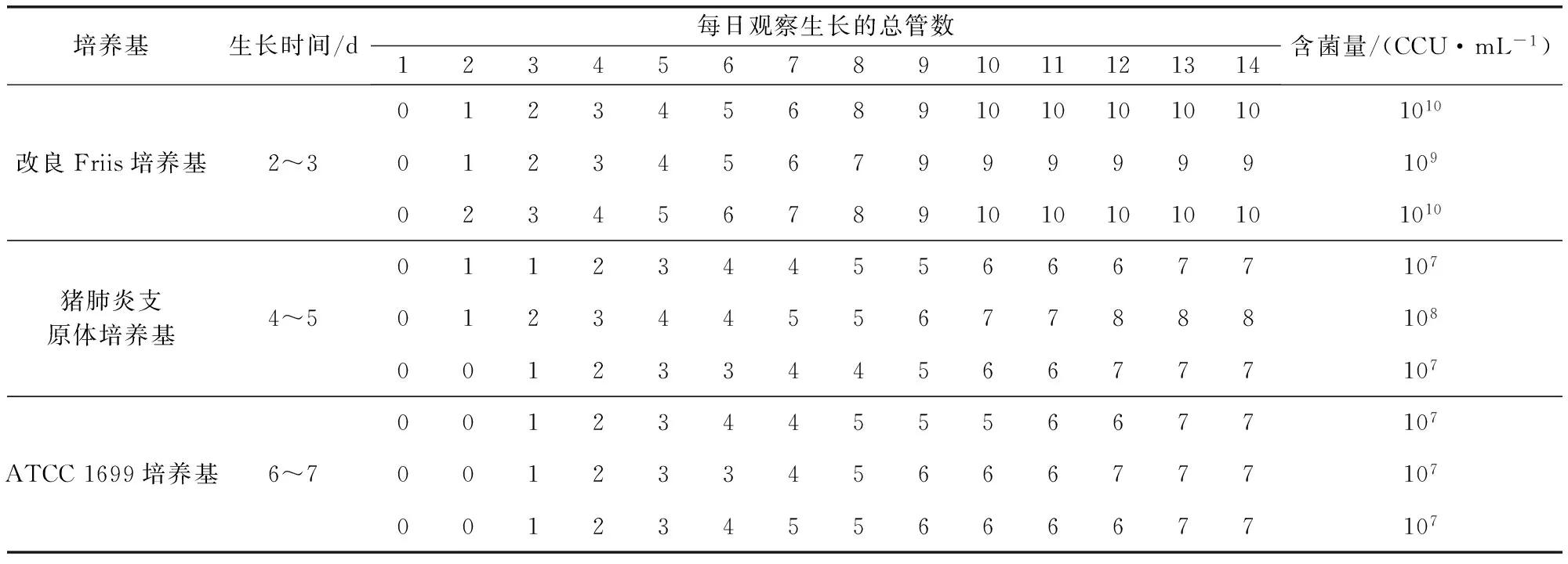
表1 猪肺炎支原体CJ株接种3种培养基的生长时间及含菌量测定结果
由表1中3种培养基培养猪肺炎支原体CJ株生长时间的结果可知,猪肺炎支原体CJ株在改良Friis培养基中生长较快,为2~3 d;猪肺炎支原体培养基需4~5 d,ATCC 1699培养基需6~7 d。由此说明,改良Friis培养基更适宜猪肺炎支原体CJ株的生长,并具有生长迅速的特点。
从3种培养基培养猪肺炎支原体CJ株含菌量的结果可知,改良Friis培养基、猪肺炎支原体培养基和ATCC 1699培养基测定的含菌量逐渐降低,分别为1.0×109~10、1.0×107~8、1.0×107CCU/mL。由此说明,改良Friis培养基培养猪肺炎支原体CJ株具有含菌量高的特点。
2.2 数据分析 将3种培养基培养猪肺炎支原体CJ株含菌量的结果进行对数化处理,并运用Prism 5.0统计分析软件进行数据分析。表2结果显示,改良Friis培养基培养猪肺炎支原体CJ株的含菌量与另2种培养基的差异均极显著(P<0.01),而另2种培养基之间无显著差异(P>0.05)。

表2 猪肺炎支原体CJ株接种3种培养基的含菌量测定结果比较
组间上标字母不同时表示差异极显著,P<0.01;上标字母相同时表示差异不显著,P>0.05
3 讨论
由于支原体很小而产量又少,所以常用的定量估计菌体的方法(如浊度、细胞容积和干重)不适用于猪肺炎支原体的定量检测。适合一般应用的定量测定支原体的主要方法有:浓缩培养物的浊度测定、用菌落计数测量活菌数和用测定变色单位测量活菌数[9]。其中,采用高速离心浓缩菌液测定OD420的浊度方法需要至少15~30 mL菌液进行离心浓缩,不适用于微量定量应用,而且为了减少培养物pH对测定结果的影响,菌液需要洗涤数次,使菌液的收获率大大降低。菌落形成单位(colony form unit,CFU)的测定需要至少两周时间,且菌落在琼脂培养基上生长时暴露时间长,易污染;由于支原体菌落小,难辨别,计数难保证精确性,测定其含量较为困难[10-11]。因此,CCU计数法比较直观,其测定的是培养物中的活菌数,结果更具有代表性,仍是测定支原体含量的经典方法,也是兽用生物制品目前仍采用的方法,广泛运用于支原体的培养检验、活疫苗的保存条件检测等,在检测疫苗活菌数的应用中具有不可替代的作用[12-13]。
猪肺炎支原体可以在无细胞培养基中生长,但条件要求较为苛刻,需要以多种必须的营养物质作为营养来源,比如:含有甾醇和脂质类且能够补充氨基酸的动物血清,含有多种维生素及碳水化合物的酵母浸出液,具有维持培养基渗透压和pH值的无机盐类,抑制杂菌生长的抗生素等等[14]。培养基的质量直接影响猪肺炎支原体的生长发育,从而影响疫苗的免疫效力。本文中的培养基改良于1975年报道的Friis培养基[5]:动物血清使用的是血清蛋白含量很高的猪血清,生长滴度高且来源方便;酵母浸出液是使用面包酵母新鲜发酵而成,能有效促进猪肺炎支原体的生长发育;并且添加了PPLO肉汤粉,更有利于猪肺炎支原体的生长繁殖;并且培养基配制工序简单方便,可操作性强。
用自制的改良Friis培养基培养自行分离的猪肺炎支原体CJ株,2~3 d含菌量可达到1.0×109~10CCU/mL,由此说明,改良Friis培养基具有生长迅速、含菌量高的特点,可用于猪肺炎支原体CJ株的培养。
[1] 李彦明,张映.猪肺炎支原体及其生物学研究进展[J].动物医学进展,2003,24(3):25-27.
[2] 王华,张清,王君玮,等.猪支原体肺炎流行病学和诊断技术研究进展[J].动物医学进展,2009,30(9):73-77.
[3] Dee S,Otake S,Oliveira S,etal.Evidence of long distance air-borne transport of porcine reproductive and respiratory syndrome virus andMycoplasmahyopneumoniae[J].Vet Res,2009,40(4):39.
[4] 王茂文.猪肺炎支原体病的特点及其防制措施[J].畜禽业,2008(2):16-17.
[5] Friis N F.Some recommendations concerning primary isolation ofMycoplasmasuipneumoniaeandMycoplasmafloccularea survey[J].Nord Vet Med,1975,27(6):337-339.
[6] 还红华,邵国青,倪艳秀, 等.猪肺炎支原体培养技术研究[J].中国人畜共患病杂志,2001,17(3):70-71.
[7] 中华人民共和国农业部. 中华人民共和国兽用生物制品规程[M]. 化学工业出版社, 2000.
[8] 中国兽医药典委员会. 中华人民共和国兽药典(三部)[M]. 中国农业出版社, 2010.
[9] 毕丁仁,王桂枝.动物霉形体及研究方法[M]. 中国农业出版社,1998.
[10]Stemke G W, Robertson J A. Comparison of two methods for enumeration ofMycoplasmas[J]. Journal of Clinical Microbiology, 1982, 16(5): 959-961.
[11]陈天寿.微生物培养基的制造与应用[M].中国农业出版社, 1995, 6:470-491.
[12] 杜德燕,张洪,姜来生, 等.不同容积的培养瓶对猪肺炎支原体培养滴度的影响[J].四川畜牧兽医, 2003, 6:29-31.[13]韦艳娜,熊祺琰,刘茂军, 等.不同因素对猪肺炎支原体颜色变化单位测定的影响[J].中国兽药杂志, 2012,46(8):8-10.
[14]李彦明,张映.猪肺炎霉形体培养技术简介[J].上海畜牧兽医通讯, 2003(2): 16-17.
(编辑:李文平)
Cultural Effects of Three Kinds of Mycoplasma Culture Media on Mycoplasma hyopneumoniae Strain CJ
HOU Feng,LI Xin-ping,WANG Gang, LI Sheng-dong, YUAN Ke, WANG Peng-jiang, LI Xin-ping, LI Yan-tao,HE Sun*
(XinjiangTeconLivestockBiotechnologyCo.,Ltd.,Urumqi830011,China)
In this article,Mycoplasmahyopneumoniaestrain CJ was inoculated with three kinds of culture media respectively, and the growth active was studied. Compared with the other two kinds of culture media, the bacterial content with the modified Friis medium could reach 1.0×109~10CCU/mL after culturing 2~3 days, with characteristics of rapid growth and high bacterial, which could be used for the culture ofM.hyopneumoniaestrain CJ.
Mycoplasmahyopneumoniae;medium; growth time; bacterial content
候凤,硕士,技术员,从事动物疫苗研发工作。
贺笋。E-mail: hesun318@163.com
2015-12-03
A
1002-1280 (2016) 03-0021-03
S852.62

