猪圆环病毒2型疫苗专利综述
王宽,刘树柏,王志坤,史越峰
(1. 国家知识产权局专利局专利审查协作北京中心,北京 100190;2. 中国科学院遗传与发育生物学研究所,北京 100101)
猪圆环病毒2型疫苗专利综述
王宽1,刘树柏1,王志坤1,史越峰2*
(1. 国家知识产权局专利局专利审查协作北京中心,北京 100190;2. 中国科学院遗传与发育生物学研究所,北京 100101)
猪圆环病毒2型(PCV2)是引起断奶仔猪多系统衰竭综合征的主要病原,疫苗免疫是防控PCV2的重要手段之一。文章从专利角度对PCV2疫苗的研究现状进行了综述,对涉及PCV2疫苗的专利申请概况、专利分布、重要申请人以及重点专利进行了分析,旨在为PCV2疫苗的开发和专利申请提供参考。
猪圆环病毒2型;疫苗;专利
猪圆环病毒2型(Porcine circovirus type 2,PCV2)是引起断奶仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome,PMWS)的主要病原,在分类学上属于圆环病毒科圆环病毒属[1];除此之外,PCV2还能够引起包括母猪繁殖障碍、肉芽肿性肠炎、先天性震颤等多种疾病,这些与PCV2相关的疾病统称为猪圆环病毒病(Porcine circovirus disease,PCVD)[2-4]。疫苗免疫接种是防控PCVD的有效手段,国内外在PCV2疫苗研究方面开展了大量研究[5-7]。灭活疫苗与亚单位疫苗是早期研究的疫苗[8-9],这些疫苗为PCV2感染的控制发挥了重要作用,但免疫效果仍然有待进一步提高。弱毒疫苗也进行了大量研究[10],但病毒增殖能力、毒力返强等问题仍需要解决。随着分子生物学技术的发展,活载体疫苗、核酸疫苗、嵌合疫苗等新型疫苗正在积极开发中[11-13],成为目前主要的研究热点。
作为专利制度的产物,专利文献中不仅记载了申请日、申请人、发明人、国别等基本信息,还记载了大量与申请主题有关的技术信息。王艳等[14]通过对国内PCV2疫苗专利综述分析,发现国内申请人在驯化和筛选适应PCV2生长的细胞系、构建重组病毒株、建立高密度培养技术等方面做了大量工作。本文从全球专利数据出发,对涉及PCV2疫苗的专利申请概况、专利分布、重点申请人以及重要专利进行了分析,以期为国内对PCV2疫苗的研发和专利申请提供指导。
1 专利申请概览
在SIPOABS数据库进行专利数据检索,全球涉及PCV2疫苗的专利申请量在1660件左右,申请量变化趋势如图1所示。2005年以前,申请量相对较少;2005年之后,申请量逐渐增多,在2006和2008年达到两个峰值;2009-2012年,申请量出现短暂降低的情形,但在2013年又逐渐升高。由于专利申请的公开具有滞后性,2014-2015年的大部分专利申请还未公开,导致近两年检索到的专利申请数量大幅减少。
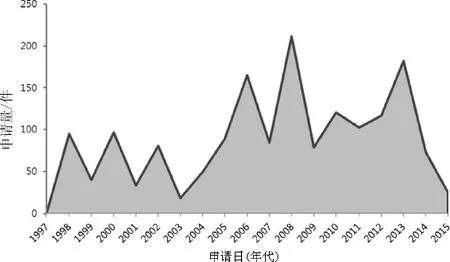
图1 全球涉及PCV2疫苗专利申请量变化趋势图
由于专利权具有地域性,比如:我国只保护在中国获得专利权的专利申请,而外国专利权在中国境内不受法律保护。基于此,如果申请人有意向在不同的国家或地区进行专利保护,则必须在该国家或地区进行专利申请。以专利申请的公开地作为检索入口,采用“PN”字段进行检索,可以对专利的目标市场地进行分析。图2示出了PCV2疫苗专利申请排名前十的目标市场地,可以看出在中国的专利申请最多,美国和欧洲紧随其后,表明PCV2疫苗在中国具有广阔的应用市场和发展潜力,各国申请人非常注重在中国的专利申请。
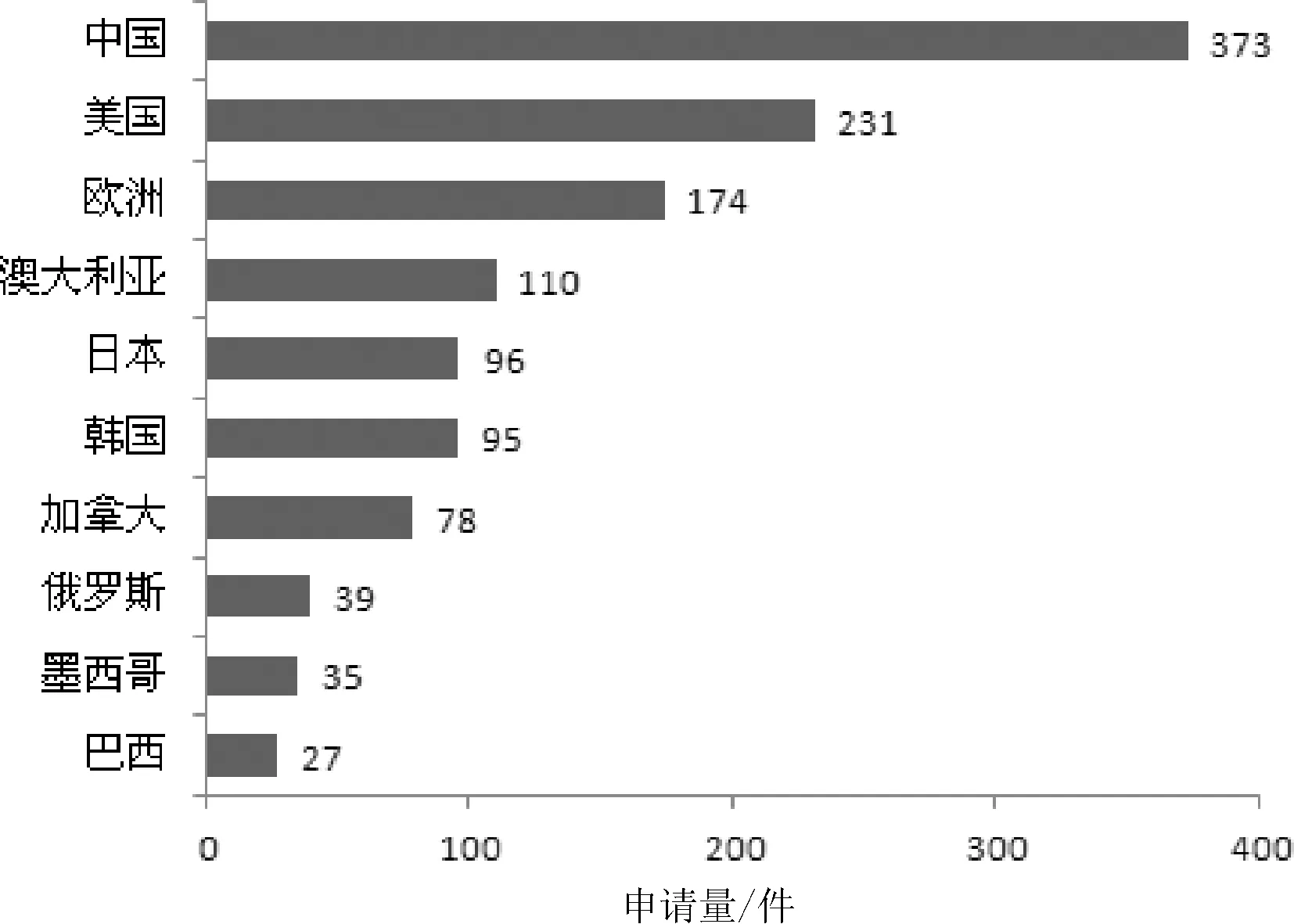
图2 PCV2疫苗专利申请目标市场地分布
专利数据检索中的优先权“PR”字段通常能够反映该专利申请的技术产出地,对该字段进行分析可以在一定程度上反映不同的国家或地区在PCV2疫苗领域的技术发展水平。图3示出了PCV2疫苗专利申请排名前十的技术产出国家或地区。从中可以看出,美国是PCV2疫苗专利技术产出的领头羊,贡献了大量的PCV2疫苗技术,而中国排名第三位。该结果表明,虽然我国在PCV2疫苗领域具有广阔的市场,但是我国自主研发的PCV2疫苗专利技术却远远落后于美国。
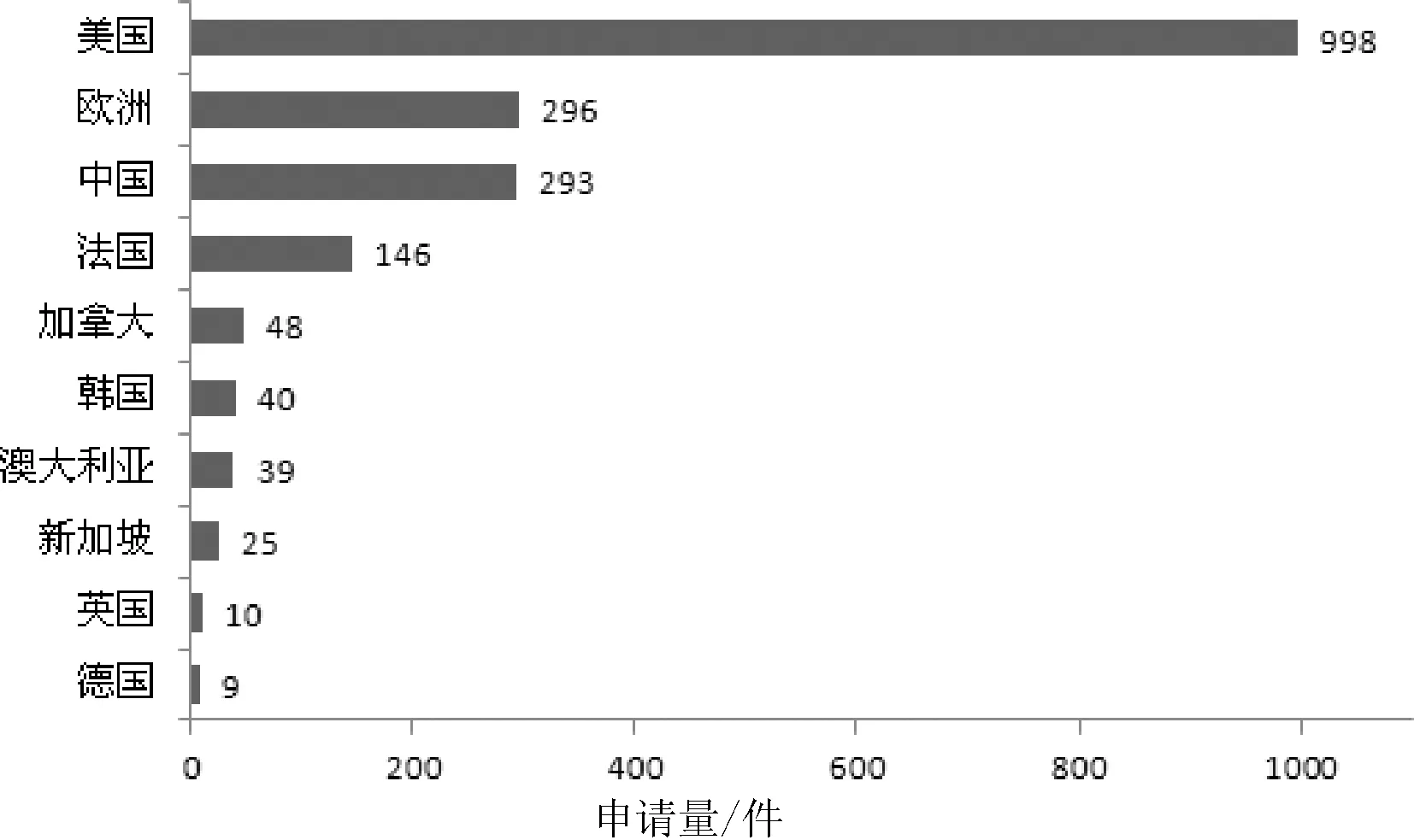
图3 PCV2疫苗专利申请技术产出地分布
2 重点申请人
采用“PA”字段可以统计不同申请人的专利申请量,对PCV2疫苗领域国外和国内的重点申请人进行分析,结果如图4所示。国外申请人中梅里亚公司(MERIAL)、勃林格公司(BOEHRINGER)、萨斯喀彻温大学(UNIV SASKATCHEWAN)、贝尔法斯特皇后大学(UNIV BELFAST)以及弗吉尼亚科技知识产权有限公司(VIRGINIA TECH INTELL PROP)排名前五;而国内申请人中普莱柯生物工程股份有限公司、江苏省农业科学院、华中农业大学、南京农业大学和中国农业科学院哈尔滨兽医研究所排名前五。由图4还能够得知,国外申请人的专利申请数量要远远高于国内申请人的专利申请数量,尤其是梅里亚公司和勃林格公司,二者可谓是行业佼佼者。

图4 PCV2疫苗领域国内外重点申请人分析(图中数字表示专利申请数量/件)
3 重点专利技术
不同类型的疫苗具有不同的适用特点和应用范围,以下针对涉及不同类型疫苗的重点专利技术进行了分析。
3.1 灭活疫苗 PCV2灭活疫苗通常是将PCV2的培养液通过加热或化学试剂处理将其灭活,然后加入佐剂制备而成,具有安全、稳定、高效等特点,是国内外研究较多的疫苗。
梅里亚公司率先于1998年提出关于PCV2灭活疫苗的专利申请FR2769322A1,将其应用到仔猪和母猪的PCV2病毒防治中。我国自主研发的灭活的PCV2a全病毒(LG株)、灭活的PCV2b全病毒(SH株)也是通过筛选合适的毒株制备全病毒灭活疫苗。
目前,普遍将PCV2分为3种基因亚型(PCV2a、PCV2b、PCV2c),其中PCV2a和PCV2b是主要存在的类型。我国猪群中主要流行PCV2b亚型[15],但是针对PCV2b亚型的灭活疫苗研究相对较少,毒株数量有限,因此国内申请人可致力于开发新的PCV2b全病毒灭活疫苗。
3.2 亚单位疫苗 亚单位疫苗是利用微生物的抗原成分制备成为能诱发机体产生抗体的疫苗,PCV2的基因组中存在11个开放阅读框,其中ORF2编码的Cap蛋白是PCV2的主要免疫保护性抗原,是研制PCV2亚单位疫苗的优选靶抗原[16]。
昆虫细胞/杆状病毒表达系统与病毒蛋白的表达情况最为接近,成为PCV2亚单位疫苗生产的常用表达系统[17-18]。勃林格公司的专利申请WO2006072065A2、WO2007076520A2和英特威(INTERVET)公司的专利申请WO2007028823A1涉及了PCV2 Cap亚单位疫苗,上述专利申请均采用昆虫细胞/杆状病毒表达系统进行PCV2 Cap亚单位疫苗的制备。此外,日本国立大学的专利申请JP2009254302A、普莱柯生物工程股份有限公司的专利申请CN101920012A也提出了采用家蚕/杆状病毒表达系统制备PCV2 Cap亚单位疫苗。
酵母表达系统作为一种真核表达系统,具有培养条件普通、细胞生长速度快、易获得可溶性蛋白、生产成本相对较低等特点,现已广泛应用于外源蛋白的商品化疫苗研发[19]。普莱柯生物工程股份有限公司的专利申请CN102115755A、华南农业大学的专利申请CN102127533A以及中国农业科学院哈尔滨兽医研究所的专利申请CN102634525A均公开了利用酵母表达系统来表达制备PCV2 Cap病毒样颗粒的亚单位疫苗。
大肠杆菌表达系统具有遗传背景清楚、基因工程操作简单、抗污染能力强、蛋白纯化技术成熟等优点,也受到研究者的青睐[20-21]。普莱柯生物工程股份有限公司的专利申请CN101948849A和南京农业大学的专利申请CN102174086A均公开了利用大肠杆菌表达系统制备PCV2 Cap蛋白疫苗,通过攻毒实验可以产生免疫保护。
3.3 活载体疫苗 将抗原基因插入到表达载体使之表达可以制备活载体疫苗,根据载体类型的不同,研究者开发了多种多样的活载体疫苗,为PCV2疾病的防控以及疫苗的使用提供了更多的选择。
3.3.1 腺病毒载体 腺病毒载体具有制备简便、宿主范围广、感染性强、转基因效率高等优势,是最具应用前景的载体,可广泛应用于疫苗开发、基因治疗等领域[22]。梅里亚公司的专利申请WO0047756A1、加拿大圭尔夫大学(UNIV GUELPH)的专利申请WO0183737A2以及南京农业大学的专利申请CN1769435A均提及了构建PCV2的腺病毒活载体疫苗。虽然腺病毒是一种理想的疫苗载体,但其仍存在不足之处,比如:整合到靶细胞的基因组DNA中可能会对动物基因组进行修饰,有潜在的转基因生物安全风险,并且腺病毒自身还具有一定的免疫原性。
3.3.2 伪狂犬病毒载体 伪狂犬病毒在宿主细胞内的增殖能力较强,可供外源基因插入,缺失毒力基因的伪狂犬病毒具有良好的安全性,其可以作为PCV2疫苗的候选载体[23-24]。华中农业大学的专利申请CN1523103A公开了一种多基因缺失的伪狂犬病毒载体,该申请人的专利申请CN101457215A提及了可有效防治猪伪狂犬病毒-猪繁殖与呼吸综合征病毒-猪圆环病毒的三价基因工程疫苗。
3.3.3 噬菌体载体 噬菌体载体具有安全、稳定、不需要佐剂等特点,已广泛应用于噬菌体治疗、噬菌体展示、细菌分型以及疫苗制备等领域,将免疫肽段与改进的噬菌体外壳蛋白融合可以制备噬菌体载体疫苗[25]。萨斯喀彻温大学的专利申请WO2009135295A1公开了将PCV2 Cap蛋白的优势表位区克隆至λ噬菌体展示颗粒(LDP)头部蛋白(D)基因下游形成融合基因,成功构建了表达融合蛋白D-CAP的重组λ噬菌体展示载体LDP-D-CAP,免疫仔猪后,未出现任何不良反应并且首免后即可诱导产生抗PCV2的特异性免疫反应。
3.3.4 乳酸菌载体 乳酸菌是一种有效的蛋白表达系统,是安全的口服细菌,以乳酸菌作为载体可以表达抗原成分从而制备疫苗[26];研究者将缺失核定位信号区的PCV2 ORF2基因最终克隆入乳酸链球菌而获得的乳酸菌口服疫苗,小鼠口服后可产生PCV2特异性抗体[27];胡文峰的专利申请CN101875941A公开了一种根据乳酸乳球菌密码子偏好性优化的PCV2 ORF2基因,并将其在乳酸乳球菌NZ9000中表达,可用于制备口服(粘膜)疫苗。
3.4 核酸疫苗 核酸疫苗是将编码抗原的基因直接导入到机体内,并通过宿主细胞的表达合成抗原蛋白从而达到免疫的效果,具有制备简单、免疫效果好、应用较安全、易于贮存等优点[28]。乔治亚大学研究基金会(UNIV GEORGIA RES FOUND INC)的专利申请WO9945956A1首次公开了关于PCV2的核酸疫苗,其是将PCV2基因组的大部分序列(38~1711bp)构建到表达调控序列后克隆形成DNA疫苗;梅里亚公司的专利申请WO0077188A2公开了针对PCV2 ORF1、ORF2的质粒核酸疫苗;浙江大学的专利申请CN1579553A公开了以pCI-neo为骨架载体的PCV2 ORF1/ORF2/ORF3的真核质粒核酸疫苗;山东省农业科学院畜牧兽医研究所的专利申请CN101401936A公开了一种共表达PRRSV ORF5和PCV2 ORF2的重组质粒pIRES-ORF2/ORF5核酸疫苗。
3.5 嵌合疫苗 嵌合疫苗是在基因水平上对抗原进行改造,是应用基因工程手段构建的一类新型疫苗,其通过将多种抗原片段采用不同方式连接或置换,从而得到能表达多种抗原成分的重组基因[29]。弗吉尼亚科技知识产权有限公司的专利申请WO03049703A2首次公开了采用PCV2 ORF2基因置换PCV1 ORF2基因而构建的PCV1-2嵌合病毒。
4 展望
国内外研究者已对PCV2及其疫苗进行了大量研究和实验,商品化的PCV2疫苗能显著降低PCV2感染猪群的临床症状,提高猪群生长性能。目前,PCV2疫苗研究总体呈现出良好的发展态势,随着分子生物学技术和基因工程技术的发展,将涌现出更多新型的PCV2基因工程疫苗,能否形成具有自主知识产权的技术将影响国内申请人在该领域的市场竞争力。
从专利数据上来看,我国PCV2疫苗专利申请数量较高,这是因为国内具有较大的养殖规模,有大量的国外申请人在华进行了专利申请以抢占国内市场。但是,从技术产出地来看,我国的研发实力明显不足,要远远落后于美国;重点申请人的分析也可以说明此问题,国外申请人在该领域进行了大量的专利申请,而国内申请人专利申请量则相对较少;这表明,我国在PCV2疫苗领域的专利申请和专利布局相对于国内的养殖规模来说处于严重欠缺阶段。国内申请人在进行PCV2疫苗研发时不仅要发展自身已掌握的技术,还要从不同方向拓展研发思路,开阔专利布局范围,比如:梅里亚公司在推出商业化PCV2全病毒灭活疫苗Circovac®的同时,在载体疫苗、核酸疫苗等领域也有较多的专利申请。
目前,针对PCV2疫苗仍有许多问题有待进一步解决,包括:PCV2接种后产生明显细胞病变的细胞系、疫苗抗原产量较低、疫苗生产检验和效力评价、商品化疫苗价格较高等问题,迫切需要开发出更优质的PCV2疫苗。伴随着PCV2研究的进一步深入以及生物技术的不断发展,将会有更多高效、低价的PCV2疫苗问世。国内申请人在进行PCV2疫苗研发的同时,不仅要注重对研究成果进行有效的专利保护,形成具有自主知识产权的产品或技术,还要时刻注意竞争对手所进行的专利申请和专利布局,了解对手的申请策略和研发方向,从而在与竞争对手的博弈中占得先机。
[1] 陈燕凌, 王颖旺, 黄恒, 等. 猪圆环病毒2型ORF2基因及其编码蛋白的研究概况[J]. 湖北畜牧兽医, 2013, 34(1): 78-81.
[2] Guo L J, Lu Y H, Wei Y W,etal. Porcine circovirus type 2 (PCV2): genetic variation and newly emerging genotypes in China[J]. Virol J, 2010, 7(1): 273.
[3] 赵晨辰, 王敏, 刘长辉, 等. 猪圆环病毒2型分子流行病学及疫苗研究进展[J]. 中国兽药杂志, 2015, 49(2): 63-69.
[4] Segalés J. Best practice and future challenges for vaccination against porcine circovirus type 2[J]. Expert Review of Vaccines, 2015, 14(3): 473-487.
[5] Xu X G, Wang Z S, Zhang Q,etal. Baculovirus as a PRRSV and PCV2 bivalent vaccine vector: baculovirus virions displaying simultaneously GP5 glycoprotein of PRRSV and capsid protein of PCV2[J]. Journal of Virological Methods, 2012, 179(2): 359-366.
[6] 周波, 苏小齐, 张永红, 等. 国内外商品化猪圆环病毒2型疫苗分类及特点[J]. 中国兽药杂志, 2013, 47(10): 62-65.
[7] Grau-Roma L, Fraile L, Segalés J. Recent advances in the epidemiology, diagnosis and control of diseases caused by porcine circovirus type 2[J]. The Veterinary Journal, 2011, 187(1): 23-32.
[8] Han K, Seo H W, Oh Y,etal. Efficacy of a piglet-specific commercial inactivated vaccine against Porcine circovirus type 2 in clinical field trials[J]. Canadian Journal of Veterinary Research, 2013, 77(3): 237.
[9] Seo H W, Lee J, Park C,etal. Comparison of commercial one-dose and two-dose baculovirus-expressed porcine circovirus type 2 subunit vaccines[J]. Journal of Swine Health and Production, 2014, 22(6): 291-295.
énez-Lirola L G,etal. Expression of antigenic epitopes of porcine reproductive and respiratory syndrome virus (PRRSV) in a modified live-attenuated porcine circovirus type 2 (PCV2) vaccine virus (PCV1-2a) as a potential bivalent vaccine against both PCV2 and PRRSV[J]. Virus Research, 2015, 210: 154-164.
[11]Genmei L, Manlin L, Ruiai C,etal. Construction and immunogenicity of recombinant adenovirus expressing ORF2 of PCV2 and porcine IFN gamma[J]. Vaccine, 2011, 29(47): 8677-8682.
[12]Fu F, Tian H, Li X,etal. C-terminal heat shock protein 70 ofMycobacteriumtuberculosisas a molecular adjuvant for DNA vaccination with the porcine circovirus type 2 ORF2 (capsid) gene in mice[J]. The Veterinary Journal, 2013, 195(2): 244-247.
[13]Hemann M, Beach N M, Meng X J,etal. A live-attenuated and an inactivated chimeric porcine circovirus (PCV) 1-2 vaccine are both effective at inducing a humoral immune response and reducing PCV2 viremia and intrauterine infection in female swine of breeding age[J]. Canadian Journal of Veterinary Research, 2014, 78(1): 8-16.
[14]王艳, 李文平, 韩乃瑞, 等. 我国猪圆环病毒病2型疫苗及相关联苗的研究进展[J]. 中国兽药杂志, 2014, 48 (11): 62-66.
[15]郎洪武, 刘丹, 陈晓春, 等. 猪圆环病毒2型田间分离株的全基因组克隆与基因亚型分析[J]. 中国兽药杂志, 2014, 48(11): 1-4.
[16]李建, 廖园园, 朱薇, 等. 猪圆环病毒2型Cap蛋白单克隆抗体的研制及其应用[J]. 中国兽药杂志, 2013, 47(8): 14-17.
[17]刘长明, 陆月华, 张超范, 等. 猪圆环病毒2型重组Cap蛋白在昆虫杆状病毒中的表达[J]. 中国预防兽医学报, 2006, 27(6): 479-482.
[18]Beach N M, Meng X J. Efficacy and future prospects of commercially available and experimental vaccines against porcine circovirus type 2 (PCV2)[J]. Virus Research, 2012, 164(1): 33-42.
[19]侯成才, 何庆东, 王丽敏, 等. 猪圆环病毒2型Cap蛋白核定位序列对其在毕赤酵母中表达的影响[J]. 中国兽医科学, 2014, 44(6): 563-568.
[20]Opriessnig T, Meng X J, Halbur P G. Porcine circovirus type 2-associated disease: update on current terminology, clinical manifestations, pathogenesis, diagnosis, and intervention strategies[J]. Journal of Veterinary Diagnostic Investigation, 2007, 19(6): 591-615.
[21]刘宗争, 尹逊河, 栾文华, 等. PCV2 ORF2基因在大肠杆菌中的表达及与 PCV2灭活抗原免疫效果的比较[J]. 江西农业学报, 2010, 22(6): 126-129.
[22]刘根梅, 谭实勇, 陈瑞爱, 等. 猪圆环病毒2型ORF2重组腺病毒的构建与鉴定及其免疫效果研究[J]. 中国畜牧兽医, 2010, 37(5): 60-65.
[23]Song Y, Jin M, Zhang S,etal. Generation and immunogenicity of a recombinant pseudorabies virus expressing cap protein of porcine circovirus type 2[J]. Veterinary Microbiology, 2007, 119(2): 97-104.
[24]琚春梅, 陈焕春, 郗鑫, 等. 表达猪2型圆环病毒ORF2基因的重组伪狂犬病病毒的构建及鉴定[J]. 中国农业科学, 2006, 39(8): 1716-1722.
[25]Gao J M, Wang Y L, Liu Z Q,etal. Phage display and its application in vaccine design[J]. Ann Mivrobiol, 2010, 60(1): 13-19.
[26]Drouault S, Corthier G, Ehrlich S D,etal. Survival, physiology, and lysis ofLactococcuslactisin the digestive tract[J]. Appl Environ Microbiol, 1999, 65(11): 4881-4886.
[27]Wang K, Huang L, Kong J,etal. Expression of the capsid protein of porcine circovirus type 2 inLactococcuslactisfor oral vaccination[J]. Journal of Virological Methods, 2008, 150(1): 1-6.
[28]王一平, 郭龙军, 唐青海, 等. 猪圆环病毒2型疫苗的研究进展[J]. 畜牧兽医学报, 2012, 43(9): 1337-1345.
[29]庄敏, 李迪. 病毒嵌合疫苗的研究进展[J]. 国外医学(免疫学分册), 2004, 27(3): 137-141.
(编辑:李文平)
Review of Patents on the Vaccines for Porcine Circovirus Type 2
WANG Kuan1, LIU Shu-bai1, WANG Zhi-kun1, SHI Yue-feng2*
(1.PatentExaminationCooperationCenterofthePatentOffice,SIPO,Beijing100190,China;2.InstituteofGeneticsandDevelopmentalBiology,ChineseAcademyofSciences,Beijing100101,China)
Porcine circovirus type 2 (PCV2) was the main pathogen of postweaning multisystemic wasting syndrome (PMWS). Vaccine immunization was one of the major methods for the prevention of PCV2. The current status of PCV2 vaccines was reviewed based upon patent data, and the general situation of patent application, patent distribution, the important applicants and the key patents for PCV2 vaccines were analyzed, which could provide reference for the development and patent application of PCV2 vaccines.
porcine circovirus type 2; vaccine; patent
王宽,博士,从事微生物生理生化方面的研究;刘树柏,博士,从事肿瘤免疫学研究,为共同第一作者。
史越峰。E-mail: yfshi@genetics.ac.cn
2016-01-22
A
1002-1280 (2016) 03-0064-06
S852.65

