改良小鼠后肢淋巴水肿模型的构建
孙一宇 崔春晓 戴婷婷 蒋朝华 曹卫刚 李圣利
改良小鼠后肢淋巴水肿模型的构建
孙一宇 崔春晓 戴婷婷 蒋朝华 曹卫刚 李圣利
目的通过调整辐射剂量和手术时机,构建一种更为稳定和持久的小鼠后肢淋巴水肿模型。方法将36只8周龄雌性C57小鼠随机分为3组:术前放疗组(R+S)、术后放射组(S+R)、术前及术后放射组(r+S+r)。采用淋巴结摘除手术联合局部放射的方法进行模型构建。R+S组于术前3 d接受4.5 Gy的局部放射,S+R组于术后2周接受4.5 Gy的局部放射,r+S+r组于术前3 d和术后2周分别接受2.25 Gy的局部放射。术后采用排水法测量动物后肢体积变化。术后24周时在后肢注射FDNG以显示体内淋巴管的分布,并结合免疫组化计数微淋巴管数目来评价淋巴管新生的情况。结果在我们为期6个月的观察中,所有小鼠均成功形成淋巴水肿。尤以r+S+r组形成的淋巴水肿最为明显、稳定持久,且死亡率和并发症率较低。术后24周的淋巴管造影显示,R+S及S+R组后肢浅表淋巴管密度增加,r+S+r组少有淋巴管再生。免疫组化结果显示,r+S+r组的淋巴管数量要少于R+S及S+R组(P<0.05)。结论在术前3 d及术后2周分别接受2.25 Gy的局部放射,可以成功构建稳定持久的小鼠后肢淋巴水肿模型。
淋巴水肿动物模型淋巴管放射
构建持久稳定的淋巴水肿动物模型极为困难,传统的小鼠淋巴水肿模型是通过手术切除淋巴结联合局部放疗的方法进行的,存在着较高的死亡率及众多的并发症[1-2]。我们对放射剂量和时机进行了优化,成功构建出一种持久稳定的小鼠后肢淋巴水肿模型,死亡率及并发症都较低,现报道如下。
1 材料及方法
1.1 实验试剂与仪器
兔抗小鼠LYVE-1抗体(1∶400,Angiobio公司,美国);山羊抗兔抗体(1∶200),二氨基联苯胺(武汉谷歌生物科技有限公司);荧光显微镜(Olympus公司,日本);倒置相差显微镜(Leica公司,德国)。
1.2 实验动物
36只健康8周龄C57雄性小鼠(中国科学院动物研究所),SPF级条件下饲养,遵守中国国家卫生研究院实验室研究动物保健和使用指南。
1.3 实验分组
36只小鼠随机分成3组:R+S组(n=12),即术前3 d接受4.5 Gy的局部照射;S+R组(n=12),即术后2周接受4.5 Gy的局部照射;r+S+r组(n=12),即分别于术前3 d及术后2周接受2.25 Gy的局部照射。未作处理的对侧后肢作为正常对照组。
1.4 手术方式
在小鼠右后肢足垫处皮下注射亚甲蓝,使得淋巴结及淋巴管显影,之后腹腔注射5%水合氯醛进行麻醉。麻醉后在右后肢膝上1 cm处作一环形切口,并环形切除1 cm的皮肤及皮下组织。术中仔细保留神经血管束、肌肉及肌腱。在解剖显微镜下摘除腘窝淋巴结,并切除蓝染的淋巴管,电刀灼烧周围皮肤。手术完成后伤口处涂抹红霉素软膏预防感染。
1.5 放射处理
手术处理侧的后肢置于铯139的辐射下,暴露的放射区域以术区为中心面积1.1 cm2,余下部位用铅板进行遮挡。R+S组及S+R组分别于术前3 d和术后2周接受4.5 Gy的照射。r+S+r组则分别于术前3 d及术后2周接受2.25 Gy的照射。
1.6 排水法测量后肢体积变化
为了观察实验侧后肢体积的变化情况,我们采用排水法进行测量。将小鼠后肢浸入装满生理盐水的5 mL的Ep管内,浸水深度为膝关节上方1 cm平面。将后肢拿出后,重新将离心管装满,此时所需要的液体量即为后肢的体积。同样的方法测量未接受处理的后肢。所有动物每周测量1次,持续6个月。每次测量重复3次,取平均值。
1.7 荧光显微镜进行淋巴管成像
前期研究中,我们采用葡聚糖-聚丙烯酸荧光纳米凝胶(FDNG)作为显影剂[3],该材料可在体内清楚显示淋巴管分布情况,具有生物安全性。本实验仍以此为显影剂来显示深部淋巴管。为了观察后肢新生淋巴管的分布情况,在术后24周进行了荧光显微镜的拍摄。于局麻下经后肢足垫处皮内注射FDNG(20 μg的样本与20 μg的水混合),并轻轻按摩足垫促使其更好分散。在荧光光学成像系统下进行拍摄,观察造影剂的摄取及淋巴管的分布情况。
1.8 免疫组化染色
所有小鼠在术后24周处死,取后肢的皮肤及肌肉组织,4%多聚甲醛固定,石蜡包埋,5 μm厚度切片。脱蜡、水化、封闭后,标本与一抗LYVE-1在4℃条件下孵育过夜。次日,标本与二抗孵育30 min,DAB染色,高倍镜下随意选取4个视野进行LYVE-1阳性的管状结构的计数,结果取平均值。
1.9 统计分析
采用SPSS 13.0软件进行数据分析,排水法测量肢体体积,微淋巴管计数采用t检验及方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 术后观察
所有动物术后都很快产生了急性淋巴水肿。r+ S+r组有1只小鼠(9%)因麻醉过量死亡,说明重复低剂量的放射对小鼠来说是可以耐受的。S+R组有3只小鼠(25%)死于感染,还有5只(42%)发生了肢端坏死。R+S组有3只(25%)小鼠死于感染,另有4只(33%)发生肢端坏死。
2.2 各组模型淋巴水肿效果的比较
术后1周,R+S和r+S+r组的肿胀程度要明显高于S+R组。1周后,3组体积均有所减小,相较于S+R组,R+S和r+S+r组的减少速度较慢。术后第2周,分别给予S+R组及r+S+r组4.5 Gy和2.25 Gy的局部放射,之后这两组的体积继续增加,直到第6周。相比之下,由于缺少放射对淋巴管的破坏作用,R+S组的体积持续减小。6周后,3组的体积均开始减小。在第10周和第12周时,R+S组及S+R组的体积接近对照组的水平,r+S+r组第8周后肢体的体积无明显变化,且维持到术后6个月(图1、2)。
2.3 淋巴水肿后肢的淋巴管显影
我们在术后24周时使用FDNG为造影剂,来显影淋巴管。在R+S及S+R组,后肢浅表淋巴管不仅密度增加,且呈现卷曲、分枝的网络状结构(图3)。大量的微淋巴管穿越术区的瘢痕组织,并形成新的连接。r+S+r组少有淋巴管再生,也没有观察到术区两端淋巴管相连接的情况。
2.4 淋巴水肿后肢淋巴管新生的评估
免疫组化染色显示,r+S+r组的淋巴管数量要少于R+S及S+R组(图4、5)。相较于对照侧,实验侧的淋巴管呈现出薄壁、管腔扩大且卷曲等特点(图4)。这表明多次的局部放射在抑制淋巴管新生方面更有效。

图1 术后24周各组肢体肿胀情况对比Fig.1Comparison of the edematous limbs in each group at the 24th week after operation

图2 术后各组肢体体积变化Fig.2Volume changes of the hind limbs in each group at different time point

图3 术后24周后肢活体淋巴管造影Fig.3Lymphatic mapping of hind limbs in vivo at the 24thweek after operation
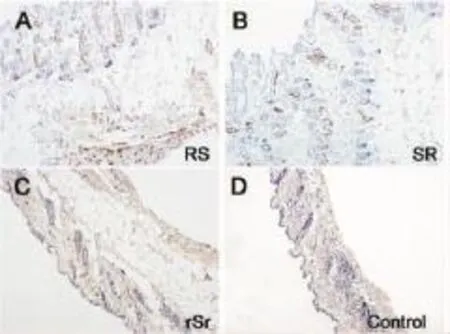
图4 微淋巴管免疫组化观察Fig.4Immunohistochemical observation of lymphatic vessels

图5 微淋巴管计数Fig.5Microlymphatic count
3 讨论
我们成功制备了一种较持久且稳定的小鼠后肢淋巴水肿模型,可维持至少6个月。我们发现,与传统的放射方式相比[4-5],通过多次低剂量照射的方式,实验动物的死亡率及并发症的发生显著降低。因此,我们认为通过手术辅以多次低剂量局部放射的方式可以有效制备持久且稳定的淋巴水肿模型,为相关研究提供了可靠的淋巴水肿模型制备方法。
采用单纯的手术方式,并不能制备持久的水肿模型。主要是由于淋巴管内皮细胞的增殖能力较强,而导致淋巴管恢复再通。Joseph等[6]的研究显示,淋巴管切除术后所致的炎性反应,会使周围组织释放促淋巴管新生因子,如VEGF-C、bFGF等,激活干细胞和已存在的淋巴管内皮细胞,使其分化增殖,从而促进淋巴管新生。该研究指出,没有额外的干预很难形成持久的淋巴水肿。研究报道,通过术前或术后放射的方式可使淋巴水肿的持续时间延长[1,7]。但是,以往的研究中,小鼠的死亡率及肢端坏死率都较高,可能是不恰当的放射剂量所导致。因此,调整放射剂量使得小鼠既不会产生严重副作用,又能维持稳定的淋巴水肿,显得尤为重要。我们设计了3种组合,以确定能与手术较好结合的放射剂量,即术前3 d接受4.5 Gy的局部放射(R+S),术后2周接受4.5 Gy的局部放射(S+R),术前3 d及术后2周分别接受2.25 Gy的放射(r+S+r组)。结果显示,3组都发生了淋巴水肿,其中r+S+r组水肿最为明显且持久,死亡率及并发症率最低,且无肢体坏死发生。
有报道显示,放射导致淋巴水肿,是由于射线破坏了淋巴管内皮细胞,从而导致脂质沉积、TGF-β生成增多(已知其会抑制淋巴管内皮的增殖)[8]。但是,由于手术刺激会使淋巴管内皮细胞及祖细胞参与淋巴管新生,因此术前给予放射就有可能会被术后刺激所产生的淋巴管新生作用所抵消,而无法产生明显的淋巴水肿效果。这就是术后1周R+S组的体积增长最快,但水肿状态很快消退,最后并没有形成明显的淋巴水肿的原因。而在术后给予放射,不仅抑制了手术刺激产生的淋巴管新生作用,而且抑制了VEGF-C的释放[9]。因此,S+R组水肿时间持续更长。然而,4.5 Gy的放射量及手术创伤导致小鼠的死亡率及肢体坏死率上升。而将总量为4.5 Gy的放射剂量分成两等分,并在不同时间点给予(术前3 d,术后2周),结果显示,淋巴管新生现象及大剂量辐射导致的肢体坏死确实得到了抑制及避免。另外,由于反复放射导致的细胞辐射敏感性增加[10],其抑制淋巴管新生的效应明显得到加强。因此,术后很快就能达到淋巴水肿急性期的高峰,且水肿程度在24周内都维持在一个较高水平,而死亡及肢体坏死之类的副反应却较少。活体淋巴管造影及免疫组化显示,淋巴管密度的差异证实了r+S+r组淋巴管新生作用较弱。而且辐射的时机对模型的构造也起到关键作用,之所以选择术前3 d进行放射,是因为有文献报道辐射对淋巴组织的损害是在3 d后开始的[11];而术后2周正是术后淋巴管新生作用开始的时候。虽然总剂量仍为4.5 Gy,但采取分次放射的方法显著减轻了副作用。因此,我们认为上述联合方式是构建淋巴水肿模型的有效方法。
4 总结
我们通过“低剂量放射+手术+低剂量放射”的方式成功构建小鼠淋巴水肿模型,效果持久,死亡率及并发症率较低,此模型能够满足继发性淋巴水肿研究的要求。
[1]Lee-Donaldson L,Witte MH,Bernas M,et al.Refinement of a rodent model of peripheral lymphedema[J].Lymphology,1999,32 (3):111-117.
[2]Yang CY,Nguyen DH,Wu CW,et al.Developing a lower limb lymphedema anim al model with combined lymphadenectomy and low-dose radiation[J].Plast Reconstr Surg Glob Open, 2014,2(3):e121.
[3]Dai T,Zhou S,Yin C,et al.Dextran-based fluorescent nanoprobes for sentinel lymph node mapping[J].Biomaterials,2014,35(28): 8227-8235.
[4]Kanter MA,Slavin SA,Kaplan W.An experimental model for chronic lymphedema[J].Plast Reconstr Surg,1990,85(4):573-580.
[5]Chen HC,Pribaz JJ,O'Brien BM,et al.Creation of distal canine limb lymphedema[J].Plast Reconstr Surg,1989,83(6):1022-1026.
[6]Joseph WJ,Aschen S,Ghanta S,et al.Sterile inflammation after lymph node transfer improves lymphatic function and regeneration [J].Plast Reconstr Surg,2014,134(1):60-68.
[7]Park HS,Jung IM,Choi GH,et al.Modification of a rodent hindlimb model of secondary lymphedema:surgical radicality versus radiotherapeutic ablation[J].Biomed Res Int,2013,2013: 208912.
[8]Hymes SR,Strom EA,Fife C.Radiation dermatitis:clinical presentation,pathophysiology,and treatment 2006[J].J Am Acad Dermatol,2006,54(1):28-46.
[9]Kesler CT,Kuo AH,Wong HK,et al.Vascular endothelial growth factor-C enhances radiosensitivity of lymphatic endothelial cells [J].Angiogenesis,2014,17(2):419-427.
[10]Hopewell JW,Nyman J,Turesson I.Time factor for acute tissue reactions following fractionated irradiation:a balance between repopulation and enhanced radiosensitivity[J].Int J Radiat Biol, 2003,79(7):513-524.
[11]Congdon CC.The destructive effect of radiation on lymphatic tissue[J].Cancer Res,1966,26(6):1211-1220.
An Improvement Model of Secondary Lymphedema in Hind Limb of Mouse
SUN Yiyu,CUI Chunxiao,DAI Tingting,JIANG Chaohua,CAO Weigang,LI Shengli.Department of Plastic and Reconstructive Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:LIShengli(E-mail:drlishengli@sina.com).
ObjectiveTo establish a more stable and sustainable model of mouse lymphedema by adjusting the administrating timing and radiation doses.MethodsThirty-six female C57 mice aged 8weeks were randomly divided into 3 groups:"radiation before surgery"group(R+S,n=12),"radiation after surgery"group(S+R,n=12),and"radiation before and after surgery"group(r+S+r,n=12).The experimental groups received radiation at varied time points:S+R group,4.5 Gy at 2 weeks after surgical treatment;R+S group,4.5 Gy at 3 days before surgery;and r+S+r group,2.25 Gy at both 3 days before and 2 weeks after surgery.The volume change of the hind limbs of animals was measured by drainage method. Lymphangiogenesis in vivo situation was visualized by FDNG injection through the hind limb at 24th week after operation and immunohistochemistry staining was performed to show superficial lymphatic vessels.ResultsIn six-month observation, all mice in the experimental groups formed lymphedema successfully.The r+S+r group showed the most stable hind limb lymphedema with lower mortality and morbidity rates.At 6 months post operation,according to the lymphatic mapping,the lymphatic vessels in R+S and S+R group increased,while rare lymphatic regeneration was observed in the r+S+r group. Immunohistochemistry revealed a decreased number of lymphatic vessels in the r+S+r group,compared with other groups(P<0.05). ConclusionA radiation dose of 2.25 Gy administered 3 days before surgery and 2 weeks after operation successfully enhanced the stability of the lymphedema model of mice hind limb.
Lymphedema;Animal model;Lymphatic vessels;Radiation
R551.2
A
1673-0364(2016)06-0349-04
2016年9月10日;
2016年10月29日)
10.3969/j.issn.1673-0364.2016.06.005
国家自然科学基金(81501571)。
200011上海市上海交通大学医学院附属第九人民医院整复外科。
李圣利(E-mail:drlishengli@sina.com)。

