化学发光法检测血浆BNP的性能评价及结果分析*
基金项目:惠州市科技计划项目(2013Y271)。
化学发光法检测血浆BNP的性能评价及结果分析*
*基金项目:惠州市科技计划项目(2013Y271)。
江小明1,刘文明1,石文2△,江颖慧1,徐建华2
(1.中信惠州医院检验科,广东惠州516006;2.广东省中医院检验科,广东广州 510105)
摘要:目的分析和评价化学发光法检测血浆脑钠肽(BNP)的精密度、正确度和线性。方法根据美国临床和实验室检准化协会(CLSI)EP15-A3、EP6-A文件及其他相关文献实验方案,分析西门子Centaur XP化学发光仪检测BNP的精密度、正确度与线性,结果与厂商声明性能或实验室制定质量目标进行比较。结果化学发光法测定BNP的不精密度小于原卫生部临检中心规定的1/3 TEa(允许总误差)、室内质控数据室间比对的变异系数指数(CVR)均小于±2;室间质评盲样测定结果与靶值的相对偏倚均小于原卫生部临检中心规定的TEa,室内质控数据室间比对的标准差指数(SDI)均小于±2;线性评价结果显示,BNP在(5.3~4 696.7)pg/mL范围内呈一次线性。结论西门子Centaur XP化学发光仪检测BNP的精密度、正确度与线性范围等分析性能基本符合质量目标要求,可满足临床需要。
关键词:脑钠肽;精密度;正确度;线性
脑钠肽(BNP)主要是由左心室分泌并释放到血液循环中的一种多肽类心脏神经激素,主要作用为排钠、利尿、扩张血管、对抗肾素-血管紧张素-醛固酮系统的活性,抑制交感神经过度反应,调节动脉压和血容量,进而对抗水钠潴留[1]。目前脑钠肽被认为是一种有意义的心脏病学标志物[2]。本研究参照相关精密度、正确度及线性评价方案、步骤,探讨西门子Centaur XP化学发光仪检测BNP的精密度,正确度与线性评价途径和方法,现报道如下。
1材料与方法
1.1标本来源线性评价的高值和低值标本来自门诊和住院患者,无溶血、脂血和黄疸。
1.2仪器与试剂BNP检测仪器采用SIEMENS Centaur XP化学发光仪;试剂采用西门子公司生产的配套试剂,配套校准品及伯乐质控品,室间质评盲样标本由原卫生部临检中心提供。
1.3方法
1.3.2正确度评价实验参照EP15-A3文件[3],BNP正确度评价采用以下方案:(1)原卫生部临检中心室间质评盲样检测:测定原卫生部临检中心发放的质评盲样,计算相对偏倚,偏倚小于等于TEa为判断标准。(2) Bio-Rad Unity室内质控数据室间比对:测定2015年1月Bio-Rad的29811和29812 BNP质控品,并进行全球对等组和方法学组比对,计算标准差指数(SDI)值,SDI≤±2.0为判断标准[SDI=(实验室均值-组均值)/组标准差;SDI<1.0 表示良好的正确度(A区),1.0~1.5表示可接受的正确度(B区),1.5~2.0 表示临界的正确度(C区),大于2.0 表示不可接受的正确度](图1)(见《国际检验医学杂志》网站主页“论文附件”)。
1.3.3线性验证参考EP6-A文件[4],选择西门子厂家声明的BNP线性范围高(H)、低(L)浓度水平混合血清,按比例配制成系列浓度的6个标本,每个标本重复2次检测,6个系列浓度制备方案:L、4L+1H、3L+2H、2L+3H、1L+4H、H。将所得数据拟合为一次(Y=b0+b1X)、二次(Y=b0+b1X+b2X2)和三次(Y=b0+b1X+b2X2+b3X3)多项式,判断各项系数与0之间的差异是否具有显著性(t检验)。如果非线性系数b2和b3与0比较差异无统计学意义(P>0.05),则认为存在线性关系,否则该组数据存在非线性,则要进行非线性度的评价。
1.4统计学处理采用Excel2007和SPSS18.0统计软件进行数据录入和分析处理。计量资料采用t检验,P<0.05表示差异有统计学意义。
2结果
2.1精密度评价结果
2.1.1稳定样本多次测量结果利用Bio-Rad两个水平质控品对BNP进行测定,2015年1~3月29811质控品(浓度:101 pg/mL)CV值分别为7.24%、5.18%、4.63%;29812质控品(浓度:370 pg/mL)CV值分别为7.85%、3.82%、7.76%,均小于1/3 TEa、即10%。
2.1.2Bio-Rad Unity室内质控数据室间比对CVR结果2015年1月Bio-Rad 29811和29812质控数据全球比对结果显示,29811质控品的本实验室测定结果与对等组和同方法组的CVR分别为1.3、0.6,29812质控品的本实验室测定结果与对等组和同方法组的CVR分别为1.5、0.9,均小于±2(图2)(见《国际检验医学杂志》网站主页“论文附件”)。
2.2正确度评价结果
2.2.1室间质评盲样结果2013~2014年原卫生部临检中心室间质评盲样测定结果显示,各浓度标本的偏倚均小于允许总误差水平,在可接受范围内(表1)。
2.2.2Bio-Rad Unity室内质控数据室间比对SDI结果2015年1月Bio-Rad 29811和29812质控数据全球比对结果显示,本实验室测定结果与对等组和同方法组的SDI均小于±2(图2,表2)。

表1 原卫生部室间质评盲样测定结果
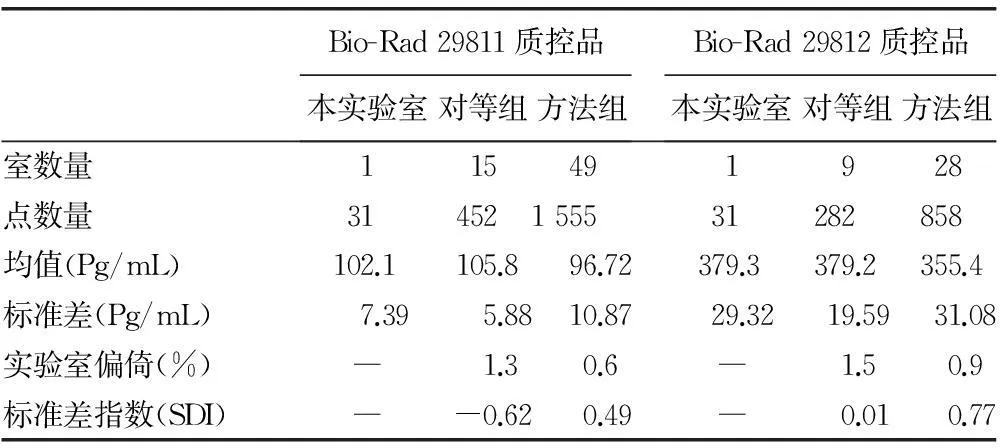
表2 2015年1月BNP的Bio-Rad Unity室内质控数据
-:无数据。
2.3线性评价实验按照EP6-A文件要求,配制6个系列稀释倍数的标本,每个样本重复测定2次。经多项式回归统计,表3结果显示,b2、b3与0比较差异均无统计学意义(P>0.05),在(5.3~4 696.7)pg/mL范围内为一次线性(图3)(见《国际检验医学杂志》网站主页“论文附件”),其方程为Y=0.997X-20.89。
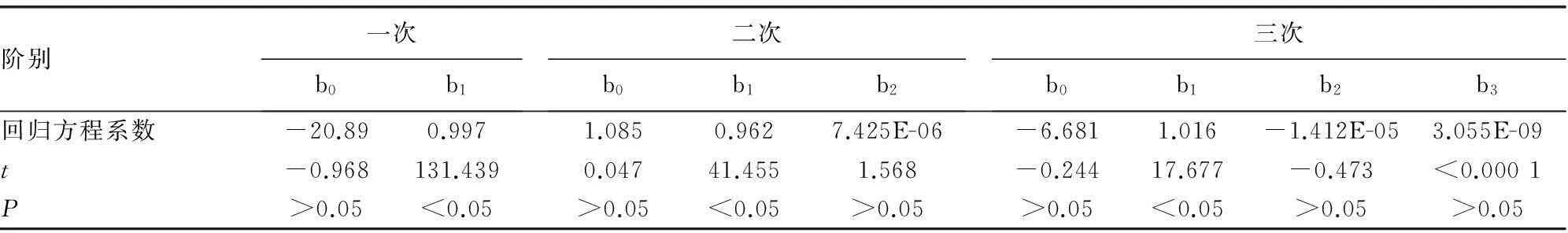
表3 BNP多项式线性回归统计分析结果
3讨论
BNP首先于1988年由日本学者Sudoh等[5]从猪脑分离出,它主要是由心脏分泌并存储的一种神经内分泌激素。NT-proBNP是BNP分泌过程中其前体裂解的氨基末端片段[6],BNP和NT-proBNP都是临床上检测心力衰竭的常用指标[7]。对临床表现为呼吸困难的患者,检测BNP或NT-proBNP有助于心源性和非心源性呼吸困难的鉴别诊断。BNP或NT-proBNP对心脏疾病诊治的临床应用价值相似,没必要同时检测[8]。 BNP是一类具有利钠、利尿、扩张血管、拮抗肾素-血管紧张素-醛固酮系统等作用的激素。急性心肌梗死(AMI)、不稳定型心绞痛(UA)、心力衰竭(HF)、原发性高血压、肾功能不全、慢性阻塞性肺疾病(COPD)等情况时BNP浓度会升高。但BNP相对分子质量小、体内半衰期短(22 min)、体外不稳定,在EDTA抗凝血浆中,室温2 h下降20%、-20 ℃可以延长至48 h,因此标本采集后应尽快完成检测[9]。BNP检测技术最初是放射免疫法(RIA),但其准确性和精密度均不高,且影响因素较多;后来发展为免疫放射测定(IRMA)及酶联免疫吸附法测定(ELISA),其灵敏度、精密度和特异性比RIA虽有提高,但耗时较长(一般需要5~36 h),难以适用于自动化。目前常用的为吖啶酯化学发光法,其检测范围可达2~5 000 pg/mL,准确度和精密度较好,能在自动化分析仪上使用,检测仅需数分钟,可满足临床急诊检验需要[10]。
在健康人群中,BNP主要与年龄和性别密切相关,年龄越大,BNP浓度越高,相同年龄女性高于男性[11];其次与肥胖和种族差异也密切相关;另外血液中的异嗜性抗体(HA)也是影响BNP测定的重要因素之一[12]。HA通过非特异性结合,桥联捕获抗体、标记抗体或标记抗原从而干扰测定,使测定结果与临床表现不符,导致误诊,实验室可以使用稀释法和使用阻滞剂的方法减少干扰[13-14]。
目前国内各级医院检验科都在向实验室标准化方向发展,根据2012《医学实验室-质量和能力认可准则》IS015189的要求,临床实验室在建立或引进新的检验项目时,应该对测量方法的基本性能进行评价,以掌握方法的特征,判断其能否满足临床需要[15]。精密度是反映仪器整体性能的首要指标,本研究应用稳定样本多次测量方法及Bio-Rad Unity室内质控数据室间比对计算CVR方法进行精密度分析,结果显示,化学发光法测定血浆BNP的不精密度均符合质量目标要求,稳定性较好。正确度又称真实度,反映仪器/方法的系统(校准)偏差大小,本研究参照徐建华等[16]研究,应用原卫生部室间质评盲样检测和Bio-Rad Unity室内质控数据室间比对计算SDI方法进行正确度评价,结果显示,原卫生部室间质评盲样测定结果在可接受范围内,SDI结果均小于±2,达到质量目标要求。线性评价实验结果显示,BNP在(5.3~4 696.7) pg/mL范围内为一次线性,实验线性范围与厂家声明的线性范围基本一致。
本研究充分利用室内质控数据及原卫生部室间质评盲样对检验项目进行精密度和正确度验证,方法简单可靠,可操作性强,易于常规实验室推广,同时CLSI EP6-A是目前常用的线性评价标准文件,利用统计软件可方便获得所评价的浓度范围是否具有一次线性,亦具有较好的操作性和适用性。
参考文献
[1]Klimenko AA,Shostak N,Demidova NA,et al.Remodeling of the right heart and the level of brain natriuretic peptide in patients with chronic thromboembolic pulmonary hypertension:a comparative cross-sectional observational study[J].Rational Pharmacotherapy in Cardiology,2013(3):479-489.
[2]Patel HS,Sarawade R.Cardiac markers as diagnostic biochemical markers in heart failure[J].Inter J Pharm Res Schol,2013,2(2):497-510.
[3]Clinical and Laboratory Standards Institute.EP15-A3 User verification of precision and estimation of bias,approved guideline -third edition[S].Wayne,PA,USA:CLSI,2014.
[4]National Committee for Clinical Laboratory.EP6-A Evaluation of the linearity of quantitative measurement procedures:A statistical Approach,Approved Guideline[S].Wayne,PA,USA:NCCLS,2003.
[5]Sudoh T,Kangawa K,M IM,et al.A new natriuretic peptide in porcine brainl[J].Nature,1988,332(1):78-81.
[6]Chien CY,Liu CC,Po HL,et al.The relationship among carotid artery remodeling,cardiac geometry,and serum N-Terminal Pro-B-Type natriuretic peptide level in asymptomatic asians:Sex-Differences and longitudinal GEE study[J].PLoS One,2015,10(7):131440.
[7]Don-Wauchope AC,Mckelvie RS.Evidence based application of BNP/NT-proBNP testing in heart failure[J].Clin Biochem,2015,48(4/5):236-246.
[8]国家卫生和计划生育委员会.WS/T 462-2015 冠状动脉疾病和心力衰竭时心脏标志物检测与临床应用[S].北京:中华人民共和国卫生行业标准,2015.
[9]Egom EE.BNP and heart failure:preclinical and clinical trial data[J].J Cardiovasc Transl Res,2015,8(3):149-157.
[10]李丹.脑钠肽实验室检测及临床应用最新进展[J].心血管病学进展,2012,33(2):230-233.
[11]Oremus M,Mckelvie R,Don-Wauchope A,et al.A systematic review of BNP and NT-proBNP in the management of heart failure:overview and methods[J].Heart Fail Rev,2014,19(4):413-419.
[12]Pan XH,Zhang SZ,Chen HQ,et al.Spuriously high B-type natriuretic peptide level caused by human antimouse antibodies[J].Ann Intern Med,2011,155(6):407-408.
[13]Greunke K,Braren I,Alpers I,et al.Recombinant IgY for improvement of immunoglobulin-based analytical applications[J].Clin Biochem,2008,41(14/15):1237-1244.
[14]韦维,戴盛明.异嗜性抗体在免疫测定中干扰的研究进展[J].国际检验医学杂志,2010,31(10):1123-1126.
[15]中国合格评定国家认可委员会.CNAS-CL02 医学实验室质量和能力认可准则[S].北京:中国合格评定国家认可委员会,CNAS,2013.
[16]徐建华,庄俊华,郑松柏,等.常规方法检测血清总胆红素的正确度评价[J].临床检验杂志,2012,30(12):946-949.

·论著·
Performance evaluation and results analysis of chemiluminescence method for detecting plasma BNP*
JiangXiaoming1,LiuWenming1,ShiWen2△,JiangYinghui1,XuJianhua2
(1.DepartmentofClinicalLaboratory,ZhongxinHuizhouHospital,Huizhou,Guangdong516001,China;
2.DepartmentofLaboratory,GuangdongProvincialHospitalofChineseMedicine,Guangzhou,Guangdong510120,China)
Abstract:ObjectiveTo analyze and evaluate the precision,accuracy and linearity of the chemiluminescence method for detecting plasma BNP.MethodsAccording to the experimental schemes of CLSI EP15-A2,EP6-A files and other relevant documents,the precision,accuracy and linearity of the Siemens Centaur XP chemiluminescence instrument for detecting BNP,and the detection results were compared with the performance declared by manufacturer or the quality target formulated by laboratory.ResultsThe imprecision of BNP detected by the chemiluminescence method was less than 1/3 TEa regulated by the Clinical Laboratory Center of Ministry of Health (allowable total error);the variation coefficient index (CVR) of internal quality control data was less than ±2;the relative bias of the results of external quality control blind samples with the target values were less than Tea regulated by the Ministry of Health;the linear evaluation results showed that BNP was once linearity in the range of 5.3-4696.7 pg/mL.ConclusionThe precision,accuracy and linearity of the Siemens Centaur XP chemiluminescence instrument for detecting BNP can accord with the quality objectives requirements and meet the clinical needs.
Key words:brain natriuretic peptide;precision;accuracy;linearity
收稿日期:(2015-05-08)
文献标识码:
DOI:10.3969/j.issn.1673-4130.2015.24.010A
文章编号:1673-4130(2015)24-3532-03
通讯作者△,E-mail:swing@163.com。
作者简介:江小明,男,副主任技师,主要从事临床检验研究。

