降钙素原在革兰阳性菌和革兰阴性菌感染鉴别诊断中的价值探讨
张 群, 胡晓波
(1.上海交通大学医学院附属第三人民医院检验科,上海 201900;
2.上海中医药大学附属龙华医院检验科,上海200032)
降钙素原在革兰阳性菌和革兰阴性菌感染鉴别诊断中的价值探讨
张群1,胡晓波2
(1.上海交通大学医学院附属第三人民医院检验科,上海 201900;
2.上海中医药大学附属龙华医院检验科,上海200032)
摘要:目的研究血浆降钙素原(PCT)、血浆C反应蛋白(CRP)、血浆中性粒细胞表面CD64(CD64)、血清白细胞介素-6(IL-6)和血清肿瘤坏死因子-α(TNF-α)在革兰阳性菌和革兰阴性菌感染时的水平,探讨这些感染指标在鉴别诊断2种不同细菌感染中的价值。方法选取204例患者,按细菌培养结果分为革兰阳性菌组(25例)、革兰阴性菌组(89例)和阴性对照组(90例),同时测定各组PCT、CRP、CD64、IL-6和TNF-α水平。采用受试者工作特征(ROC)曲线评价PCT等感染指标的诊断性能。结果革兰阴性菌组、革兰阳性菌组和阴性对照组PCT平均浓度分别为10.01、5.80和1.06 μg/L,3组之间差异均有差异有统计学意义(P<0.01);CRP、IL-6和TNF-α水平3组之间差异也均有统计学意义(P<0.05);革兰阴性菌组、革兰阳性菌组CD64明显高于阴性对照组(P<0.01),但革兰阴性菌组和革兰阳性菌组之间差异无统计学意义(P>0.05)。当PCT的Cut-off值为0.41 μg/L时,鉴别细菌感染的ROC曲线下面积为0.882,灵敏度和特异性分别为85.1%、82.2%,均高于其他4项指标。PCT、CRP、IL-6、TNF-α鉴别革兰阳性菌(≤Cut-off值)和革兰阴性菌(>Cut-off值)感染的Cut-off值分别为1.25 μg/L、79.34 mg/L、27.4 pg/mL、20.5 pg/mL,此时曲线下面积分别为0.671、0.625、0.654、0.619,阳性预测值分别为88.6%、83.1%、88.5%、90.4%,其中PCT的曲线下面积最大,其灵敏度和特异性分别为69.7%和72%,阳性预测值也达到了88.6%。结论PCT可用于细菌感染的早期诊断,也可以初步鉴别革兰阳性菌和革兰阴性菌感染,但诊断性能较弱。
关键词:降钙素原;革兰阳性菌;革兰阴性菌;感染
细菌感染在临床上颇为常见。由于革兰阳性菌和阴性菌在致病机制上不同,两者对抗菌药物的敏感性也不同,因此早期并有效地鉴别病原菌种类对指导抗菌药物用药及病情诊治有重大意义。为了提升临床感染诊断中的速度和效率,各种感染指标和方法不断地被研究出来,我们从中选取了临床常用的降钙素原(procalcitonin,PCT)、C反应蛋白(C reactive protein,CRP)、中性粒细胞表面CD64(CD64)、白细胞介素(interleukin,IL)-6和肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)5项感染指标,通过测定细菌感染者的以上指标,探讨这些感染指标在细菌感染诊断以及革兰阳性菌和阴性菌感染鉴别诊断中的价值。
材料和方法
一、研究对象
随机选取2014年1月至11月上海交通大学医学院附属第三人民医院住院患者204例,男133例,女71例,年龄18~97岁,排除术后、严重烧伤、严重肝硬化和急慢性肝炎、严重肾功能不全、肿瘤晚期等疾病患者[1]。按细菌培养结果分为感染阳性组(根据革兰染色进一步分为革兰阳性菌组和革兰阴性菌组)和阴性对照组。
二、方法
1.标本采集选取体温超过38 ℃、临床怀疑细菌感染的住院患者,在治疗前按标准操作规程一次性采血,一部分进行血培养和一般细菌培养,另一部分分别用于分离血浆和血清,检测PCT、CRP、CD64、IL-6和TNF-α。
2.细菌培养一般细菌培养3 d内检出细菌为阳性,血培养5 d内检出细菌为阳性。细菌鉴定采用ATB全自动细菌鉴定仪(法国生物梅里埃公司)及配套试剂。
3.血浆PCT检测PCT采用UPT上转发光免疫分析仪(北京热景生物技术有限公司)和配套试剂(上转发光免疫分析法)测定,严格按说明书操作,检测限为0.05 μg/L。正确度验证采用方法学比较实验,以ROCHE Cobas E602电化学发光分析仪(罗氏公司)和配套试剂为对照方法(简称罗氏PCT),以UPT上转发光免疫分析仪(北京热景生物技术有限公司)和配套试剂为比较方法(简称热景PCT),得到方法正确度。按规范进行校准和室内质控。选取40例标本,浓度覆盖线性范围,并尽可能分布均匀。每天测定8个标本,5 d内完成[2]。剔除溶血、脂血等可能对方法产生影响的标本。
4.血浆CRP检测CRP采用DELTA全自动CRP检测仪(上海希亚克诊断用品有限公司)和配套试剂(免疫比浊法)测定,检测限为8 mg/L。
5.血浆CD64检测CD64采用FACSVerse流式细胞仪(美国BD公司)和配套试剂测定。仪器CD64阳性表达率检测限为30%。
一直想有个展览馆,这个愿望在2005年第一次实现。于大同市云冈公园,花了五六万元,租了六间房子。好不容易建起来了,但公园整体开发没有跟上,只展览了一个星期便关门了。李建明记得,那个位置在现在公园湖边上。
6.血清IL-6和TNF-α检测IL-6和TNF-α均采用Immulite 1000化学发光免疫分析仪(德国西门子公司)和配套试剂(化学发光法)测定。IL-6检测限为3.4 pg/mL,TNF-α检测限为8.1 pg/mL。
三、统计学方法
采用MedCalc 11.4.2.0软件进行统计分析。3组间的差异采用ANOVA检验。诊断性能评价采用受试者工作特征(receiver operating characteristic,ROC)曲线,计算ROC曲线下面积、诊断灵敏度、诊断特异性、阳性预测值和阴性预测值,以95%可信区间(confidence interval,CI)表示。以P<0.05为差异有统计学意义。
结果
一、细菌培养结果分析
204例患者中细菌培养阳性114例,其中革兰阳性菌25例、革兰阴性菌89例;细菌培养阴性90例。细菌感染者以鲍曼不动杆菌、大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌和金黄色葡萄球菌为主,约占80%,并以革兰阴性菌为主,见表1。培养阳性标本以痰标本和血液标本为主,约占80%,见表2。

表1 细菌培养阳性菌种分类

表2 细菌培养阳性标本类型
二、PCT正确度验证
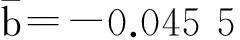
革兰阴性菌组、革兰阳性菌组和阴性对照组之间PCT、CRP、IL-6和TNF-α水平差异均有统计学意义(P<0.01、P<0.05);革兰阴性菌组、革兰阳性菌组CD64明显高于阴性对照组(P<0.01),但革兰阴性菌组和革兰阳性菌组之间差异无统计学意义(P>0.05)。见表3。
四、各感染指标诊断细菌感染及鉴别革兰阴、阳性菌感染的性能比较
5项感染指标均可鉴别是否为细菌感染,但PCT的ROC曲线下面积及特异性最高,说明其诊断性能更好。根据各项感染指标的Cut-off值,可以初步区分是否为细菌感染。见表4、图1。
ROC曲线分析显示,当PCT、CRP、IL-6、TNF-α的Cut-off值分别为1.25 μg/L、79.34 mg/L、27.40 pg/mL、20.50 pg/mL时可得到最佳诊断性能,见表5、图2。PCT的曲线下面积最大,为0.671,灵敏度、特异性和阳性预测值分别为69.7%、72.0%、88.6%。 PCT、CRP、IL-6和TNF-α均能对革兰阳性菌(≤Cut-off值)和革兰阴性菌(>Cut-off值)感染进行区分,但其鉴别诊断性能均较弱。相对而言,PCT鉴别革兰阳性菌和阴性菌感染的性能在4项指标中的最强。

表3 3组之间各感染指标的检测结果比较[均值(5%~95%范围)]
注:与阴性对照组比较,*P<0.01;与革兰阴性菌组比较,#P<0.05
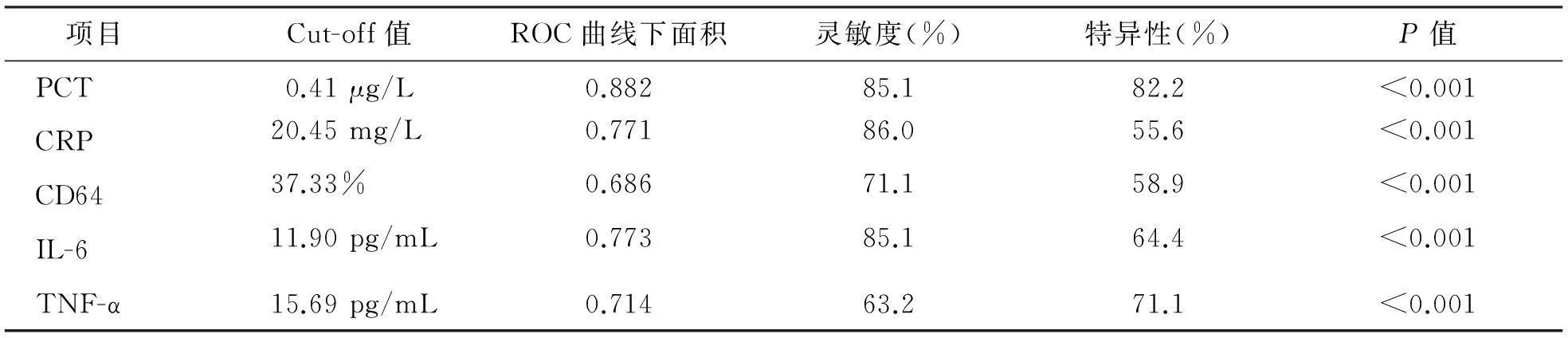
表4 各感染指标在细菌培养阳性组与阴性组的诊断性能比较
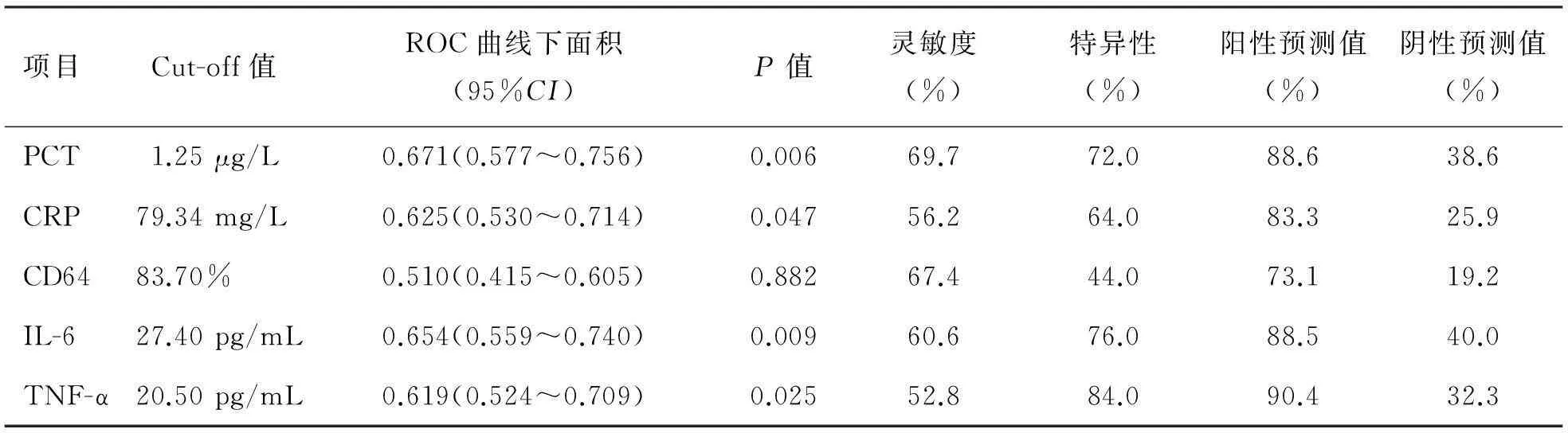
表5 各感染指标在革兰阳性菌组和革兰阴性菌组之间的诊断性能比较
注:>Cut-off值为革兰阴性菌;≤Cut-off值为革兰阳性菌
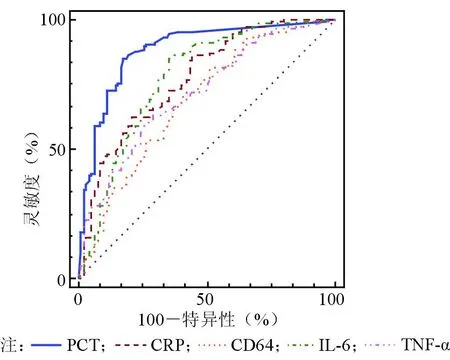
图1 各项感染指标诊断细菌感染的ROC曲线

图2 各项感染指标鉴别诊断革兰阳性菌和
讨论
PCT、CRP、CD64、IL-6、TNF-α是临床常用的排除细菌感染的几个感染标志物[5]。细菌培养是细菌感染诊断的金标准,但由于细菌培养周期较长,因此入院早期,临床医生需借助其他血清/血浆标志物对早期感染进行判断。
CRP是1930年发现的急性时相反应蛋白。血浆中CRP浓度在炎症、创伤、感染、外科手术、恶性肿瘤和风湿性关节炎等疾病时迅速增高,可达正常水平2 000倍。因CRP测定操作简单、快速,临床医生可在短时间内得到结果,可对病情进行早期诊断,所以临床上已广泛应用。但越来越多的研究表明,CRP在局部感染和轻度炎症时也会增高,因此在特异性方面不甚理想。HOSHINA 等[6]的研究结果显示,在细菌性肺炎组中,CRP和PCT水平均明显升高,但PCT的灵敏度、特异性、阳性预测值和阴性预测值明显高于CRP。本研究结果显示,细菌感染时CRP平均水平增高3倍左右,诊断灵敏度为86.0%,但特异性仅为55.6%,在细菌感染的鉴别诊断中价值不大,与文献报道[7]相符。
CD64是IgG的Fc受体之一,具有高亲和力,介导体液免疫和细胞免疫。正常情况下,CD64主要表达于巨噬细胞、单核细胞和树突状细胞表面,中性粒细胞表面几乎不表达。当机体发生炎症时,中性粒细胞表面CD64表达迅速升高。DARYAPEYMA等[7]的研究显示,患者术前与术后24 h CD64有明显差异(P<0.01)。因此,CD64对早期术后感染有较高鉴别诊断价值。本研究结果显示,在细菌感染时,CD64平均水平增高1.5倍左右,诊断灵敏度为71.1%,特异性为58.9%,可对细菌感染性疾病进行早期诊断,但其诊断价值较小,与文献报道[7]有差异。本研究结果还显示CD64对早期革兰阳性菌和阴性菌感染无鉴别诊断价值(P>0.05)。
IL-6是一种多细胞来源的细胞因子,正常人体内含量很低,当发生细菌感染,特别是在革兰阴性菌产生的内毒素诱导时可加速合成和释放,与感染程度呈正相关,其变化也可反映革兰阴性菌脓毒症的情况。IL-6和TNF-α也是参与炎症反应的重要细胞因子,能调节巨噬细胞等的功能,是早期促炎细胞因子,与肿瘤、感染、发热和自身免疫性疾病发生、发展有关。张洲等[8]研究表明,革兰阴性菌和革兰阳性菌感染组IL-1β、IL-6、IL-8、TNF-α阳性率明显高于正常对照组(P<0.01),IL-6诊断敏感性和特异性均高于IL-1β、IL-8、TNF-α,IL-6及TNF-α均是参与细菌血流感染的重要细胞因子。本研究结果显示,在诊断细菌感染时,IL-6平均水平增高2倍左右,诊断灵敏度可达85.1%,但特异性为64.4%,在细菌感染的鉴别诊断中价值不大;而TNF-α平均水平增高2倍左右,诊断灵敏度为63.2%,特异性为71.1%,在细菌性疾病诊断和鉴别诊断有一定价值,但效果不明显,和文献报道[8]不完全一致。
1989年,PASCALE等[9]发现了PCT。PCT是一种无激素活性糖蛋白,为降钙素前肽,受11号染色体Calc-1单基因调控[10]。大量文献证明,正常人体内PCT分泌量极少,但在细菌感染时PCT浓度急剧增高,具有较高地灵敏度和特异性[11]。本研究结果显示,细菌感染时,PCT平均水平增高5倍以上,诊断灵敏度和特异性均高于80%。GIAMARELLOS-BOURBOULIS等[12]和PHUA等[13]通过对115例发热性中性粒细胞减少的感染患者进行研究,结果显示菌血症患者PCT中位数水平为8.23 μg/L,而局部细菌感染患者为0.86 μg/L,二者差异有统计学意义(P<0.05)。他们认为PCT在鉴别细菌感染和非细菌感染性疾病方面较CRP等指标有较高的灵敏度和特异性,可作为理想的标志物。本研究同样也证明,细菌培养阳性组PCT、CRP、IL-6、TNF-α和CD64浓度明显高于阴性对照组(P<0.01),PCT的ROC曲线面积为0.882,诊断特异性和灵敏度分别为85.1%和82.2%,远高于其他4项标志物。KÖKTÜRK等[14]的研究结果显示,细菌感染者PCT水平与非细菌感染者比较有明显差异,诊断敏感性和特异性分别为94.0%和96.5%,高于CRP、IL-1β、TNF-α、IL-8等指标;PCT水平的连续测定有助于早期预测重症细菌感染,监测抗菌药物治疗反应,并能对感染过程中的并发症进行早期监测。本研究结果与KÖKTÜRK等[14]的研究结果基本一致。
本研究结果显示革兰阳性菌组和革兰阴性菌组之间PCT、CRP、IL-6、TNF-α水平差异均有统计学意义(P<0.05),但CD64差异无统计学意义(P>0.05)。ROC曲线分析显示,当PCT、CRP、IL-6和TNF-α的Cut-off值分别为1.25 μg/L、79.34 mg/L、27.40 pg/mL、20.50 pg/mL时可得到最佳诊断性能,ROC曲线下面积分别为0.671、0.625、0.654、0.619,阳性预测值分别为88.6%、83.1%、88.5%、90.4%,其中PCT的曲线下面积最大,其灵敏度和特异性分别为69.7%和72.0%,阳性预测值也达到了88.6%,但阴性预测值较低(38.6%)。综合判断,PCT、CRP、IL-6、TNF-α均能对革兰阳性菌和革兰阴性菌感染进行区分,但鉴别诊断性能均较弱。刘英其[15]的研究结果显示,革兰阴性菌组血浆PCT水平及ROC曲线下面积明显高于革兰阳性菌组,灵敏度和特异性也高于其他炎症指标,可指导临床早期判断细菌性脓毒症,并鉴别革兰阳性菌和革兰阴性菌脓毒症。本研究结果与其结果不相符。虽然2个研究的例数差不多,但刘英其[15]的研究未提供Cut-off值,造成结果不一致的原因可能为诊断性能计算方法和研究对象有差异。
综上所述,PCT、CRP、CD64、IL-6和TNF-α均可作为早期细菌感染的诊断指标之一,在判断革兰阳性菌或革兰阴性菌感染上也有一定参考价值(除CD64外),但鉴别诊断能力相对较弱。本研究中由于革兰阳性菌感染患者数量相对较少,尚有不足之处,研究结果存在一定的局限性,因此有关PCT的鉴别诊断性能还需有更大样本量或多中心的临床研究。
参考文献
[1]降钙素原急诊临床应用专家共识组. 降钙素原(PCT)急诊临床应用的专家共识[J]. 中华急诊医学杂志,2012,21(9):944-951
[2]中华人民共和国国家卫生和计划生育委员会. WS/T 420-2013临床实验室对商品定量试剂盒分析性能的验证[S]. 2013.
[3]OVED K,COHEN A,BOICO O,et al. A novel host-proteome signature for distinguishing between acute bacterial and viral infections[J].PLoS One,2015,10(3):e0120012.
[4]肖政辉,易著文,胥志跃,等. 重症肺炎患儿血浆IL-1、IL-6、IL-8、TNF-α变化及临床意义[J]. 医学临床研究,2007,24(8):1345-1346.
[5]OPPEGAARD O,SKODVIN B,HALSE AK,et al. CD64 as a potential biomarker in septic arthritis[J]. BMC Infect Dis,2013,13:278.
[6]HOSHINA T,NANISHI E,KANNO S,et al. The utility of biomarkers in differentiating bacterial from non-bacterial lower respiratory tract infection in hospitalized children: difference of the diagnostic performance between acute pneumonia and bronchitis[J]. J Infect Chemother,2014,20(10):616-620.
[7]DARYAPEYMA A,PEDERSEN G,LAXDAL E,et al. Neutrophil CD64 as a marker for postoperative infection: a pilot study[J]. Eur J Vasc Endovasc Surg,2009,38(1):100-103.
[8]张洲,徐元宏,李涛,等. 细胞因子IL-1β、IL-6、IL-8、TNF-α在细菌性血流感染中的诊断价值[J]. 安徽医科大学学报,2012,47(9):1079-1081.
[9]GHILLANI PP,MOTTÉ P,TROALEN F,et al. Identification and measurement of calcitonin precursors in serum of patients with malignant diseases[J]. Cancer Res,1989,49(23):6845-6851.
[10]艾红梅,王昌富. 降钙素原在感染性疾病中的临床应用[J]. 中华医院感染学杂志,2012,22(18):4178-4180.
[11]王胜云,陈德昌. 降钙素原和C-反应蛋白与脓毒症患者病情严重程度评分的相关性研究及其对预后的评估价值[J]. 中华危重病急救医学,2015,27(2):97-101.
[12]GIAMARELLOS-BOURBOULIS EJ,GRECKA P,POULAKOU G,et al. Assessment of procalcitonin as a diagnostic marker of underlying infection in patients with febrile neutropenia[J]. Clin Infect Dis,2001,32(12):1718-1725.
[13]PHUA J,NGERNG W,SEE K,et al. Characteristics and outcomes of culture-negative versus culture-positive severe sepsis[J]. Crit Care,2013,17(5):R202
[14]KÖKTÜRK N,KANBAY A,BUKAN N,et al. The value of serum procalcitonin in differential diagnosis of pulmonary embolism and community-acquired pneumonia[J]. Clin Appl Thromb Hemost,2011,17(5): 519-525.
[15]刘英其. 血清降钙素原在不同种类细菌脓毒症的早期鉴别诊断价值[J]. 中华医院感染学杂志,2013,23(3):500-502.
(本文编辑:龚晓霖)

Investigation on the significance of procalcitonin in the differential diagnosis of Gram-positive bacterium and Gram-negative bacterium infectionsZHANGQun1,HUXiaobo2.( 1.DepartmentofClinicalLaboratory,ShanghaiThirdPeople′sHospitalAffiliatedtoShanghaiJiaotongUniversitySchoolofMedicine,Shanghai201900,China; 2.DepartmentofClinicalLaboratory,LonghuaHospital,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai200032,China)
Abstract:ObjectiveThrough the study of the different levels of procalcitonin (PCT), C reactive protein (CRP) and neutrophil CD64(CD64) in plasma and interleukin-6 (IL-6), tumor necrosis factor alpha (TNF-α) in serum for the infections of Gram-positive and Gram-negative bacteria, to discuss the significance of these indices in the differential diagnosis of 2 different bacterium infections. MethodsA total of 204 patients were classified into Gram-positive bacterium group (25 cases), Gram-negative bacterium group (89 cases) and negative control group (90 cases). The levels of PCT, CRP, CD64, IL-6 and TNF-α among the groups were determined. The diagnosis performance of PCT and other indices was evaluated by receiver operating characteristic (ROC) curve. ResultsThe PCT levels in Gram-negative bacterium group, Gram-positive bacterium group and negative control group were 10.01, 5.80 and 1.06 μg/L, and there was statistical significance among the 3 groups(P<0.01). The differences of CRP, IL-6 and TNF-α among the 3 groups had statistical significance (P<0.05). The levels of CD64 in Gram-positive and Gram-negative bacterium groups were obviously higher than that in negative control group (P<0.01), but there was no statistical significance between Gram-positive and Gram-negative bacterium groups (P>0.05). When the cut-off value of PCT was 0.41 μg/L, the area under the ROC curve of PCT for identifying bacterium infection was 0.882. The sensitivity was 85.1%, and the specificity was 82.2%, which were higher than those of the other 4 indices. For the differential diagnosis of Gram-positive and Gram-negative bacterium groups, the cut-off values of PCT, CRP, IL-6 and TNF-α were 1.25 μg/L, 79.34 mg/L, 27.4 pg/mL and 20.5 pg/mL, and the areas under the ROC curves were 0.671, 0.625, 0.654 and 0.619. The positive predictive values were 88.6%, 83.1%, 88.5% and 90.4%. The area under the ROC curve of PCT was biggest. The sensitivity was 69.7%, and the specificity was 72%. The positive predictive value reached 88.6%. ConclusionsPCT can be used to the early diagnosis bacterium infection and the differential diagnosis of Gram-positive bacterium and Gram-negative bacterium infections, but the diagnosis performance is weak.
Key words:Procalcitonin;Gram-positive bacterium;Gram-negative bacterium;Infection
收稿日期:(2015-08-11)
通讯作者:胡晓波,联系电话:021-56691101-6338。
作者简介:张群,男,1987年生,学士,技师,主要从事临床血液体液学检验工作。
基金项目:上海交通大学医学院附属第三人民医院院基金项目(syz2013-010)
中图分类号:
文章编号:1673-8640(2015)11-1113-06R446.1
文献标志码:ADOI:10.3969/j.issn.1673-8640.2015.11.013

