流式细胞术淋巴细胞亚群检测室间质评结果分析
朱宇清, 朱 俊, 徐 翀
(上海市临床检验中心,上海 200126)
流式细胞术淋巴细胞亚群检测室间质评结果分析
朱宇清,朱俊,徐翀
(上海市临床检验中心,上海 200126)
摘要:目的通过分析卫生部临床检验中心、上海市临床检验中心的淋巴细胞亚群室间质量评价(EQA)报告数据以及上海市2家实验室室内质控上报数据,探讨目前国内淋巴细胞亚群检测EQA评判规则的合理性,为进一步提高国内该检测项目的质量水平提供依据。方法对BD流式细胞仪用户组2014年卫生部临床检验中心及2015年上海市临床检验中心第1次淋巴细胞亚群EQA报告数据进行统计,计算各浓度质评样本上报数据的标准差(s)和变异系数(CV),选取上海市2家BD流式细胞仪用户2014年9月至2015年4月期间的淋巴细胞亚群室内质控数据,计算月s和月CV值。并对卫生部临床检验中心第201403和201405号质评样本CD3+CD4+百分比(CD3+CD4+%)项目(靶值分别为42.7%、42.1%)、上海市临床检验中心第1521和1525号质评样本 CD3+CD4+%项目(靶值分别为43.2%,44.13%)的回报数据以及2家上海市临床实验室CD3+CD4+%项目中值水平(月组均值为44.39%~46.80%)室内质控数据进行比较分析。结果2014卫生部临床检验中心5份EQA样本的s为1.10%~1.55%,CV为3.1%~5.5%,平均CV为3.36%;2015年上海市临床检验中心第1次EQA 5份样本的s为0.67%~1.63%,CV为3.51%~8.64%,平均CV为4.83%。在样本CD3+CD4+%值相近的情况下,卫生部临床检验中心2个EQA样本组s(1.55%、1.35%)和组CV(3.6%、3.2%)、上海市临床检验中心2个EQA样本的组s(1.63%、1.55%)和组CV(3.78%、3.51%)均在上海市2家临床实验室室内质控月s(1.06%~2.44%、0.98%~2.03%)和月CV(2.18%~5.28%、2.14%~4.35%)的变化范围之内。结论由于仪器品牌和型号、溶血方法、荧光抗体的品牌和用量、设门方法、实验人员、环境条件等不同因素的影响,EQA数据统计中的s和CV低于室内质控的s和CV不合理。其原因可能是部分参与EQA的实验室在数据上报前对检测结果进行了交流、核对和更改。当前除了加强对实验室的质量教育外,EQA组织者还需要探讨建立更合适的质控规则。
淋巴细胞亚群检测对影响机体免疫系统的多种因素的诊断和监测提供了重要信息。上世纪80年代,研究者发现人类免疫缺陷病毒(human immunodeficiency virus, HIV)因破坏CD4+T细胞而导致获得性免疫缺陷综合征(acquired immunodeficiency syndrome, AIDS),此发现也成为流式细胞术从研究工具转变为常规诊断技术的原动力[1],同时也激励科学家和临床病理学家迅速建立了多种准确、可靠的CD4+T细胞百分比和绝对计数的方法[2],也激发了临床实验室对淋巴细胞亚群检测的室间质量评价(external quality assessment, EQA)需求的增加,促使一系列国际间协作研究组织的诞生。目前,我国卫生部临床检验中心和上海市临床检验中心也已建立了淋巴细胞亚群检测的EQA计划,为提高国内各实验室的检测准确度起到了积极作用。我们对2014年卫生部临床检验中心流式细胞术-淋巴细胞亚群EQA数据以及2015年上海市临床检验中心第1次流式细胞术-淋巴细胞亚群EQA数据进行分析,并结合上海市2家实验室该项目的室内质控数据,探讨国内实验室可能存在的问题或趋势。
材料和方法
由于国内开展CD4+T细胞绝对计数的实验室数量很少,上海市开展绝对计数的实验室仅为5家,故仅对CD4+T细胞百分比(CD3+CD4+%)结果进行探讨。本研究所采用的数据包括2014年卫生部临床检验中心淋巴细胞亚群BD仪器组EQA数据、2015年上海市临床检验中心第1次流式细胞术-淋巴细胞亚群BD仪器组EQA数据以及上海市2家BD仪器组临床实验室自2014年9月至2015年4月的室内质控数据。


结果
一、 2014年卫生部临床检验中心淋巴细胞亚群EQA数据

二、 2015年上海市临床检验中心第1次流式细胞术-淋巴细胞亚群EQA数据
2015年上海市临床检验中心第1次EQA样本编号为1521~1525,共5份。按回报数据计算出BD仪器组的s和CV,见表2。5份EQA样本的s为0.67%~1.63%,CV为3.51%~8.64%,平均CV为4.83%。

表1 2014年卫生部临床检验中心淋巴细胞
三、上海市2家临床实验室室内质控上报数据


表2 2015年上海市临床检验中心第1次
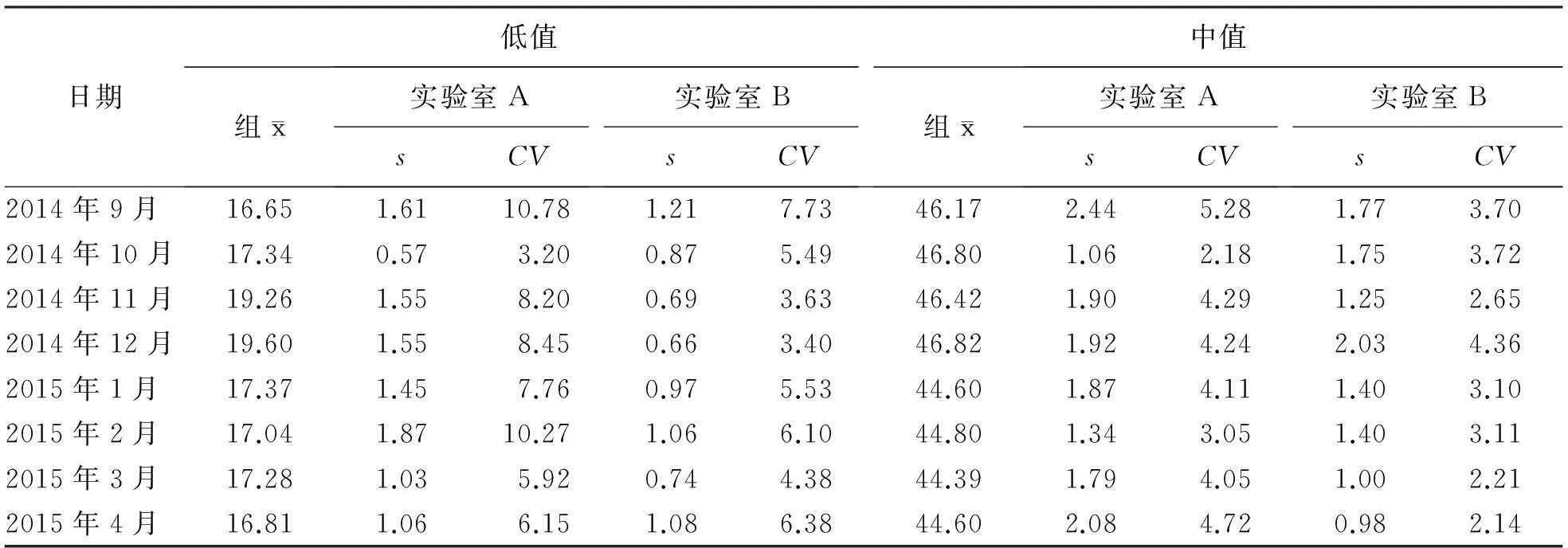
表3 实验室A和B流式细胞术-淋巴细胞亚群室内质控上报数据 (%)
四、数据比较
在样本CD3+CD4+%值相近的情况下,卫生部临床检验中心2个EQA样本和上海市临床检验中心2个EQA样本的组s值和组CV值均在上海市2家临床实验室室内质控月s和月CV的变化范围之内。说明卫生部临床检验中心和上海市临床检验中心EQA的s值和CV值低于一些临床实验室室内质控的月s值和CV值。
讨论
实验室参加EQA活动可以从中获得如下益处:通过EQA可以确认并监测实验室的检测能力,能帮助实验室确定所采用的检测方法的准确度并识别检测方法中存在的问题,教育员工并建立信心,监测员工的能力等。但这些都应基于EQA能够科学、准确地反映所有参加者能力水平的真实情况。
本研究发现流式细胞术-淋巴细胞亚群EQA有部分数据的s和CV低于实验室室内质控的s和CV。流式细胞术检测项目所具有的特殊性决定了其受到的影响因素多于其他常规的生化和免疫的定量检测项目。其影响因素及其对室内质控和EQA的不同作用见表4。
综合上述信息来看,上海市的2家临床实验室按规定进行室内质控样本检测并定期如实上报室内质控数据,操作人员具有较强的质量控制意识;相对而言,国内还有相当一部分实验室并未能做到每次进行淋巴细胞亚群检测工作的同时进行室内质控样本的检测,质控意识较为薄弱。因此,EQA的s和CV低于实验室A和B的室内质控s和CV的原因可能是EQA数据并未能够反映参与EQA的实验室的实际情况。
另外,根据国外相关机构组织的淋巴细胞亚群检测EQA计划的经验来看,参与实验室之间的s和CV的减小也需经历相应的过程。
在稳定化处理的质控血研制成功之前,EQA样本为新鲜全血。根据上世纪90年代初已发表的多中心协作研究报道,对于HIV阴性新鲜全血样本的CD4+T细胞百分比(CD4+%)项目,可接受的CV值是<15%[3-4]。

表4 各种影响因素对室内质控和EQA的作用差异

自1990年起,国际上就已逐步建立了数种流式细胞术检测淋巴细胞亚群的方法。由于临床决断对于淋巴细胞亚群检测结果的依赖性日益提高,针对淋巴细胞亚群计数的国家和国际指南以及EQA计划陆续建立[8]。GLENCROSS等[9]报道在4年里同时采用非洲地区室间质量评价计划(African Regional External Quality Assessment Scheme, AFREQAS)和QASI质评样本共进行了20轮试验。当各参与实验室使用各自常规使用的方法时,对于中值CD4+T细胞的质评样本,AFREQAS实验室间平均CV为7.3%、QASI的CV为8.8%。对于低值CD4+T细胞质评样本,AFREQAS的CV为10.7%、QASI的CV为15.1%。而如果参与实验室采用相同检测方法,如全白细胞设门(panLeuco gating,PLG)检测方法时,则CD4+T细胞中值样本的CV为4.2%,低值样本CV为5.5%。
HULTIN等[10]报道,在美国国家过敏和感染性疾病研究院AIDS部免疫学质量评价(the National Institute of Allergy and Infectious Disease,Division of AIDS Immunology Quality Assessment, NIAID-IQA)能力验证项目的主导下,采用未加稳定剂的新鲜血液,连夜送往4家AIDS多中心队列研究(multicenter AIDS cohort study, MACS)实验室,确保在抽血之后30~36 h检测。所有4家MACS实验室自成立以来都已参加NIAID-IQA能力验证项目,都采用免洗溶血素和CD45设门法。研究结果表明,即使使用未加稳定剂的新鲜血液样本,低值CD4+T细胞样本的CV[中位数(四分位间距)]为3.7%(3.4%~6.6%),中值CD4+T细胞样本的CV[中位数(四分位间距)]为2.4%(1.5%~2.9%),总体CV[中位数(四分位间距)]为2.8%(1.9%~3.7%)。总体CV明显低于SCHNIZLEIN-BICK等[11]的研究结果(9%)。分析这2个研究结果的差异,原因是多方面的,但最重要的是样本制备过程中使用了新的免洗溶血方法及CD45设门方法。自此,MACS下属实验室均统一使用免洗溶血素和CD45设门方法,淋巴细胞亚群检测的CV因此可控制在较小的范围内。NIAID-IQA可接受标准为CD4+%和CD8+T细胞百分比项目室内重复性CV≤3%,室间重复性CV<5%。而国内实验室检测方法远未达到统一,即使参与上海市临床检验中心EQA活动的实验室也未能统一使用免洗溶血素和CD45设门的检测方法。
综上所述,卫生部临床检验中心和上海市临床检验中心的淋巴细胞亚群检测EQA的s和CV低于临床实验室室内质控s和CV的情况存在不合理性,其原因可能是部分参与EQA的实验室在数据上报前对检测结果进行了交流、核对和更改。针对这样的情况,能够采取的较为适合的措施除了加强对实验室的质量教育外,EQA组织者还需要探讨建立更合适的质控规则以及设计防串通方案。比如在EQA样本准备中,配置多于5个浓度水平的样本,对于不同实验室随机选取不同浓度的组合;或将5个不同浓度水平的样本通过软件将编号打乱发放等措施。
参考文献
[1]MANDY FF, BERGERON M, MINKUS T. Evolution of leukocyte immunophenotyping as influenced by the HIV/AIDS pandemic: a short history of the development of gating strategies for CD4+ T-cell enumeration[J]. Cytometry,1997,30(4): 157-165.
[2]BARNETT D, GRANGER V, WHITBY L, et al. Absolute CD4+ T-lymphocyte and CD34+ stem cell counts by single-platform flow cytometry: the way forward [J]. Br J Haematol,1999,106(4): 1059-1062.
[3]ABOULKER JP, AUTRAN B, BELDJORD K, et al. Consistency of routine measurements of CD4+, CD8+ peripheral blood lymphocytes [J]. J Immunol Methods,1992,154(2): 155-161.
[4]GOGUEL AF, CRAINIC K, DUCAILAR A, et al. Interlaboratory quality assessment of lymphocyte phenotyping. Etalonorme 1990-1992 surveys [J]. Biol Cell,1993,78(1-2): 79-84.
[5]BARNETT D, GRANGER V, MAYR P, et al. Evaluation of a novel stable whole blood quality control material for lymphocyte subset analysis: results from the UK NEQAS immune monitoring scheme [J]. Cytometry,1996,26(3): 216-222.
[6]MANDY F, BERGERON M, HOULE G, et al. Impact of the international program for quality assessment and standardization for immunological measures relevant to HIV/AIDS: QASI [J]. Cytometry, 2002,50(2): 111-116.
[7]BAUDOUIN F, SARDA MN, GOGUEL A, et al. Multicenter study of reference stabilized human blood for lymphocyte immunophenotyping quality control in flow cytometry. GEIL [J].Cytometry,1999, 38(3): 127-132.
[8]LEVERING WHBM, VAN WIERINGEN WN, KRAAN J, et al. Flow cytometric lymphocyte subset enumeration: 10 years of external quality assessment in the Benelux countries [J]. Cytometry B Clin Cytom, 2008,74(2): 79-90.
[9]GLENCROSS DK, AGGETT HM, STEVENS WS, et al. African regional external quality assessment for CD4 T-cell enumeration: development, outcomes, and performance of laboratories [J]. Cytometry B Clin Cytom, 2008,74(Suppl 1): S69-S79.
[10]HULTIN LE, CHOW M, JAMIESON BD, et al. Comparison of interlaboratory variation in absolute T-cell counts by single-platform and optimized dual-platform methods [J].Cytometry B Clin Cytom, 2010,78(3): 194-200.
[11]SCHNIZLEIN-BICK CT, SPRITZLER J, WILKENING CL, et al. Evaluation of TruCOUNT absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Site investigators nad the NIAID DAIDS new technolgies evaluation group[J]. Clin Diagn Lab Immunol, 2000,7(3): 336-343.
(本文编辑:龚晓霖)
关键词:淋巴细胞亚群;流式细胞术;室间质量评价;标准差;变异系数
Analysis on the results of external quality assessment of lymphocyte subsets by flow cytometryZHUYuqing,ZHUJun,XUChong.(ShanghaiCenterforClinicalLaboratory,Shanghai200126,China)
Abstract:ObjectiveTo evaluate the assessment rationality scheme of external quality assessment (EQA) for the analysis of lymphocyte subsets by comparing the data from the lymphocyte subset EQA in the National Center for Clinical Laboratory and Shanghai Center for Clinical Laboratory and the submitted data of internal quality control from 2 laboratories in Shanghai, in order to improve the analysis quality of lymphocyte subsets. MethodsThe data of BD flow cytometry group from the National Center for Clinical Laboratory EQA in 2014 and Shanghai Center for Clinical Laboratory EQA for the first time in 2015 were analyzed statistically, and the standard deviation (s) and coefficient of variation (CV) were calculated. The internal quality control data from 2 laboratories in Shanghai were collected from September 2014 to April 2015, and the s and CV were calculated. The CD3+CD4+percentage (CD3+CD4+%) data of Sample 201403 and Sample 201405 (target values: 42.7% and 42.1%) from the National Center for Clinical Laboratory, Sample 1521 and Sample 1525 (target values: 43.2% and 44.13%) from Shanghai Center for Clinical Laboratory and the submitted internal quality control data (monthly mean 44.39%- 46.80%) of 2 laboratories were analyzed comparatively. ResultsThe s and CV of 5 EQA samples from the National Center for Clinical Laboratory in 2014 were 1.10%-1.55% and 3.1%-5.5%, respectively, and the average CV was 3.36%. The s and CV of 5 EQA samples for Shanghai Center for Clinical Laboratory in 2015 were 0.67%-1.63% and 3.51%-8.64%, respectively, and the average CV was 4.83%. In the situation of data with approximate means, the group s (1.55% and 1.35%) and group CV (3.6% and 3.2%) from the National Center for Clinical Laboratory and the group s (1.63% and 1.55%) and group CV (3.78% and 3.51%) from Shanghai Center for Clinical Laboratory were less than those of internal quality control data from 2 laboratories (monthly s1.06%-2.44% and 0.98%-2.03%; monthly CV 2.18%-5.28% and 2.14%-4.35%). ConclusionsIt is irrational that the s and CV of EQA are less than those of internal quality control since different impacts from the factors such as instrument brands and models, lysis techniques, brands and volumes of antibodies, gating strategies, experimenters and environment conditions and so on. One of the possible reasons may be that some laboratories exchanged, checked and sometime modified the EQA data before submitting the data. Other than improving the quality education for the laboratories, the solution can be the establishment of rational marking scheme.
Key words:Lymphocyte subset; Flow cytometry; External quality assessment; Standard deviation; Coefficient of variation
收稿日期:(2015-07-07)
作者简介:朱宇清,女,1967年生,硕士,副主任技师,主要从事免疫学检验及质量控制研究。
基金项目:上海市卫生和计划生育委员会资助项目(2013ZYJB0010)
中图分类号:
文章编号:1673-8640(2015)11-1086-05R446.63
文献标志码:ADOI:10.3969/j.issn.1673-8640.2015.11.007

