内皮细胞膜微粒在慢性阻塞性肺疾病中的表达及意义
张冬 王慧敏 何慧洁等
[摘要] 目的 探讨内皮细胞膜微粒(EMPs)在慢性阻塞性肺疾病(COPD)中的表达及意义。 方法 选取本院2013年10月~2014年7月收治的30例COPD急性加重期患者作为AECOPD组,选取同期的30例COPD稳定期患者作为COPD稳定期组,选取同期的30例无COPD健康志愿者作为对照组,检测其EMPs水平。 结果 COPD稳定期组与对照组的PECAM、VE-cadherin及E-selectin水平显著低于AECOPD组,差异有统计学意义(P<0.01)。对照组的PECAM、VE-cadherin及E-selectin水平显著低于COPD稳定期组,差异有统计学意义(P<0.01)。在30例COPD稳定期患者中,10例有反复急性加重病史。有急性加重病史组的PECAM、VE-cadherin、E-selectin水平显著高于无急性加重病史组,差异有统计学意义(P<0.01)。 结论 COPD急性加重期内皮损伤主要在肺毛细血管,高基线E-selectin、VE-cadherin及PECAM水平预示着COPD患者容易急性加重。EMPs可作为COPD急性加重的易感性标志物。
[关键词] 内皮细胞膜微粒;慢性阻塞性肺疾病;流式细胞术
[中图分类号] R563.9 [文献标识码] A [文章编号] 1674-4721(2015)09(a)-0028-03
[Abstract] Objective To explore the expression and significance of endothelial microparticles (EMPs) in chronic obstructive pulmonary disease (COPD). Methods 30 patients with acute exacerbation of COPD in our hospital from October 2013 to July 2014 were selected as the AECOPD group,30 patients with COPD in the stable period during the same period were selected as the COPD stable stage group,30 cases of healthy volunteers without COPD during the same period were selected as the control group.The level of EMPs was detected. Results The level of PECAM,VE-cadherin,E-selectin in the COPD stable stage group and the control group was lower than that in AECOPD group,with significant difference(P<0.01).The level of PECAM,VE-cadherin,E-selectin in the control group was lower than that in the COPD stable stage group,with significant difference(P<0.01).Among 30 patients with COPD in the stable period,10 cases had a history of repeated exacerbations.The levels of PECAM,VE-cadherin,E-selectin in COPD patients with a history of acute exacerbation was higher than patients without a history of acute exacerbation,with significant difference(P<0.01). Conclusion The endothelium damage of COPD acute exacerbation is mainly in pulmonary capillaries.The high baseline of E-selectin,VE-cadherin and PECAM predicts that patients with COPD is prone to acute exacerbation.EMPs can be used as a susceptibility marker of COPD acute exacerbations.
[Key words] Endothelial microparticles;Chronic obstructive pulmonary disease;Flow cytometry instrument
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是严重危害人类健康的多发病、常见病,临床特征为患者存在持续的气流受限,呈进行性加重,是目前可以治疗和预防的慢性呼吸道疾病。COPD患者如发生急性加重或出现并发症将影响疾病的预后。随着COPD的急性加重,其肺功能加速下降,死亡风险明显增加。COPD管理策略的重要组成部分就是减少COPD急性发作加重[1]。研究显示,血管内皮细胞损伤是COPD重要的病理生理特征。已有研究显示,肺血管的内皮细胞膜损伤是肺泡破坏的基本机制之一[4-6],但是COPD急性加重对血管内皮细胞损伤的机制目前尚不完全清楚。
内皮细胞膜微粒(endothelial microparticles,EMPs)是激活或凋亡内皮细胞表面释放的囊泡,具有内皮细胞的某些抗原特性,血管内皮损伤可通过其数量的增加而反映[2-6]。E-选择素(E-selectin)由炎症刺激活化的内皮细胞迅速诱导而产生,内皮细胞黏附因子(platelet endothelial cell adhesion molecule,PECAM)定位于黏附连接之外,血管内皮细胞钙黏蛋白(VE-cadherin)定位于黏附连接[7-9]。本研究通过检测COPD患者稳定期和急性加重期的EMPs数量,评估其与COPD进展之间的关系。
1 资料与方法
1.1 一般资料
选取本院2013年10月~2014年7月收治的30例COPD急性加重期患者作为AECOPD组,其中男16例,女14例;平均年龄(64.23±6.38)岁。选取同期的30例COPD稳定期患者(近3个月内无急性加重)作为COPD稳定期组,其中男18例,女12例;平均年龄(58.36+7.26)岁。选取同期的30例无COPD健康志愿者作为对照组,其中男15例,女15例;平均年龄(62.76±8.26)岁。所有入选病例均签署知情同意书,同时报本院伦理委员会。所有病例入组前均停止吸烟>2个月。根据肺功能检测诊断COPD患者的气流受限,当吸入支气管舒张剂后FEV1/FVC<70%时,诊断为存在气流受限。排除目前已知能够导致血浆内皮细胞膜微粒升高的受试者,包括高脂血症、心血管疾病、血管炎、慢性肾功能衰竭和代谢性疾病像糖尿病等。急性加重标准:急性加重的诊断依据入组前1个主要症状(呼吸困难、咳痰和痰量,)的增加和1个次要症状(咳嗽、喘息、咽喉肿痛、鼻塞/流涕)至少持续2 d或任意2个主要症状明显加重。反复急性加重病史是指1年有≥2次急性加重。COPD急性加重是指患者需要静脉输注糖皮质激素(如甲泼尼龙琥珀酸钠)治疗和(或)需要静脉输注抗生素治疗的呼吸道症状恶化。
1.2 方法
抽取所有入选者清晨空腹外周血2 ml,采用乙二胺四乙酸二钠抗凝,3000 r/min离心15 min,收集离心液,准确抽取40 μl离心液与10 μl PECAM、VE-cadherin或E-selectin细胞膜微粒充分摇匀,避光37℃孵育20 min,加入5 μl免疫荧光微球,再次避光37℃孵育20 min,然后上流式细胞仪机器检测。
通过流式细胞仪测定去血小板血浆特异性抗原的表达,通过测定PECAM、VE-cadherin、E-selectin、血管性假血友病因子(vWF)表达来识别EMPs的来源。肺泡毛细血管vWF为阴性,肺小动脉和小静脉以及其他器官内皮细胞为阳性。血管性血友病因子阴性的细胞膜微粒提示其来源于肺毛细血管内皮细胞[4-5]。
1.3 统计学处理
采用SPSS 21.0统计学软件对数据进行分析,计量资料以x±s表示,采用t检验,计数资料采用χ2检验,采用One-way-ANOVA统计方法进行多组间比较,以P<0.05为差异有统计学意义。
2 结果
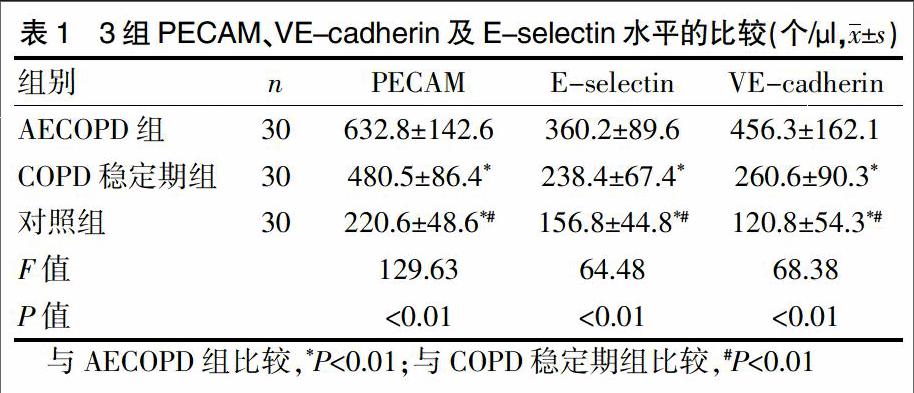
2.1 3组PECAM、VE-cadherin及E-selectin水平的比较
COPD稳定期组与对照组的PECAM、VE-cadherin及E-selectin水平显著低于AECOPD组,差异有统计学意义(P<0.01)。对照组的PECAM、VE-cadherin及E-selectin水平显著低于COPD稳定期组,差异有统计学意义(P<0.01)(表1)。
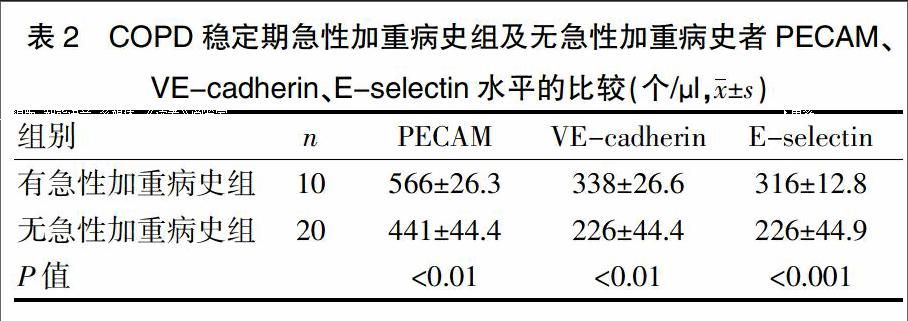
2.2 COPD稳定期有急性加重病史及无急性加重病史者PECAM、VE-cadherin、E-selectin水平的比较
在30例COPD稳定期患者中,10例有反复急性加重病史。有急性加重病史组的PECAM、VE-cadherin、E-selectin水平显著高于无急性加重病史组,差异有统计学意义(P<0.01)(表2)。
3 讨论
持续气流受限导致肺通气功能障碍是COPD的特征性病理生理变化。随着COPD的进展,肺组织弹性逐渐减退,肺泡持续扩大,回缩障碍,导致残气量占肺总量的比例以及残气量增加,肺气肿加重。膨胀肺泡的挤压导致大量肺泡周围的毛细血管受压而退化,进一步导致毛细血管大量减少,肺毛细血管内皮损伤严重。内皮细胞在凋亡或激活过程中能够释放EMPs、当内皮细胞受到刺激时,内皮细胞内的Ca2+会使ATP依赖性氨基磷脂特异性移位酶和磷脂爬行酶活性增加,氨基磷脂转移酶活性降低,导致细胞膜的不对称性消失,细胞膜微粒暴露在细胞膜的表面,细胞膜出芽形成微粒,进而释放EMPs[10-15]。
本研究结果显示,COPD稳定期组与对照组的PECAM、VE-cadherin及E-selectin水平显著低于AECOPD组,差异有统计学意义(P<0.01);对照组的PECAM、VE-cadherin及E-selectin水平显著低于COPD稳定期组,差异有统计学意义(P<0.01);上升的EMPs中绝大部分属于vWF阴性,vWF在肺小动脉和小静脉以及其他器官内皮细胞为阳性。血管性血友病因子阴性的细胞膜微粒提示其来源于肺毛细血管内皮细胞[4-5]。此外,本研究结果还显示,稳定期患者的PECAM、VE-cadherin、E-selectin水平与反复急性加重相关。有反复急性加重病史者的PECAM、VE-cadherin、E-selectin水平显著高于无急性加重病史组,提示COPD急性加重期内皮损伤主要在毛细血管,高基线EMPs含量可能预测COPD急性加重的易感性。EMPs的释放反映了内皮结构的破坏,COPD患者急性加重炎症导致的内皮细胞损伤可通过EMPs含量来评估。
EMPs含量的增加可能预示着COPD患者气流受限严重。COPD患者内皮功能异常现已被证实,因此COPD患者血浆细胞膜微粒水平的增高可能意味着疾病的进展,而内皮损伤的一个重要角色就是血浆细胞膜微粒水平的增高。与COPD患者每年FEV1的下降比较,血浆EMPs水平能够更快、更准确地做出反应。监测EMPs水平变化对于评估COPD进展有非常重要的临床应用价值,可作为药物开发的一个有用指标。
综上所述,COPD患者高水平EMPs预示着肺部炎症的存在,COPD急性加重期内皮损伤明显,主要在毛细血管,高水平EMPs预示着COPD患者发生急性加重的可能性增加。目前COPD急性加重的诊断主要依据患者的临床症状,但是患者的临床特征不具体,不能加以量化,因此可通过测量EMPs水平的变化来评价患者的状况,同时,EMPs水平也可作为评价药物治疗是否有效的有用指标。
[参考文献]
[1] 葛均波,徐永健.内科学[M].8版.北京:人民卫生出版社,2013:21-27.
[2] Koga H,Sugiyama S,Kugiyama K,et al.Elevated levels of VE-cadherin-positive endothelial microparticles in patients with type 2 diabetes mellitus and coronary artery disease[J].J Am Coll Cardiol,2005,45(10):1622-1630.
[3] Zwaal RF,Comfurius P,Bevers EM.Surface exposure of phosphatidylserine in pathological cells[J].Cell Mol Life Sci,2005,62(9):971-988.
[4] Müller AM,Hermanns MI,Skrzynski C,et al.Expression of the endothelial markers PECAM-1,vWf,and CD34 in vivo and in vitro[J].Exp Mol Pathol,2002,72(3):221-229.
[5] Kawanami O,Jin E,Ghazizadeh M,et al.Mosaic-like distribution of endothelial cell antigens in capillaries and juxta-alveolar microvessels in the normal human lung[J].Pathol Int,2000,50(2):136-141.
[6] Takahashi T,Kobayashi S,Fujino N,et al.Annual FEV1 changes and numbers of circulating endothelial microparticles in patients with COPD:a prospective study[J].BMJ Open,2014,4(3):e004571.
[7] Markiewicz M,Richard E,Marks N,et al.Impact of Endothelial Microparticles on Coagulation, Inflammation, and Angiogenesis in Age-Related Vascular Diseases[J].J Aging Res,2013,(2013):734509.
[8] Leryn J,Boyle,Daniel P,et al.Impact of reduced daily physical activity on conduit artery flow-mediated dilation and circulating endothelial microparticles[J].J Appl Physiol (1985),2013,115(10):1519-1525.
[9] Thomashow MA,Shimbo D,Parikh MA,et al.Endothelial microparticles in mild chronic obstructive pulmonary disease and emphysema.The Multi-Ethnic Study of Atherosclerosis Chronic Obstructive Pulmonary Disease Study[J].Am J Respir Crit Care Med,2013,188(1): 60-68.
[10] van Ierssel SH,Hoymans VY,Van Craenenbroeck EM,et al.Endothelial microparticles (EMP) for the assessment of endothelial function:an in vitro and in vivo study on possible interference of plasma lipids[J].PLoS One,2012, 7(2):e31496.
[11] Gordon C,Gudi K,Krause A,et al.Circulating endothelial microparticles as a measure of early lung destruction in cigarette smokers[J].Am J Respir Crit Care Med,2011, 184(2):224–232.
[12] Yun CH,Jung KH,Chu K,et al.Increased circulating endothelial microparticles and carotid atherosclerosis in obstructive sleep apnea[J].J Clin Neurol,2010,6(2):89-98.
[13] Tramontano AF,Lyubarova R,Tsiakos J,et al.Circulating endothelial microparticles in diabetes mellitus[J].Mediators Inflamm,2010,(2010):250476.
[14] Goon PK,Lip GY,Boos CJ,et al.Circulating endothelial cells,endothelial progenitor cells,and endothelial microparticles in cancer[J].Neoplasia,2006,8(2):79-88.
[15] Lacroix R,Sabatier F,Mialhe A,et al.Activation of plasminogen into plasmin at the surface of endothelial microparticles:a mechanism that modulates angiogenic properties of endothelial progenitor cells in vitro[J].Blood,2007,110(7):2432-2439.
(收稿日期:2015-08-12 本文编辑:祁海文)

