龙眼己糖激酶基因的克隆及原核表达
帅 良,李 静,韩冬梅,吴振先(华南农业大学园艺学院,广东广州5064;广东省农业科学院果树研究所,广东广州50640)
龙眼己糖激酶基因的克隆及原核表达
帅良1,李静1,韩冬梅2,吴振先1
(1华南农业大学园艺学院,广东广州510642;2广东省农业科学院果树研究所,广东广州510640)
摘要:【目的】克隆龙眼Dimocarpus longan己糖激酶(Hexokinase,HXK)基因,并对其进行生物信息学分析及原核表达分析.【方法】以龙眼总RNA为模板,采用RT-PCR结合RACE法获得基因全长cDNA序列,构建pET-32a-DlHXK原核表达载体,转化到大肠埃希菌Escherichia coli Rosetta (DE3)中诱导表达.【结果和结论】成功克隆龙眼己糖激酶基因的cDNA全长序列,命名为DlHXK,登录号为KF776906.1.龙眼DlHXK序列全长2 101 bp,包括1个1 488 bp的开放阅读框,预测编码495个氨基酸;进化树和相似性分析发现,该基因与温州蜜柑Citrus unshiu的相似性最高,达到了82%;荧光定量表达分析表明,DlHXK基因随着果实的发育成熟表达量逐渐上升;经IPTG诱导和SDSPAGE检测,所构建的原核表达载体表达的融合蛋白与预期蛋白大小相吻合.由此可见,利用RT-PCR结合RACE方法成功克隆了龙眼的己糖激酶基因,构建原核表达载体,并在大肠埃希菌Rosetta (DE3)中获得高效表达.
关键词:龙眼;己糖激酶;基因克隆;荧光定量PCR;原核表达
帅良,李静,韩冬梅,等.龙眼己糖激酶基因的克隆及原核表达[J].华南农业大学学报,2015,36(3) : 91-97.
优先出版时间:2015-04-14
优先出版网址: http: / /www.cnki.net/kcms/detail/44.1110.s.20150414.0945.019.html
龙眼Dimocarpus longan属于无患子科Sapindaceae龙眼属,是我国南方主要的亚热带果树之一,产区主要分布在广东、广西、福建、海南等省.龙眼果实属于糖直接积累型,果实发育前期只有极少数的淀粉积累,果实发育后期均以可溶性糖的形式贮藏于液泡中[1].龙眼果实成熟时期假种皮中可溶性固形物质量分数可达22%~24%,在龙眼果实的可溶性固形物中,糖是主要组成成分,因此糖组分及其含量在一定程度上已经成为衡量龙眼品种好坏的一个重要指标[2].大多数高等植物通过光合作用在叶片中产生以蔗糖为主的碳水化合物,并通过韧皮部运输分配到不同的库组织中[3].蔗糖进入库器官后,在蔗糖合成酶或转化酶作用下分解为果糖和葡萄糖,果糖和葡萄糖均为己糖[4-6].己糖经过磷酸化后才能进入糖酵解途径,从而为植物的生理活动提供能量和中间代谢产物,因而己糖磷酸化对维持植物的呼吸作用是必不可少的[3].己糖磷酸化的催化酶统称为己糖激酶(Hexokinase,HXK).HXK是一种双功能酶,不仅催化己糖磷酸化,而且在糖信号感受和传达方面有很重要的作用,同时它也是植物体呼吸代谢过程中的关键酶之一[7].因此,探明龙眼果实中HXK的生化性质对其糖信号调控机制和人工调控龙眼果实中糖含量,提高龙眼果实品质有非常重要的意义.
自从Minet等[8]通过功能互补表达文库从拟南芥Arabidopsis thaliana中鉴定出第一个植物HXK基因.目前GenBank已登录多种高等植物HXK基因全长或片段序列.但是关于无患子科的HXK基因至今鲜见报道.本论文以龙眼为研究材料,分离克隆出龙眼果实HXK基因的cDNA全长序列,通过荧光定量技术分析了该基因在果实不同发育期间表达变化情况,并且构建了该基因的原核表达载体,在大肠埃希菌Escherichia coli中进行表达,为深入探索HXK基因在龙眼果实糖代谢过程中所起作用奠定基础.
1 材料与方法
1.1材料
试验材料为石硖龙眼D.longan cv.Shixia,采自广东省农业科学院果树研究所.
参照韩冬梅等[9]对龙眼果实发育进程的研究,分别于花后59、73、87、94、101和110 d摘取不同发育阶段龙眼果实,其中花后110 d为果实成熟采收时期.摘取的果实立即运回实验室,去梗,选取发育正常、外观良好的果实作为试验材料.
采集的假种皮样品于液氮中速冻,置于-80℃超低温冰箱中保存.
1.2龙眼果实总RNA的提取及反转录cDNA的合成
从龙眼各发育阶段假种皮中分别提取总RNA,参照热硼酸方法[10],并稍作改动.使用纯度合格且已经去除基因组DNA的混合果皮和果肉的RNA为模板,采用TaKaRa cDNA合成试剂盒进行反转录,反转录酶为Reverse Transcriptase M-MLV,使用Random Primer引物,严格按照说明书的方法进行cDNA的合成,产物于-40℃条件下保存备用.
1.3龙眼果糖激酶基因(DlHXK)的克隆
根据GenBank上登录的其他物种HXK基因序列,重点关注亚热带果树,经过比对保守区域序列设计特异引物P1和P2.以龙眼cDNA为模板进行片段扩增: 94℃5 min; 94℃45 s,55℃45 s,72℃60 s,共30个循环; 72℃延伸10 min.反应产物于10 g·L-1琼脂糖凝胶电泳检测后,切胶回收,连接至pMD18-T载体,转化大肠埃希菌DH5α,菌液鉴定后送上海生工生物工程公司测序.
根据克隆得到的HXK基因片段序列设计3' RACE的P3、P4引物以及5'RACE的P5引物; 3'端的获得使用TaKaRa 3'-Full RACE Core Set试剂盒,方法按照说明书步骤进行,5'端的获得通过TaKaRa 的Clontech Smart试剂盒,方法按照说明书步骤进行.扩增产物进行回收转化后测序.根据所得的拼接序列,在起始密码子处和终止密码子处设计引物P6 和P7,进行PCR扩增,得到全长序列;引物设计、序列分析使用DNAMAN和Primer 5.本试验中使用的引物序列见表1,引物均委托上海捷瑞生物工程有限公司合成.
1.4生物信息学分析
使用GenBank的BLAST工具进行序列检索;引物设计、序列拼接及分析采用DNAMAN 6.0软件;使用NCBI中的ORF Finder工具寻找基因的开放阅读框(ORF) ;使用ExPASy ProtParam进行蛋白质的理化性质分析;使用TMHMM 2.0进行跨膜结构预测与分析;亚细胞定位使用PSORT;使用ClustalX 1.83软件对氨基酸序列进行多重比对;使用MEGA 5.0软件中的Neighbor-Joining法(邻位相连法,NJ)建树,并进行编辑和测试。

表1 引物序列及用途Tab.1 Sequence of primers and their usage
1.5龙眼果糖激酶基因(DlHXK)的表达
选用DlHXK基因作为内参基因进行龙眼果实RT-PCR分析.20 μL扩增体系: cDNA模板1 μL,上游引物P13和下游引物P14各1 μL,反应SYBR Green MIX 10 μL(Toyobo),ddH2O 7 μL.RT-qPCR反应程序: 50℃2 min; 95℃10 min; 95℃15 s,60℃25 s,72℃35 s,40个循环.PCR扩增程序之后添加溶解程序,得到溶解曲线.内参基因扩增体系使用引物为P11和P12.
1.6原核表达载体的构建
使用Clontech发明的In-Fusion技术,于Clontech网上设计带BamH I (GGATCC)和Sal I (GTCGAC)酶切位点的上下游引物P9和P10,PCR反应体系为20 μL: 10×LA Taq PCR buffer 2 μL,引物P9和P10 各1 μL(10 μmol·L-1),LA-Taq酶0.2 μL,dNTP Mixture 2 μL(2.5 mmol·L-1),cDNA 2 μL,ddH2O补至20 μL.PCR程序: 94℃预变性5 min; 94℃30 s,55℃45 s,72℃1.5 min,30个循环; 72℃延伸10 min.PCR产物使用12 g·L-1琼脂糖凝胶电泳检测.目前条带经切胶、纯化、回收,所获得的片段在In-Fusion HD Enzyme Premix酶的作用下连接到经过BamH I和Sal I双酶切回收后的pET-32a载体上,50℃条件下连接15 min.连接产物转入DH5α感受态细胞,涂板于含氨苄抗性的LB平板上,37℃条件下培养16 h以上,选取重组质粒,通过PCR、双酶切筛选阳性克隆,并对阳性克隆进行正确性验证.将构建成功的表达质粒命名为pET-32a-DlHXK,将测序完全正确的重组质粒转化到大肠埃希菌Rosetta (DE3)感受态细胞中,以验证单克隆的正确性.
1.7重组质粒的诱导表达及SDS-PAGE分析
选取正确的单克隆细胞接种到5 mL含50 μg·mL-1氨苄的LB培养基中,恒温振荡培养12 h,然后将菌液按体积比1∶100的比例加入到5 mL含50 μg·mL-1氨苄的LB培养基中,37℃条件下200 r·min-1振荡培养,期间不断测定D600 nm的变化,至D600 nm为0.5~0.6时,加入IPTG诱导剂进行诱导表达,IPTG的终浓度为0.4 mmol·L-1,于诱导表达后的1、3、5和7 h时离心收集菌体,-20℃条件下保存菌体.使用未经IPTG诱导的菌液作为空白对照,同时以pET-32a质粒转化菌加IPTG和不加IPTG分别诱导3 h后收集菌体作为正对照.
取10 μL菌体沉淀与等体积的上样缓冲液混匀,进行SDS-PAGE胶的电泳检测,凝胶使用R-250染色并脱色至背景清晰.
2 结果与分析
2.1龙眼果实总RNA的提取
从植物组织中提取RNA是进行分子生物学研究的前提,进行下一步试验需要高质量的RNA,而纯度和完整性是评价RNA质量品质的2个关键指标.经过测定,本试验提取的RNA的D260 nm/D280 nm均在1.8~2.0之间,由图1A可以确定所提取RNA纯度较高,可以进行下一步试验.

图1 琼脂糖凝胶电泳结果Fig.1 Results of agarose gel electrophoresis
2.2龙眼果实HXK基因全长的cDNA克隆
根据GenBank已有序列设计特异性引物P1和P2,以提取的总RNA直接反转录获得的cDNA为模板,经过PCR扩增出1条与预期目标片段相符、约1 100 bp的DNA片段,经测序分析为HXK基因片段(图1B).采用3'RACE方法扩增HXK基因的3'端,经2轮扩增后得到长度600 bp的DNA片段(图1C),采用5'RACE方法扩增获得HXK基因的5'端,产物长度约1 000 bp(图1D).最后将所得片段和3'端及5'端进行拼接,得到HXK基因的全长cDNA序列,找到起始密码子ATG,终止密码子TGA,并设计ORF引物进行序列全长准确性验证(图1E).
2.3 DlHXK生物信息学分析
经分析对比发现,获得了HXK基因的全长,命名为DlHXK,其全长cDNA序列约2 101 bp,包括1 个1 488 bp的ORF,1个长249 bp的5'非翻译区序列和1个长361 bp的3'非翻译区,后面带着1个长12 bp的poly(A)尾,编码495个氨基酸.经过Ex-PASy ProtParam推测,该蛋白相对分子质量为53 700,等电点为6.20,说明该蛋白呈酸性,该蛋白含Leu (L)最多,达10.1%,不含Sec (U)和Pyl (O).总的带正电残基(Arg + Lys)为56,负电残基(Asp + Glu)为62,不稳定系数35.02,为稳定蛋白,其脂溶指数为96.15,GRAVY(Grand average of hydropathicity)值为-0.007,属亲水蛋白.经TMHMM2.0推测,该蛋白具有跨膜区域,是膜蛋白.由此可知,DlHXK是跨膜的亲水稳定性蛋白.经过PSORT推测,该蛋白亚细胞定位在叶绿体中的可能性最大.
直接对获得的碱基序列在NCBI网站上BLAST,分析其与其他物种HXK基因的相似性发现,与甜橙Citrus sinensis(AF196966.1)的相似性达到了86%,与向日葵Helianthus annuus(DQ835563.2)的相似性达到了77%,与拟南芥(NM _ 119057.3、AK230265.1、U18754.2、U28214.1、)的相似性达到76%以上.通过对其预测编码的氨基酸序列与其他植物中HXK基因的相似性分析发现,与温州蜜柑Citrus unshiu(AAG28503.1)相似性达到了82%,与甜瓜Cucumis melo(ACJ04704.1)、番茄Lycopersicon esculentum(NP_001234710.1)、枇杷Eriobotrya japonica (ADZ96378.1)、甘蓝Brassica oleracea(AAL60584.1)、烟草Nicotiana tabacum(AAS60195.1)等物种相似性分别达到了79%、71%、74%、73%、74%.与拟南芥(NP_179576.1)的相似性也达到了72%.使用ClustalX 1.83软件将其与其他植物HXK基因编码的氨基酸序列做相似性比对(图2),HXK蛋白含有核心糖结合域(Sugar: LGFTFSFP-Q-L/I),并含有4个肽段(L 1-4)其中L2是不保守的肽段区域,2个磷酸化点(P1,P2),2个结合位点(Con1,Con2)和1个腺苷酸(Adenosine)[11].
进行相似性进化分析后,进一步用MEGA5构建系统进化树(图3).结果显示DlHXK与温州蜜柑AAG28503.1的相似性最高,这与相似性分析结果相一致.
2.4龙眼DlHXK基因的表达分析
运用实时荧光定量PCR技术,以龙眼GAPDH基因为内参,检测龙眼果实发育期间的DlHXK基因的表达情况(图4).结果发现,DlHXK基因的表达量随着果实的发育逐渐增加,在果实成熟采收时期达到表达的最大值,这与果实在盛夏采收时期温、湿度较高导致的生理活动旺盛和呼吸强度较高有一定关系.

图2 DlHXK基因与其他植物中HXK基因编码的氨基酸序列相似性比较Fig.2 The amino acid sequence alignment of DlHXK compared with HXK genes of other species

图3 DlHXK与其他物种HXK基因编码的氨基酸序列进化树分析Fig.3 The phylogenetic tree of amino acid sequences based on DlHXK and other species with HXK gene
2.5原核表达载体构建及鉴定
原核表达载体pET-32a的质粒使用BamH I和Sal I双酶切(图5A)后回收产物片段,使用In-Fusion HD Enzyme Premix与带有In-Fusion连接片段的Dl-HXK基因的ORF片段连接(图5B),获得原核表达载体pET-32a-DlHXK,转化进入DH5α感受态细胞中.挑选阳性克隆菌株进行菌液PCR和测序鉴定.菌液PCR分析发现能获得1条约1 500 bp的条带(图5C),测序结果经比对与DlHXK基因一致,并且未出现碱基突变及移码现象,表明pET-32a-DlHXK原核表达载体构建成功.提取质粒,将pET-32a-DlHXK质粒转入到Rosetta (DE3)中,进行蛋白的诱导表达.
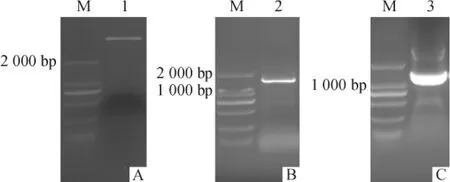
图5 PCR扩增及pET-32a载体双酶切电泳图Fig.5 Agarose gel electrophoresis of PCR amplification and pET-32a digested by BamH I and Sal I
2.6原核表达产物的检测
重组质粒pET-32a-DlHXK转入到Rosetta (DE3)中后,使用0.4 mmol·L-1IPTG诱导重组蛋白表达,结果(图6)表明,在相对分子质量71 700(含His标签18 000)左右位置有目的蛋白的融合表达条带,表达的融合蛋白分子与理论预测值相符,这表明融合蛋白在Rosetta(DE3)中成功表达.未诱导的pET-32a-DlHXK则没有在71 700左右出现条带.不同诱导时间(1、3、5和7 h)结果表明,随着诱导时间的延长融合蛋白的表达量逐渐增大,但5和7 h表达量相差不大,由此推测,经过5 h的诱导,融合蛋白的表达量可以达到最大值.
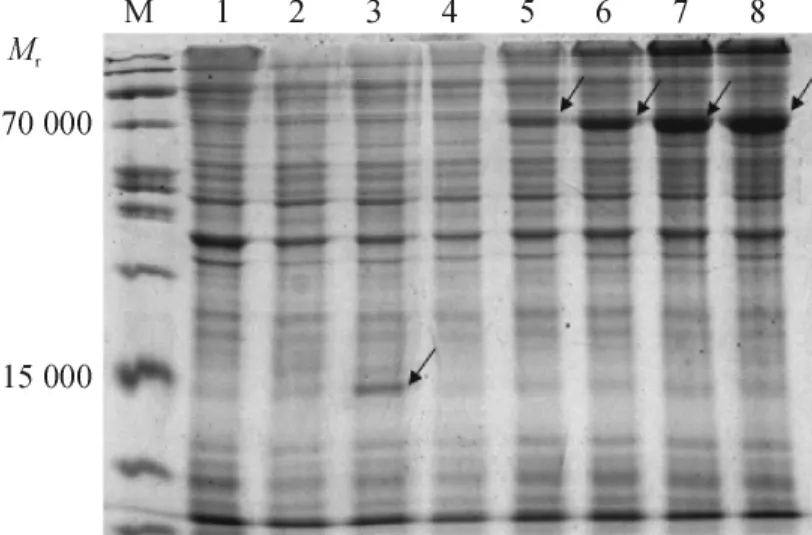
图6 龙眼DlHXK基因重组蛋白在大肠埃希菌中的表达Fig.6 Expression of recombinant pET-32a-DlHXK protein in Rosetta (DE3)
3 讨论
自Minet等[8]利用酵母hxk1、hxk2双突变体,通过功能互补表达文库从拟南芥中鉴定出植物的第1 个HXK基因后,现今已证实HXK基因几乎存在于所有生物体中[12],现在GenBank上已经有多达28种高等植物的HXK基因全长或者片段[7].然而在无患子科的龙眼上至今没有相关报道.本文采用RT-PCR结合RACE技术扩增获得了1个长度为2 101 bp的龙眼HXK全长cDNA序列,该序列包括1个1 488 bp的ORF,249 bp的5'非翻译区序列和361 bp的3'非翻译区,推测该基因编码495个氨基酸.通过NCBI比对和同源进化分析,发现该基因与温州蜜桔(AAG28503.1)的HXK基因具有很高的相似性,达到了82%,可见本文克隆出了龙眼HXK基因.通过对部分植物HXK基因的深入研究发现,植物HXK基因以多基因家族的形式存在[13],且不同物种家族成员数不同,水稻中含有10个HXK家族成员[14],拟南芥中含有6个该家族成员[15],番茄中含有4个该家族成员[11],本研究克隆得到1个HXK基因,推测可能是该基因的器官表达特异、时空表达差异、转录水平和翻译水平差异等原因造成的.
HXK是一种双功能酶,不仅催化己糖磷酸化,并且在糖信号感受和转导方面有很重要的作用[16],同时它也是植物体呼吸代谢过程中的关键酶之一[7].定量分析表明,DlHXK基因的表达量随着龙眼果实的发育逐渐增加,在果实成熟采收时期达到表达的最大值,这与果实在盛夏采收时期,由于温度湿度较高导致的生理活动旺盛和呼吸强度较高有一定关系.马凤凰[17]研究发现,龙眼果实在发育过程中,己糖含量随着果实的发育逐渐增加,与本文己糖激酶表达活性变化表现出较高的一致性.
原核表达系统具有易操作、稳定性好、产量高、经济实惠等优点[18],为研究蛋白功能和基因表达提供了一条高效可行的途径.本研究将DlHXK基因与原核表达载体pET-32a重组构建为pET-32a-Dl-HXK,经IPTG诱导表达后发现DlHXK蛋白能够与载体中的His标签蛋白形成融合蛋白,并且在原核表达体系中成功表达.pET-32a-DlHXK在Rosetta (DE3)中表达,获得了1个相对分子质量为71 700左右的表达蛋白,除去pET-32a上自带的相对分子质量18 000的His标签蛋白,可知DlHXK表达蛋白相对分子质量大约在53 700左右,与前文经过核苷酸推测编码蛋白质大小结果相吻合.因此可知龙眼假种皮中DlHXK基因在大肠埃希菌中能够成功表达,为深入研究己糖激酶的功能奠定了基础,但其可溶性及酶学特性还有待进一步验证.
参考文献:
[1]陈俊伟,张上隆,张良诚.果实中糖的运输、代谢与积累及其调控[J].植物生理与分子生物学学报,2004,30 (1) : 1-10.
[2]胡志群,李建光,王惠聪.不同龙眼品种果实品质和糖酸组分分析[J].果树学报,2006,23(4) : 568-571.
[3]秦巧平,张上隆,徐昌杰.己糖激酶与植物生长发育[J].植物生理学通讯,2003,39(1) : 1-8.
[4]OFFLER C E,PATRICK J W.Cellular pathway and hormonal control of short distance transfer in sink regions[J].Plant Biol,1986(1) : 295-306.
[5]齐红岩,李天来,刘海涛.番茄不同部位中糖含量和相关酶活性的研究[J].园艺学报,2005,32(2) : 239-243.
[6]崔娜,李天来,赵聚勇.外源生长素PCPA对番茄果实蔗糖代谢的影响[J].北方园艺,2008,32(5) : 8-12.
[7]张超,王彦杰,付建新,等.高等植物己糖激酶基因研究进展[J].生物技术通报,2012,(4) : 19-26.
[8]MINET M,DUFOUR M E,LACROUTE F.Complementation of Saccharomyces cerevisiae auxotrophic mutants by Arabidopsis thaliana cDNAs[J].Plant J,1992,2(3) : 417-422.
[9]韩冬梅,郭栋梁,潘学文,等.不同品种龙眼果实发育进程对其生理落果和熟性的影响[J].广东农业科学,2011,38(7) : 59-62.
[10]WAN C Y,WILKINS T A.A modified hot borate method significantly enhances the yield of high-quality RNA from cotton (Gossypium hirsutum L.)[J].Anal Biochem,1994,223(1) : 7-12.
[11]KANDEL-KFIR M,DAMARI-WEISSLER H,GERMAN M A,et al.Two newly identified membrane-associated and plastidic tomato HXKs: Characteristics,predicted structure and intracellular localization[J].Planta,2006,224 (6) : 1341-1352.
[12]CÁRDENAS M L,CORNISH-BOWDEN A,URETA T.E-volution and regulatory role of the hexokinases[J].Biochim Biophys Acta,1998,1401(3) : 242-264.
[13]KARVE R,LAURIA M,VIRNIG A,et al.Evolutionary lineages and functional diversification of plant hexokinases [J].Mol Plant,2010,3(2) : 334-346.
[14]CHO J,RYOO N,KO S,et al.Structure,expression,and functional analysis of the hexokinase gene family in rice (Oryza sativa L.)[J].Planta,2006,224(3) : 598-611.
[15]KARVE A,RAUH B L,XIA X X,et al.Expression and evolutionary features of the hexokinase gene family in Arabidopsis[J].Planta,2008,228(3) : 411-425.
[16]秦巧平,张上隆,徐昌杰.己糖激酶与植物生长发育[J].植物生理学通讯,2003,39(1) : 1-8.
[17]马凤凰.龙眼果实发育过程中糖代谢的研究[D].福州:福建农林大学,2009.
[18]WAUGH D S.Making the most of affinity tags[J].Trends Biotechnol,2005,23(6) : 316-320.
【责任编辑李晓卉】
Cloning and prokaryotic expression of hexokinase gene from Dimocarpus longan
SHUAI Liang1,LI Jing1,HAN Dongmei2,WU Zhenxian1
(1 College of Horticulture,South China Agricultural University,Guangzhou 510642,China;
2 Institute of Fruit Tree Research,Guangdong Academy of Agricultural Sciences,Guangzhou 510640,China)
Abstract:【Objective】Hexokinase gene (named DlHXK) was cloned from longan,Dimocarpus longan cv.Shixia,fruit.The bioinformatics and prokaryotic expression of DlHXK were analyzed.【Method】Total RNA extracted from longan fruit was used as a template.The full length cDNA of the gene was cloned using a combination of RT-PCR and RACE-PCR.Prokaryotic expression vector pET-32a-DlHXK was constructed and transformed into Escherichia coli Rosetta (DE3) to induce expression.【Result and conclusion】The full length cDNA of DlHXK was cloned and its NCBI GeneBank accession number was KF776906.1,which has 2 101 bp nucleotides including a 1 488 bp ORF.It was predicted to encode 495 amino acids.It had the highest homology with the Citrus unshiu (82%) through the NCBI and evolutionary tree analysis.The results of quantitative RT-PCR showed that DlHXK gene expression increased gradually during the longan fruit maturation.Induced by IPTG and determinated by SDS-PAGE,the inducing expressed recombinant protein from prokaryotic expression vector was consistent with the putative protein of DlHXK.Therefore,the full length of DlHXK has been cloned and its prokaryotic expression vector has been constructed successfully.It was induced to express effectively in E.coli Rosetta (DE3).
Key words:Dimocarpus longan; hexokinase; gene cloning; quantitative RT-PCR; prokaryotic expression
基金项目:国家现代农业产业技术体系(荔枝龙眼)资助(CARS-33-14)
作者简介:帅良(1986—),男,博士研究生,E-mail: 107206202@ qq.com;通信作者:吴振先(1971—),男,教授,博士,E-mail: litchi2008@126.com
收稿日期:2014-03-10
文章编号:1001-411X(2015) 03-0091-07
文献标志码:A
中图分类号:S667.2

