亚低温状态下TGF-β 1/Smad2/3通路对大鼠急性脑缺血再灌注损伤的保护作用
亚低温状态下TGF-β1/Smad2/3通路对大鼠急性脑缺血再灌注损伤的保护作用
曾洪艳, 彭宇婕,赵晓姝
(昆明医科大学海源学院,昆明 650000)
摘要:目的探讨TGF-β1/Smad2/3通路在亚低温状态保护大鼠急性脑缺血再灌注损伤的作用。方法选择健康成年雄性SD大鼠30只,制作急性脑缺血再灌注损伤大鼠模型,随机分为假手术组、手术组、亚低温组各10只。亚低温组在亚低温处理1 h后采用干湿法测定各组脑组织含水量,Q-PCR和Western blotting分别检测各组脑组织TGF-β1和p-Smad2/3的基因和蛋白的表达量。结果亚低温组脑组织含水量低于假手术组、手术组(P均<0.05),而TGF-β1和p-Smad2/3的基因和蛋白的表达量高于假手术组、手术组(P均<0.05)。结论 亚低温能减轻急性脑缺血再灌注损伤引起的急性脑水肿,TGF-β1/Smad2/3信号通路参与了此过程。
关键词:急性脑缺血;再灌注损伤;亚低温;转化生长因子β1;Smad2/3;大鼠
doi:10.3969/j.issn.1002-266X.2015.41.009
中图分类号:R651.1
文献标志码:A
文章编号:1002-266X(2015)41-0025-03
收稿日期:(2015-06-04)
急性脑缺血后5~7 min,细胞能量耗尽,引发急性脑水肿,进一步加剧脑缺血,缺血再灌注使一氧化氮和氧自由基的形成增加,加重神经元损伤。急性脑缺血的处理原则是使血管再通,降低脑代谢,控制脑水肿及保护脑细胞等。亚低温可有效降低脑代谢和控制脑水肿。TGF-β1在急性脑缺血损伤中发挥抗氧化、阻止细胞凋亡、调节炎症反应,调节小胶质细胞和星形胶质细胞反应等多种作用。目前,TGF-β1/Smad2/3通路在亚低温保护急性脑缺血再灌注损伤中的作用机制尚不清楚。2014年11月~2015年6月,我们制作动物模型对此问题进行了研究。
1材料与方法
1.1材料健康成年雄性SD大鼠30只,体质量(280±20)g,购自昆明医科大学动物试验中心,饲养在清洁级动物室,以标准饲料喂养和饮水。水合氯醛(动物实验中心提供),兔抗大鼠TGF-β1单克隆抗体和兔抗大鼠抗p-Smad2/3单克隆抗体(美国Cell Signaling),TRIzol Reagent(美国Lifetech),蛋白酶抑制剂(瑞士Roche),PVDF膜(美国Miliipore),电子秤(常州市宏衡电子仪器厂),PCR扩增仪(德国Eppendoff),荧光定量PCR仪和凝胶数码成像分析系统(美国BIO-RAD)。
1.2急性脑缺血再灌注损伤模型制备模型制作采用线栓法,以10%水合氯醛(30 mg/kg)腹腔注射麻醉后,将大鼠以仰卧位固定,行颈部正中切口,分别暴露右侧颈总动脉、颈内动脉和颈外动脉。手术线结扎颈外动脉近心端,在颈内动脉近心端夹一动脉夹,在颈总动脉距分叉3~4 mm处用眼科剪做一斜行的血管切口,将栓线自血管切口处缓缓插入。栓线通过分叉处后,用手术线扎活结将栓线固定于颈内动脉上,松开颈内动脉处的动脉夹,缓慢将栓线沿右侧颈内动脉送至大脑中动脉起始部。起始处深度距颈总动脉血管切口处(20±2)mm,至大脑中动脉遇阻即止,说明栓线已达到大脑中动脉起始部处。阻断大脑中动脉血流,用手术线扎紧固定栓线,结扎固定栓线。缺血1.5 h后,轻轻外拉尼龙线至颈外动脉内恢复再灌注。
1.3动物分组30只SD大鼠完全随机分为3组。假手术组10只除不送入栓线外,其余处理皆同大脑中动脉线栓模型手术。手术组10只急性脑缺血再灌注。亚低温组10只急性脑缺血再灌注后,将冰袋置于大鼠头颈部,调低空调温度,在0.5~1 h内使大鼠体温逐步降低,大鼠肛温控制在32~34 ℃,持续1 h。其余各组以保持大鼠肛温为37 ℃左右。
1.4 脑组织含水量测定亚低温组在亚低温处理1 h后立即断头,各组迅速以冠状切开大脑,去除额极,双侧大脑各取约2 mm厚的脑组织,采用干湿法测定脑含水量,计算公式为:(脑组织湿重-脑组织干重)/湿重×100%。
1.5 脑组织TGF-β1和p-Smad2/3基因和蛋白表达检测各组动物处死后取缺血侧皮层脑组织,置-80 ℃冻存备用。采用Q-PCR检测TGF-β1和p-Smad2/3 mRNA,得到目的基因表达的C(t)值,以2-ΔΔCt进行相对定量分析。采用Western blotting检测TGF-β1和p-Smad2/3蛋白表达,凝胶成像系统扫描图像,所得图片用Image J软件分析灰度值。
1.6统计学方法采用SPSS 17.0统计软件。计量资料以±s表示,多组数据比较采用单因素方差分析。P<0.05为差异有统计学意义。
2结果
2.1各组脑组织含水量假手术组脑组织含水量为(77.26±12.53)%,手术组为(84.73±11.58)%,亚低温组为(81.33±14.63)%。与假手术组相比,手术组和亚低温组脑组织含水量增多(P均<0.05),亚低温组与手术组比较,亚低温组脑组织含水量有所降低(P<0.05)。
2.2各组脑组织TGF-β1和p-Smad2/3基因表达见表1。
表1 各组脑组织TGF-β 1和p-Smad2/3基因表达( ± s)
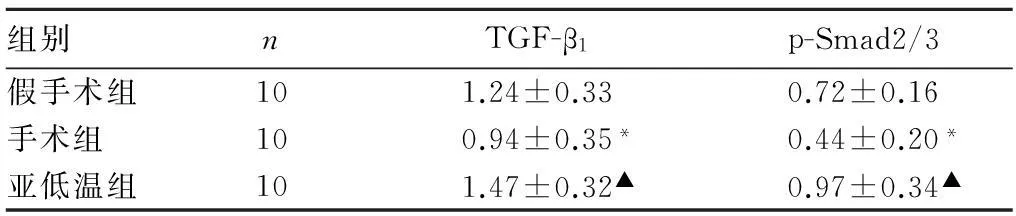
表1 各组脑组织TGF-β 1和p-Smad2/3基因表达( ± s)
组别nTGF-β1p-Smad2/3假手术组101.24±0.330.72±0.16手术组100.94±0.35*0.44±0.20*亚低温组101.47±0.32▲0.97±0.34▲
注:与假手术组比较,*P<0.05;与手术组比较,▲P<0.05。
2.3各组脑组织TGF-β1和p-Smad2/3蛋白表达见表2。
表1 各组脑组织TGF-β 1和p-Smad2/3蛋白表达( ± s)

表1 各组脑组织TGF-β 1和p-Smad2/3蛋白表达( ± s)
组别nTGF-β1p-Smad2/3假手术组10126.57±17.95104.68±14.47手术组1083.69±20.63*74.52±16.34*亚低温组10154.70±23.51▲117.25±20.83▲
注:与假手术组比较,*P<0.05;与手术组比较,▲P<0.05。
3讨论
目前,国际医学界将低温划分为轻度低温(33~35 ℃)、中度低温(28~32 ℃)、深低温(17~27 ℃)、超深低温(16~2 ℃)4种[1],而28~35 ℃轻中度低温定义为亚低温[2]。在低温状态下,由于脑代谢和脑耗氧量的下降使脑组织易于改善和维持氧供需平衡,并减少和抑制多种氧自由基及兴奋性递质的合成与释放,缓解缺血后Na+-K+-ATP酶活性降低而稳定血脑屏障和细胞膜[3,4],亚低温治疗不但可以减轻颅脑损伤后的病理损害,而且可以促进神经功能恢复[5,6]。亚低温对脑保护可能的保护机制包括:减少兴奋性氨基酸释放,抑制钙离子内流,调节钙调蛋白激酶Ⅱ和蛋白激酶C的活性,抑制脑缺血后的炎性反应,抑制其水肿形成,降低氧代谢率,减少自由基的产生,抑制坏死和线粒体释放细胞色素C诱导神经元凋亡。亚低温脑保护作用的机制,可能涉及到损伤级联中的各个事件,从各个环节影响基因、蛋白质的表达以及转录因子的活性。
TGF-β1通过与下游受体型的Smad2/3,使Smad2/3蛋白C端丝氨酸残基磷酸化[7],Smad2/3转位到核内,启动转录因子聚合物LEF/TCF,调控相应基因表达,以此产生广泛的生物学效应[8]。TGF-β1可由中枢神经系统中神经元、星型胶质细胞和小胶质细胞产生,从而参与调节神经细胞的生长、分化和凋亡,在多种生理病理过程中起着重要的作用[9]。在生理情况下,大脑的很多区域都不表达TGF-β1,但是在缺血缺氧的情况下,其表达却大幅上调。缺血区TGF-β1表达上调可能的作用有:促血管生成、减弱脑缺血诱发的血管反应、神经保护和抗凋亡。脑室注射TGF-β1能挽救短暂性全脑缺血后海马CA1区锥体神经元损害,与神经营养因子和纤维生长因子相比,只需1/10 000~1/1 000倍的剂量即可显示很强的神经保护效应[10];对体外培养的海马神经元用TGF-β1进行24 h干预治疗,一氧化氮所致的神经毒性可受到明显抑制[11]。TGF-β1基因敲除的新生小鼠会出现广泛的神经元变性,这些小鼠的神经元在体外培养时存活时间明显缩短[12]。此外,TGF-β1可减轻兴奋性氧基酸、缺氧/缺血损伤以及β-淀粉样肽诱导的神经损伤,从而发挥神经保护作用[13,14]。
本研究发现,亚低温可缓解大鼠急性脑缺血再灌注损伤后急性脑水肿程度,且急性脑缺血再灌注损伤大鼠经亚低温处理后,损伤脑组织中TGF-β1和p-Smad2/3基因和蛋白表达升高,表明亚低温可通过激活TGF-β1/ Smad2/3信号通路,减轻急性脑水肿,对急性脑缺血再灌注损伤脑组织起到保护作用。
参考文献:
[1] Tisherman SA. Hypothermia and injury [J]. Curr Opin Crit Care, 2004,10(11):512-519.
[2] Goossens J, Hachimi-Idrissi S. Combination of therapeutic hypothermia and other neuroprotective strategies after an ischemic cerebral insult[J]. Curr Neuropharmacol, 2014,12(5):399-412.
[3] Gregory S, Tatiana Z, Steven S, et al. Brain oxygenation and metabolism during selective cerebral perfusion in neonates[J]. Eur J Cardiothorac Surg, 2006,29(2):168-174.
[4] Kollmar R, Staykov D, Dörfler A, et al. Hypothermia reduces perihemorrhagic edema after intracerebral hemorrhage[J]. Stroke, 2010,41(8):1684-1689.
[5] Kramer C, Freeman WD, Larson JS, et al. Therapeutic hypothermia for severe traumaticbrain injury: a critically appraised topic [J]. Neurologist, 2012,18(3):173-177.
[6] Dietrich WD, Bramlett HM. The evidence for hypothermia as a neuroprotectant in traumatic brain injury[J]. Neurotherapeutics, 2010,7(1):43-50.
[7] Ten Dijke P, Goumans MJ, Itoh F, et al. Regulation of cell proliferation by Smad proteins[J]. J Cell Physiol, 2002,191(1):1-16.
[8] Caestecker M. The transforming growth factor-beta superfamily of receptors [J]. Cytokine Growth Factor Rev, 2004, 15(1):1-11.
[9] Guan J, Miller OT, Waugh KM, et al. TGF beta-1 and neurological function after hypoxia-ischemia in adult rats[J]. Neuroreport, 2004,15(6):961-964.
[10] Vivien D, Ali C. Transforming growth factor-β signaling in brain disorders[J]. Cytokine Growth Factor Rev, 2006,17(1-2):121-128.
[11] Pera J, Zawadzka M, Kaminska B, et al. Influence of chemical and ischemic preconditioning on cytokine expression after focal brain ischemia[J]. J Neurosci Res, 2004,78(1):132-140.
[12] Brionne TC, Tesseur I, Masliah E, et al. Loss of TGF-β1leads to increased neuronal cell death and microgliosis in mouse brain[J]. Neuron, 2003,40(6):1133-1145.
[13] Boche D, Cunningham C, Gauldie J, et al. Transforming growth factor-beta1- mediated neuroprotection against excitotoxic injury in vivo[J]. J Cereb Blood Flow Metab, 2003,23(10):1174-1182.
[14] BuissonA, Lesne S, Docagne F, et al. Transforming growth factor-beta and ischemic brain injury[J]. Cell Mol Neiirobiol, 2003,23(4-5):539-550.


