不同培养模式下奶牛乳腺上皮细胞形态及酪蛋白表达的差异
詹 康 左晓昕 贡笑笑 陈银银 占今舜 赵国琦(扬州大学动物科学与技术学院,扬州225009)
不同培养模式下奶牛乳腺上皮细胞形态及酪蛋白表达的差异
詹 康 左晓昕 贡笑笑 陈银银 占今舜 赵国琦∗
(扬州大学动物科学与技术学院,扬州225009)
摘 要:本试验旨在研究二维和三维培养模式下奶牛乳腺上皮细胞形态及酪蛋白表达的差异。利用组织块培养细胞来分离奶牛乳腺上皮细胞,利用有限稀释法克隆奶牛乳腺上皮细胞。通过显微镜观察细胞在基质胶中的形态,并用Western blot法检测酪蛋白的诱导表达。结果表明:1)采用组织块培养细胞能够成功分离奶牛乳腺上皮细胞,克隆得到的细胞能稳定传至20代。2)细胞接种12 h之后,二维培养的奶牛乳腺上皮细胞并没有形成明显的细胞簇,细胞间也没有相互连接;三维培养的奶牛乳腺上皮细胞形成明显的细胞簇,在基质胶内的层黏连蛋白作用下形成交织网状结构。培养2 d细胞间交织网状结构逐渐消失,细胞开始形成单个的成细胞簇,使细胞间更加紧密的相连。3)二维培养奶牛乳腺上皮细胞不能诱导表达酪蛋白,但三维培养细胞可诱导表达κ-酪蛋白。综上所述,三维培养奶牛乳腺上皮细胞能够改变细胞的形态和功能,诱导κ-酪蛋白的表达,三维培养的奶牛乳腺上皮细胞可作为奶牛的泌乳机制研究的体外模型。
关键词:奶牛乳腺上皮细胞;三维培养;酪蛋白;体外模型
三维培养已经成为研究细胞基因表达调控和细胞分化一种重要方法[1-5]。因此,三维培养引起国内外研究者的关注。Wang等[6]利用精氨酸来刺激奶牛乳腺上皮细胞研究中发现,精氨酸水平在556 mg/L时κ-酪蛋白mRNA表达量最高。田青等[7]在利用胰岛素对奶牛乳腺上皮细胞酪蛋白合成调节机理的研究中发现,胰岛素能够促进奶牛乳腺上皮细胞中αS1-酪蛋白的基因表达。李文清等[8]用不同培养方法来研究奶牛乳腺上皮细胞中β-酪蛋白mRNA表达,胰岛素样生长因子1 (IGF⁃1)能够促进β-酪蛋白mRNA的表达。但是以上试验进行奶牛乳腺上皮细胞培养都是以二维培养的方式进行,这样会导致细胞去分化,细胞间分子信号转导受阻,许多功能性基因表达受到抑制。同时,以上试验对酪蛋白的表达都是通过对mRNA水平检测进行验证的。在二维培养的模式下,酪蛋白的mRNA可能已经降解了,最终导致酪蛋白mRNA不能翻译成具有功能活性的酪蛋白。原因在于基因转录成mRNA之后有许多内部的mRNA水平的调控,如mRNA的转录速率、mRNA运输、mRNA稳定性、mRNA定位、mRNA翻译调控。因此,通过荧光定量PCR来检测酪蛋白的mRNA丰度显然不能够准确反映酪蛋白真正表达量。本试验旨在通过三维培养奶牛乳腺上皮细胞诱导酪蛋白的表达,并在体外建立奶牛泌乳模型,为研究奶牛泌乳机制提供科学的细胞模型。
1 材料与方法
1.1 材料
1.1.1 试剂
DMEM/F12完全培养基:10%胎牛血清(FBS)、0.05%胰蛋白酶-乙二胺四乙酸(trypsin⁃EDTA)、1×胰岛素-转铁蛋白-硒-乙醇胺(ITS)溶液均为Gibco产品;青霉素、链霉素、4 mmol/L L-谷氨酰胺溶液、氢化可的松、催乳素均为Sigma产品;15 ng/mL表皮生长因子(EGF)为Peprotech产品;β-肌动蛋白(β⁃actin)为Abcam产品(1∶1 000稀释);辣根过氧化物酶(HRP)标记的羊抗鼠免疫球蛋白G(IgG)为Santa cruz抗体;HRP标记的兔抗αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白、κ-酪蛋白多克隆抗体均为Bioss产品;皮克级和飞克级ECL发光液为Thermo产品;EHS基质胶和细胞回收液为BD产品;RIPA裂解液和50×蛋白酶抑制剂为北京普利莱基因技术有限公司产品;二喹啉甲酸(BCA)蛋白质浓度测定试剂盒为碧云天产品。
1.1.2 培养液
原代细胞培养基:DMEM/F12培养基中添加10%FBS、100 U/mL青霉素、100 mg/mL链霉素、4 mmol/L L-谷氨酰胺溶液、15 ng/mL EGF,1 μg/mL氢化可的松,1×ITS。
细胞分化培养基:在原代培养基的基础上加4 mg/mL催乳素和4%的EHS基质胶。
1.2 方法
1.2.1 奶牛乳腺上皮细胞培养
对无乳房炎的荷斯坦奶牛活体采集乳腺组织立即放入含有300 U/mL的青霉素和300 μg/mL链霉素无血清DMEM/F12培养基中,上下颠倒混匀,立即带回实验室。用酒精消毒并撕下封口膜,把组织放入培养皿中,用杜氏磷酸盐缓冲液(DPBS)清洗乳腺组织数次,剔除结缔组织和脂肪组织,将组织移至新培养皿中,用DPBS进行清洗乳腺组织,直至上清液清亮。再用无血清的DMEM/F12培养基反复清洗组织,直至培养基上清液清亮无杂物,并转移到100 mL小烧杯中,并用小剪刀将组织剪成<1 mm3的碎片,静置1~2 min自行沉淀,弃去上清液,继续剪碎,加无血清DMEM/F12培养基悬浮组织块,再转移至15 mL的离心管中清洗,1 000 r/min离心5 min,弃上清。如上反复清洗组织块,直至上清液澄清。加入DMEM/F12完全培养基悬浮组织块,用扩口移液管将组织块转入25 cm2培养瓶(瓶底面积)中,放入CO2培养箱中培养。加入培养基量非常重要,刚开始加入一点点湿润组织即可,切记不能让组织块飘起来。
1.2.2 奶牛乳腺上皮细胞的纯化和克隆
将培养瓶放在倒置显微镜下观察,用记号笔只圈出一个上皮细胞集落,然后用一次性细胞刮刀将其他区域的细胞全部刮掉,并用DPBS清洗培养瓶去除杂细胞。继续培养10 d之后,用胰酶分离消化细胞,完全培养基终止消化,吹打并悬浮细胞,计数,使细胞密度为5个/mL。采用有限稀释法克隆细胞,取200 μL细胞悬液加入96孔板中,培养1周,如果没有集落再培养1周,若仍然没有集落形成,换液再培养1周,这时再没有形成集落,就不会形成集落了。
1.2.3 奶牛乳腺上皮细胞的三维培养
4℃过夜使EHS基质胶慢慢解冻。在铺胶的全过程均在冰上操作。每孔加500 μL的EHS基质胶于6孔板内,左右来回摆动,不要产生气泡,使胶均匀铺开。之后,放置在37℃培养箱孵育20~30 min,使胶成固体。在这个过程中,分离奶牛乳腺上皮细胞,使细胞成单细胞悬液,离心沉淀细胞,并用细胞分化培养基悬浮细胞并计数。接种细胞密度为3×105个/mL。其中3个孔作为二维培养,采用原代培养基,每隔1 d换培养基。
1.2.4 蛋白质提取
吸弃培养基,用预冷的PBS清洗细胞3次。每35 mm2的培养皿加2 mL的细胞回收液,刮掉细胞胶层转移到预冷的50 mL离心管中,放冰上再用预冷的2~4 mL的细胞回收液冲洗皿底,在转移到预冷的50 mL离心管中颠倒离心管几次,放冰上1 h,直到胶全部溶解。在此过程中不停来回摇动离心管,加速胶溶解。4℃250×g离心5 min使细胞沉淀,弃上清。预冷的PBS轻轻悬浮细胞,4℃250×g离心5 min,弃上清,重复2次。RIPA裂解液和50×蛋白酶抑制剂以50∶1浓度配制成100 μL加入到1.5 mL指形管中裂解细胞30 min,每隔5 min漩涡振荡细胞,使细胞充分释放出蛋白质,4℃12 000×g离心10 min,吸取上清,即为所提取的蛋白质,用BCA法测蛋白质浓度。
1.2.5 Western blot法检测酪蛋白表达
用含1×蛋白酶抑制剂的RIPA裂解液裂解细胞,分别从三维和二维培养的细胞提取总蛋白。每个孔加入等量的蛋白质进行12%的十二烷基四乙酸二钠-聚丙烯酰胺凝胶电泳(SDS⁃PAGE),然后将蛋白质转到硝酸纤维素膜上。5%脱脂奶粉室温封闭2 h,之后吐温Tris⁃HCl缓冲盐溶液(TBST)清洗1次。加入HRP标记的兔抗αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白、κ-酪蛋白多克隆抗体和β⁃actin一抗孵育过夜。TBST清洗6次,每次5 min。对于β⁃actin加入HRP标记的羊抗鼠二抗孵育2 h,TBST清洗6次,每次5 min。ECL发光液1∶1混合拍照。
2 结 果
2.1 奶牛乳腺上皮细胞培养
由图1可知,12 h内组织块即可贴壁,并分裂出少量的成纤维细胞。培养6 d成纤维细胞迅速增殖并处于对数生长期,同时辐射出少量的乳腺上皮细胞。由图2可知,培养8~9 d乳腺上皮细胞增殖明显,且活力较强。

图1 组织块种植大约12 h后发生贴壁,并有少量成纤维细胞分裂Fig.1 The tissue mass started the adherence and a few fibroblast cells divided after 12 h of inoculation(40×)
2.2 奶牛乳腺上皮细胞的纯化和克隆
本试验利用多种纯化方法可获得奶牛乳腺上皮细胞系。刮除法、相差贴壁、相差消化法等3种方法联合使用可获得较纯的奶牛乳腺上皮细胞。乳腺组织块刚贴壁时首先从周围辐射出的是成纤维细胞,而且增殖旺盛。之后奶牛乳腺上皮细胞从组织块周围辐射出少量的细胞,但是成纤维细胞占绝大多数。这时可以采用刮除法把大量的成纤维细胞刮掉,然后根据成纤维细胞和奶牛乳腺上皮细胞贴壁时间和对胰酶的敏感度不同,再进一步纯化上皮细胞。经过2次以上操作,培养瓶中90%是奶牛乳腺上皮细胞。由图3可知,利用96孔板有限稀释法克隆细胞,已成功获得克隆的乳腺上皮细胞株。乳腺上皮细胞形态呈现不规则形状,细胞与细胞之间紧密相连,呈单层“铺石路”生长。克隆得到的细胞能稳定传至20代。
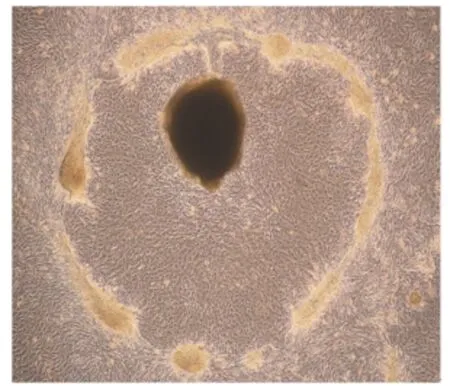
图2 培养8~9 d乳腺上皮细胞增殖明显Fig.2 At 8 to 9 days of cultivation,bovine mammary epithelial cells proliferated obviously(40×)
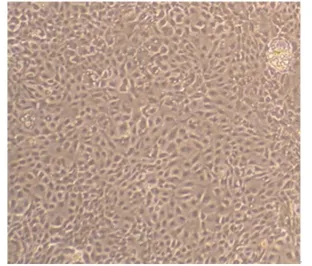
图3 利用96孔板有限稀释法获得的单克隆奶牛乳腺上皮细胞系Fig.3 Monoclonal bovine mammary epithelial cell lines obtained using limiting dilution method(40×)
2.3 二维和三维培养模式下奶牛乳腺上皮细胞形态
细胞接种12 h之后,二维培养的奶牛乳腺上皮细胞并没有形成明显的细胞簇,细胞间也没有相互连接;三维培养的奶牛乳腺上皮细胞在基质胶内的层黏连蛋白作用下形成交织网状结构,细胞之间开始聚集并形成细胞簇(图4)。这有利于细胞之间相互作用打开信号分子的转导,使细胞产生分化培养。培养2 d开始细胞间交织网状结构逐渐消失,细胞开始形成单个的成细胞簇,使细胞间更加紧密的相连(图5)。进一步培养细胞,细胞在基质胶中开始形成腺泡内腔,细胞腔内的细胞开始凋亡。结果提示,通过三维培养的奶牛乳腺上皮细胞能够促使细胞间紧密连接,打开分子信号转导通路,有利于细胞的分化培养和基因的转录。
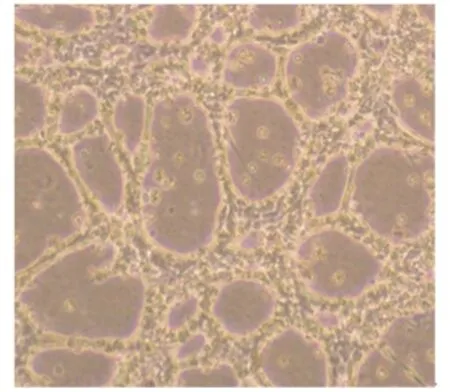
图4 三维培养12 h之后,奶牛乳腺上皮细胞开始聚集并形成交织网状Fig.4 Bovine mammary epithelial cells began to aggregate and form interwoven mesh after12 h of 3D cultivation(100×)
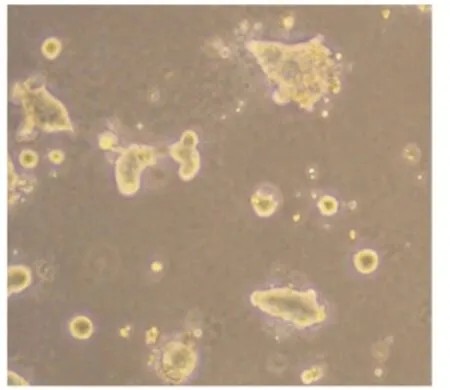
图5 培养2 d开始细胞间交织网状结构逐渐消失,细胞开始形成单个的细胞团Fig.5 At 2 days of cultivation,the mesh began to disappear and the cells began to form single cell mass(100×)
2.4 奶牛乳腺上皮细胞酪蛋白诱导表达
由图6可知,通过Western blot法检测奶牛乳腺上皮细胞内αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白、κ-酪蛋白表达情况,在二维培养的模式下均不表达;在三维培养模式下,αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白均不表达,但是能够检测到κ-酪蛋白的表达。以上数据提示奶牛乳腺上皮细胞κ-酪蛋白的表达必须在三维培养的模式下才可以实现。

图6 三维培养奶牛乳腺上皮细胞诱导酪蛋白的表达Fig.6 The induced expression of casein of 3D cultured bovine mammary epithelial cells
3 讨 论
3.1 奶牛乳腺上皮细胞培养
利用组织块培养原代细胞是最简单方便的方法。由于该方法未经任何酶的处理,因此能够获得活性很高且增殖旺盛的细胞,这为建立永生化细胞系奠定基础。国外研究人员通过离心泌乳奶牛的乳汁来培养原代乳腺上皮细胞,这种方法要求采样时必须无菌,离心过的细胞活力强。王秀美等[9]通过不同时间来诱导乳腺上皮细胞酪蛋白基因的表达,结果表明酪蛋白的表达量在培养5 d是最佳的。本试验采取组织块细胞培养法,并成功获得奶牛乳腺上皮细胞株。组织块细胞培养首先确保组织不能被污染。采样结束后,应立即带回实验室处理,并用酒精喷洒离心管周围。将组织剪碎<1 mm3的组织块,然后用吸管将组织块转移到新的培养瓶。在这过程先用培养基湿润移液管,否则组织块会黏在管的内壁,将影响试验的进程。组织块接种到培养瓶的数量也是非常重要,过少导致细胞难以汇合,过多会导致培养基营养成分相对降低,最重要的是会使大量组织块飘起。本试验是每隔1 cm大约1个组织块,并取得良好的效果。组织块接种到培养瓶之后,培养基的用量是原代细胞培养成功的关键。刚开始培养基的用量控制非常少,湿润组织即可,千万不可使组织的上层表面干涸。24 h之后可以再加1 mL DMEM/F12完全培养基,注意不能使组织块漂起,48 h后可再加1 mL DMEM/F12完全培养基。原代培养过程中,要每天观察细胞的培养状况,如有污染应立即丢弃。从培养箱拿出培养瓶的时候,要小心操作,禁止晃动培养瓶。因为,只要轻微的晃动组织块就可能会漂起来。组织块培养过程中,霉菌和白色链球菌是最为常见污染源。本试验还发现,采集乳腺组织时,先要摸下奶牛的乳房区,如果发现硬区,很可能奶牛患有隐性乳房炎。一旦采集患有乳房炎的组织,经试验验证,培养2 d培养基表面出现大量的白色链球菌污染。如果产生上述污染物,根本无法清除,应立即丢弃以免污染整个细胞室。
3.2 奶牛乳腺上皮细胞的纯化和克隆
组织块细胞培养法最大的缺点是杂细胞太多,上皮细胞与成纤维细胞夹杂生长。本实验室采用刮除法和相差消化、相差贴壁法来纯化乳腺上皮细胞[10-11]。首先用细胞刮刀将大部分成纤维细胞刮掉,用DPBS清洗以去除杂细胞。这时,在上皮细胞生长距离很近的成纤维细胞用刮除法是不可行,会导致上皮细胞也会被刮掉。采用0.05%胰酶来消化30 s,敲打皿壁,放入培养箱温育1 min。在纯化的过程中,胰蛋白酶的浓度和消化时间非常重要。由于,成纤维细胞和上皮细胞对胰蛋白酶的敏感性不同,0.05%胰酶就可以轻松把成纤维细胞消化下来,而乳腺上皮细胞只有一小部分皱缩发亮,但是不会脱落,仍继续贴壁。消化时间是本实验室摸索出来的最佳时间,能够最低限度减少上皮细胞的伤害。如果在纯化过程中还有杂细胞生长,可采用相差贴壁法。这是由于成纤维细胞比上皮细胞贴壁快。放入培养箱中20 min,成纤维基本上贴壁,上皮细胞没有贴壁或贴壁不牢,轻轻晃动培养瓶将培养基移入另一培养瓶中,此时培养瓶基本上是乳腺上皮细胞。我们也发现培养基表面也漂浮着少量的死细胞,这可能是胰酶二次消化和吹打过程造成的,只要上皮细胞贴壁之后立即吸弃死细胞,基本对细胞无影响。然而,单克隆细胞才是我们做试验的理想细胞。许多国外的克隆细胞采用克隆环方法,但是本试验未获得成功,可能是由于技术上不够娴熟,有待进一步研究。利用有限稀释法克隆细胞,最关键的是避免孔与孔之间的污染。每孔里面大约1个细胞,培养2 d观察细胞生长情况,直至细胞密度达到50%即可转入到24孔板中,进一步扩大培养。
3.3 二维和三维培养模式下奶牛乳腺上皮细胞形态
三维培养是通过基质胶与细胞在体外进行共培养,使细胞能够在基质胶空间下产生细胞迁移、生长,并产生三维的培养基、细胞、基质胶复合物。在二维和三维培养模式下奶牛乳腺上皮细胞最大的不同点在于培养的细胞形态不一样。三维培养的细胞在基质胶内层黏连蛋白、钙黏蛋白作用下相互紧密连接,形成相互联系的交织网状结构。同时产生高密度的类腺泡的结构[1,5]。三维培养的奶牛乳腺上皮细胞在12 h之后细胞间就开始大量聚集。这时奶牛乳腺上皮细胞的形态发生改变已经引起细胞的基因表达[12]。这是由于基质胶含有大量的层黏连蛋白、钙黏蛋白、整合蛋白,这些蛋白质通过与细胞膜受体相结合,使细胞与细胞紧密结合,细胞表面的这些受体会聚集黏连蛋白,使细胞大量聚集并形成细胞簇。国外的研究表明,三维培养模式下的细胞会出现4种不同的形态,分别是圆形、块状形、葡萄样形、星形[2]。奶牛乳腺上皮细胞的形态的改变为酪蛋白分泌提供了独特天然的环境。然而,二维培养模式下的奶牛乳腺上皮细胞形态是“铺路石”、多角形形状。由于,胞外缺乏基质胶内层黏连蛋白、钙黏蛋白、整合蛋白的作用,细胞间不会紧密相连,从而细胞间就不会产生细胞分子信号转导。然而,三维培养的奶牛乳腺上皮细胞能够很好地模拟奶牛乳腺内泌乳坏境,符合奶牛泌乳的生理特点。本试验研究表明,三维培养的奶牛乳腺上皮细胞在形态上接近于奶牛体内乳腺细胞的生理特征,很好地模拟了体内奶牛乳腺泌乳生理环境。
3.4 奶牛乳腺上皮细胞酪蛋白诱导表达
奶牛乳腺上皮细胞在二维培养模式下,最大的缺陷是细胞培养去分化,导致许多功能性的基因不能够表达[13-14]。目前,国内进行奶牛乳腺上皮细胞培养均以二维培养模式进行,同时检测αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白、κ-酪蛋白都是通过荧光定量PCR检测mRNA水平。然而,通过检测αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白、κ-酪蛋白的mRNA水平来证明奶牛乳腺上皮细胞酪蛋白的表达量并不科学。因为,奶牛乳腺上皮细胞酪蛋白作为营养物质,而且是分泌型蛋白质,就要求检测必须做到蛋白质水平。同时,转录成的酪蛋白mRNA不一定能够翻译成相应的蛋白质。这是由于基因转录成mRNA之后有许多内部的mRNA水平的调控,如mRNA的转录速率、mR⁃NA运输、mRNA稳定性、mRNA定位、mRNA翻译调控。在这几个mRNA水平的调控中,对于酪蛋白调控而言,mRNA稳定性对酪蛋白是否能够正常表达产生至关重要作用[15]。本试验在三维模式培养的奶牛乳腺上皮细胞内αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白均不表达,然而κ-酪蛋白在三维培养的诱导下能够表达,但是表达量比较低。在二维培养的模式下的αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白、κ-酪蛋白均不表达。这种差异可能和自身的基因结构有关系αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白基因组结构含有较多的内含子,这样mRNA剪切过程中极易造成mRNA降解。虽然,分化培养基含有催乳素刺激奶牛乳腺上皮细胞能够使酪蛋白的mRNA水平显著增加,但是大部分酪蛋白的翻译合成并不是酪蛋白的转录速率所控制而是酪蛋白mRNA半衰期所引起[15]。然而,κ-酪蛋白含有较少的内含子,这为mRNA成功翻译为κ-酪蛋白创造前提。同时,三维培养奶牛乳腺上皮细胞为酪蛋白的表达提供良好的环境。细胞表面的这些受体与胞外黏连蛋白结合,会改变细胞膜的受体结构,将细胞膜分子信号转导到细胞内,引起胞内一系列的蛋白质的磷酸化。在细胞间的层黏连蛋白,直接和肌动蛋白或细胞骨架蛋白相互作用,使细胞在基质胶内发生移动,促使细胞间相互传递分子信号[16-18],实现了细胞在基质中迁移聚集。细胞间的分子信号转导进一步激活胞内蛋白质的磷酸化。以上数据提示,奶牛乳腺上皮细胞能够正常表达酪蛋白与是否为三维培养、mRNA的稳定性,同时还与催乳素、细胞传代数相关。综上所述,三维培养奶牛乳腺上皮细胞对κ-酪蛋白表达至关重要。
4 结 论
本试验利用组织块细胞培养法成功分离了奶牛乳腺上皮细胞,且细胞活力较强,并能够进行继续传代。三维培养奶牛乳腺上皮细胞能够改变细胞的形态和功能,诱导κ-酪蛋白的表达,三维培养的奶牛乳腺上皮细胞可作为奶牛的泌乳机制研究的体外模型。
参考文献:
[1] DEBNATH J,MUTHUSWAMY S K,BRUGGE J S. Morphogenesis and oncogenesis of MCF⁃10A mam⁃mary epithelial acini grown in three⁃dimensional base⁃ment membrane cultures[J].Methods,2003,30(3):256-268.
[2] KENNY P A,LEE G Y,MYERS C A,et al.The mor⁃phologies of breast cancer cell lines in three⁃dimen⁃sional assays correlate with their profiles of gene ex⁃pression[J].Molecular Oncology,2007,1(1):84-96.
[3] ITOH M,NELSON C M,MYERS C A,et al.Rap1 in⁃tegrates tissue polarity,lumen formation,and tumori⁃genic potential in human breast epithelial cells[J].Cancer Research,2007,67(10):4759-4766.
[4] FRIEDLAND J C,LAKINS J N,KAZANIETZ M G,et al.α6β4 integrin activates Rac⁃dependent p21⁃acti⁃vated kinase 1 to drive NF⁃κB⁃dependent resistance to apoptosis in 3D mammary acini[J].Journal of Cell Science,2007,120(20):3700-3712.
[5] KOZLOWSKI M,GAJEWSKA M,MAJEWSKA A,et al.Differences in growth and transcriptomic profile of bovine mammary epithelial monolayer and three⁃di⁃mensional cell cultures[J].Journal of Physiology and Pharmacology,2009,60:5-14.
[6] WANG M Z,XU B L,WANG H R,et al.Effects of arginine concentration on the in vitro expression of ca⁃sein and mTOR pathway related genes in mammary epithelial cells from dairy cattle[J].PLoS One,2014,9(5):e95985.
[7] 田青,季昀,庞学燕,等.胰岛素对奶牛乳腺上皮细胞酪蛋白合成调节机理的研究[J].动物营养学报,2013,25(3):550-560.
[8] 李文清,王加启,南雪梅,等.奶牛乳腺上皮细胞的不同培养方法比较及激素和细胞因子对β-酪蛋白mRNA表达的诱导[J].动物营养学报,2014,26 (9):2607-2614.
[9] 王秀美,侯先志,敖长金,等.三维模式下培养时间对奶牛乳腺上皮细胞酪蛋白基因表达的影响[J].动物营养学报,2013,25(7):1526-1533.
[10] PAYE J M D,AKERS R M,HUCKLE W R,et al.Autocrine production of insulin⁃like growth factor⁃Ⅰ(IGF⁃Ⅰ)affects paracellular transport across epitheli⁃al cells in vitro[J].Cell Communication and Adhe⁃sion,2007,14(2/3):85-98.
[11] 佟慧丽,尹德云,李庆章,等.奶山羊乳腺上皮细胞系的建立[J].东北农业大学学报,2008,39(8):104-109.
[12] MUTHUSWAMY S K,LI D M,LELIEVRE S,et al.ErbB2,but not ErbB1,reinitiates proliferation and in⁃duces luminal repopulation in epithelial acini[J].Na⁃ture Cell Biology,2001,3(9):785-792.
[13] BISSELL M J,WEAVER V M,LELIEVRE S A,et al.Tissue structure,nuclear organization,and gene ex⁃pression in normal and malignant breast[J].Cancer Research,1999,59(7):1757-1764.
[14] BISSELL M J,RIZKI A,MIAN I S.Tissue architec⁃ture:the ultimate regulator of breast epithelial function [J].Current Opinion in Cell Biology,2003,15(6):753-762.
[15] GUYETTE W A,MATUSIK R J,ROSEN J M.Pro⁃lactin⁃mediated transcriptional and post⁃transcriptional control of casein gene expression[J].Cell,1979,17(4):1013-1023.
[16] DI BARI M G,GINSBURG E,PLANT J,et al.Msx2 induces epithelial⁃mesenchymal transition in mouse mammary epithelial cells through upregulation of Crip⁃to⁃1[J].Journal of Cellular Physiology,2009,219 (3):659-666.
[17] KAMETANI Y,TAKEICHI M.Basal⁃to⁃apical cad⁃herin flow at cell junctions[J].Nature Cell Biology,2006,9(1):92-98.
[18] YAMADA S,NELSON W J.Localized zones of Rho and Rac activities drive initiation and expansion of ep⁃ithelial cell⁃cell adhesion[J].The Journal of Cell Biol⁃ogy,2007,178(3):517-527.
Differences of Morphology and Casein Expression of Bovine Mammary Epithelial Cells under Different Culture Models
ZHAN Kang ZUO Xiaoxin GONG Xiaoxiao CHEN Yinyin ZHAN Jinshun ZHAO Guoqi
∗
(责任编辑 王智航)
(College of Animal Science and Technology,Yangzhou University,Yangzhou 225009,China)
Abstract:This research aimed to study the differences of morphology and casein expression of bovine mamma⁃ry epithelial cells under two⁃and three⁃dimensional culture models.Bovine mammary epithelial cells were isola⁃ted by tissue mass culture,and were cloned by limiting dilution mehod.Morphology was observed in matrigel using microscopy.The induced casein expression was determined by Western blot method.The results showed as follows:1)Bovine mammary epithelial cells could be successfully isolated by tissue mass culture,and the clones were passaged 20 generations stably.2)After 12 h cultivation,the two⁃dimensional cultured bovine mammary epithelial cells neither formed apparent clusters nor produced interconnection,however,the three⁃di⁃mensional cultured cells formed apparent clusters and produced interconnection under the action of laminin in matrigel.The bovine mammary epithelial cells in matrigel started to form network structure and produce inter⁃connection.After 2 d of cultivation,the network structure among cells began to disappear,and single clusters started to appear,which made the connection among cells tighter.3)The bovine mammary epithelial cells in two⁃dimensional culture did not express casein,but the expression of κ⁃casein could be induced in three⁃dimen⁃sional culture.It is concluded that the bovine mammary epithelial cells are able to change the morphology and function by three⁃dimensional culture,and can induce the κ⁃casein expression,can be used as an in vitro model for cows’lactating mechanism research.[Chinese Journal of Animal Nutrition,2015,27(7):2241⁃2247]
Key words:bovine mammary epithelial cells;three⁃dimensional culture;casein;in vitro model
Corresponding author∗,professor,E⁃mail:jszhaoguoqi@hotmail.com
通信作者:∗赵国琦,教授,博士生导师,E⁃mail:jszhaoguoqi@hotmail.com
作者简介:詹 康(1988—),男,江苏南京人,博士研究生,从事动物分子营养研究。E⁃mail:zhankang0305@163.com
基金项目:江苏省高校优势学科建设工程资助项目;江苏省科技支撑项目(BE2013387)
收稿日期:2015-01-08
doi:10.3969/j.issn.1006⁃267x.2015.07.031
文章编号:1006⁃267X(2015)07⁃2241⁃07
文献标识码:A
中图分类号:S823

