牛乳主要过敏原酪蛋白的特性和分离纯化研究进展
熊子奕,马 鑫,陈红兵,李 欣,熊春红,
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.南昌大学食品学院,江西南昌 330047;3.南昌大学中德联合研究院,江西南昌 330047)
食物过敏是指人体接触某特定食物后,引发的不良免疫反应[1]。有数据显示,约有5%的成年人和6%的儿童(特别是3岁以下)会发生食物过敏[2−3],且发病率呈上升趋势。牛乳是联合国粮食及农业组织(Food and Agriculture Organization, FAO)和世界卫生组织(World Health Organization, WHO)认定的八大过敏性食物之一,同时也是婴幼儿最早接触的食物过敏原[4]。最新研究表明,在我国有2.69%的婴幼儿对牛乳蛋白过敏[5]。牛乳蛋白种类较多,至少有25种蛋白具有潜在致敏性[6]。酪蛋白(casein,CN)、β-乳球蛋白(Beta- lactoglobulin,β-Lg)和α-乳白蛋白(Alpha-lactalbumin,α-La)被认为是牛乳中最主要的过敏原,其中,酪蛋白含量约占牛乳蛋白总量的80%[7],大约有65%的牛乳过敏患者对酪蛋白过敏[8],其症状通常表现为湿疹、腹泻和胃肠出血等[9−11]。
研究表明,酪蛋白的致敏性与其结构特性密切相关。通过质谱、圆二色光谱、核磁共振波谱和X射线等分析技术[12],可以分析酪蛋白的各级结构,但是由于酪蛋白易受外界因素的影响,相互聚集形成较为复杂的胶束结构,造成包括致敏性在内的诸多生物特性的变化。因此,酪蛋白的结构测定和酪蛋白胶束的模型构建成为研究其致敏性的关键,而提取出高纯度且具有完整生物学特性的酪蛋白是准确测定其结构及致敏性的前提条件。
本文重点综述了牛乳酪蛋白的分离纯化研究进展,总结归纳了单一酪蛋白组分的生物学特征和多种酪蛋白胶束结构模型的共同特点,并介绍了酪蛋白的结构与其致敏性的关系,为利用蛋白质改性技术降低或消除酪蛋白致敏性的研究提供理论参考。
1 牛乳中酪蛋白的结构及特性
酪蛋白是哺乳动物乳汁中的一类含磷钙的结合蛋白,其含量丰富,相当于总乳成分的2.75%[13]。根据分子特性的差异,乳品中酪蛋白可分为四类:αs1-、αs2-、β-和κ-酪蛋白,分别由位于6号染色体上的CSN1S1、CSN1S2、CSN2和CSN3基因编码[14],其中β-酪蛋白还可进一步水解,得到的水解产物被称为γ-酪蛋白[15]。不同品种的乳中四种酪蛋白的相对比例不同,在牛乳中αs1-、αs2-、β-和κ-酪蛋白比例分别为45.0%、12.0%、35.0%和8.0%[16]。酪蛋白等电点为4.6~4.8,在常温下微溶于水和有机溶剂,具有非吸湿性和非结晶性[17]。表1[18]为牛乳中酪蛋白的组分及化学性质。酪蛋白对酸敏感,当溶液的pH较低时,蛋白分子聚集形成沉淀,加工后可制得干酪和干酪素。
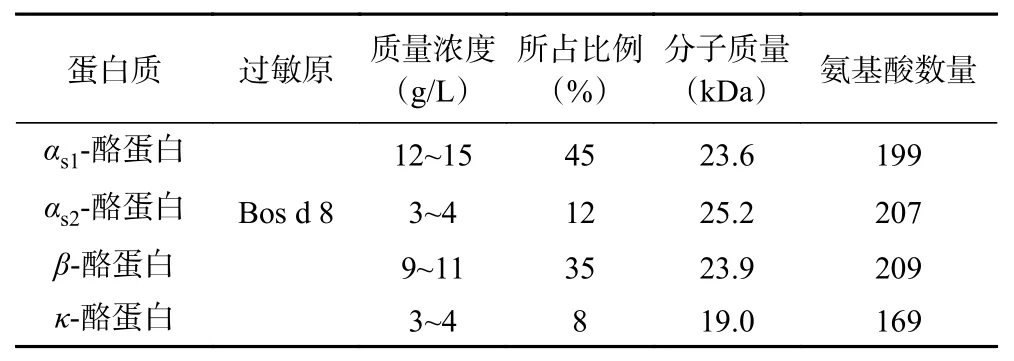
表1 牛乳中酪蛋白的组分及化学性质[18]Table 1 Components and chemical properties of casein in milk[18]
1.1 牛乳中酪蛋白的结构
酪蛋白在牛乳中并不是以单一组分的形式存在,而是相互交联形成类似球状的聚集体[19],即酪蛋白胶束,其平均直径约为150 nm[20]。图1[12]为酪蛋白胶束冷场发射电镜的扫描图。通常情况下,酪蛋白胶束含有成千上万个酪蛋白分子,其中大部分与矿物质结合形成热力学稳定的配位化合物。酪蛋白胶束与传统意义上的胶束存在着很大的区别,其具体结构较为复杂,由于检测水平的限制,人们对酪蛋白胶束结构的认识还处于理论假说和模型构建的阶段[21]。目前,模拟酪蛋白胶束结构模型有套核结构模型、亚单元结构模型、Holt模型和双结合模型[22−24]。近年来,对于这些结构模型还存在很大争议,但是学者们普遍认为,酪蛋白胶束具有由αs1-、αs2-、β-酪蛋白与矿物质(主要为非晶态磷酸钙)构成的内部结构和由κ-酪蛋白构成的覆盖在胶束表面的外部“毛”层。外部“毛”层分布不均匀,仅部分覆盖在酪蛋白胶束的表面,形成聚电解质刷[25],其空间位阻和静电斥力共同抑制了乳中酪蛋白胶束的聚集,对维持酪蛋白胶束的稳定起到了非常关键的作用。除此之外,酪蛋白胶束表面的κ-酪蛋白有一个糖基化的亲水基团,被称为糖巨肽[26],易于发生水合,其胶束内部也包含着大量的水分,这是酪蛋白胶束结构的一个很重要的特点。
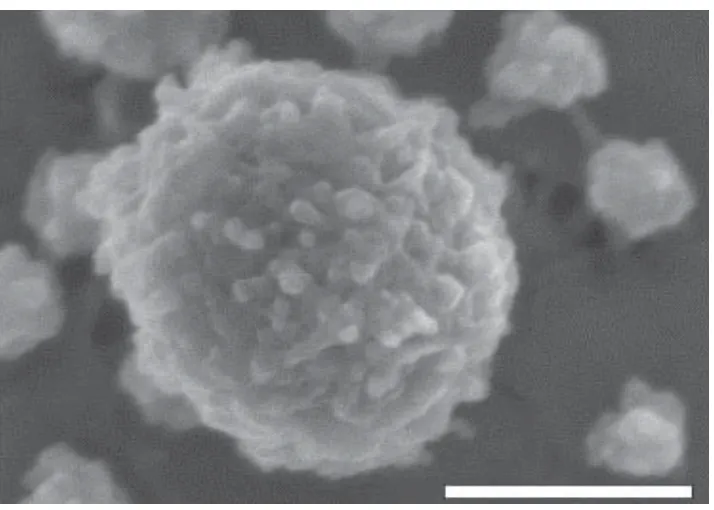
图1 酪蛋白胶束冷场发射电镜的扫描图[12]Fig.1 Electron micrograph of casein micelle cold field emission[12]
酪蛋白胶束的生物学功能与其结构密切相关。它的三个主要的生物学功能是:有助于乳腺安全分泌高浓度的钙和磷酸盐,未使其钙化;通过乳腺安全分泌高浓度的潜在纤维性酪蛋白;胶束在新生儿胃内滞留,使营养物质得以充分消化吸收[27]。
酪蛋白的结构与其致敏性关系密切。酪蛋白存在可以与特异性抗体相结合的结构组织,称为抗原决定簇(表位),是引发牛乳过敏反应的免疫学物质基础[2−29]。根据表位结构的不同,可将其分为连续性过敏原表位(线性表位)和不连续性过敏原表位(构象性表位);又根据过敏原表位与细胞的不同结合方式,可将其分为B细胞表位和T细胞表位。一般来说,T细胞表位都是线性表位,而B细胞可以识别并呈递完整抗原,所以B细胞表位既可以是线性表位,也可以是构象性表位。牛乳中酪蛋白相互聚集形成胶束,会覆盖一定数量的过敏原表位,当人体摄入牛乳时,酪蛋白胶束结构易被破坏,被覆盖的过敏原表位重新暴露,增强了酪蛋白的致敏性。
1.2 牛乳中单一酪蛋白的特性
1.2.1α-酪蛋白α-酪蛋白又称αS-酪蛋白,由两个单独的基因产物αs1-和αs2-酪蛋白组成[30]。
αs1-酪蛋白的分子量约为23.6 kDa[31],是由199个氨基酸(图2)组成的单链磷酸化蛋白[32],具有2种常见的磷酸化状态,即含有8个(αs1-CN-8P)或9个(αs1-CN-9P)磷酸化丝氨酸残基[33]。另外,αs1-酪蛋白的脯氨酸残基和疏水残基数量较多,分布均匀,使其不具有确定的三级结构,而是一个随机线圈构象,由基团间疏水相互作用稳定[34]。目前,已经发现了牛乳αs1-酪蛋白的9种变异型, 并以A到I进行分类[35]。其中,最常见的两种变体是B和C,两者区别在于蛋白质的192处的氨基酸不同,分别为Glu和Gly。这种变化改变了αs1-酪蛋白的等电点,从而使这两种变体很容易通过等电聚焦(IEF)识别区分[36]。有研究表明,牛乳酪蛋白中αs1-酪蛋白的致敏性明显高于其他几种酪蛋白,所以它被认为是牛乳酪蛋白中最为关键的过敏原[37−38]。

图2 牛αs1-酪蛋白B-8P的氨基酸序列[31]Fig.2 Amino acid sequence of αs1-CN B-8P[31]
αs2-酪蛋白由207个氨基酸残基组成(图3[31]),分子量大小约为25.2 kDa[39],在牛乳总酪蛋白中占比较低。它由两个主要结构域和数个次要结构域组成,这几个结构域呈现不同程度的翻译后磷酸化以及分子间二硫键[40]。αs2-酪蛋白是酪蛋白家族中对钙最敏感的成员,这可能是因为它的酯磷酸含量很高,酯磷酸来源于每条肽链上的磷酸基团[41]。目前,已发现αs2-酪蛋白存在A、B、C、D和E这5个等位基因,呈现出基因多态性[42]。研究表明,αs2-酪蛋白基因的多态性与奶牛泌乳量、乳蛋白量、乳脂量及乳脂率等产奶性状呈现一定相关性[43]。在过去的几年中,人们发现αs1-和αs2-酪蛋白都具有分子伴侣的特性,可以防止由于高温和其他应激条件而导致的凝血和沉淀[44]。

图3 牛αs2-酪蛋白A-11P的氨基酸序列[31]Fig.3 Amino acid sequence of αs2-CN A-11P[31]
1.2.2β-酪蛋白 在牛乳中,β-酪蛋白的含量仅次于αs1-酪蛋白[45],由209个氨基酸残基组成(图4[31]),分子量约为23.6 kDa,若加上5个修饰的磷酸基团,则分子量可增加至24 kDa[46]。β-酪蛋白不稳定,易发生水解从而产生γ-酪蛋白和短肽[47]。根据相同位置上氨基酸的不同,β-酪蛋白中至少存在13个遗传变异体[48]。其中,根据β-酪蛋白的第67位氨基酸是脯氨酸还是组氨酸,可将其分为A1和A2两种类型,这两种变体在β-酪蛋白中最为常见[49−51]。有研究显示,部分β-酪蛋白变体,如A1、B和C,可能是导致人体患有牛乳不耐症和一些其他疾病的重要因素,这是由于这些变体在消化过程中产生一种具有阿片活性的生物活性肽β-酪啡肽(BCM-7)[51−52]。相比之下,A2变异体不参与致病机制。有一种假说认为A1β-酪蛋白可能增加遗传易感儿童患Ⅰ型糖尿病(DM-I)的风险,也有人认为A1β-酪蛋白可能是导致冠心病的危险因素,而含A2β-酪蛋白的牛奶则可以减轻牛乳不耐症患者的急性肠胃道症状[53−54]。

图4 牛β-酪蛋白A2-5P的氨基酸序列[31]Fig.4 Amino acid sequence of β-CN A2-5P[31]
1.2.3κ-酪蛋白κ-酪蛋白是唯一具有糖成分的酪蛋白,含有169个氨基酸残基(图5[31]),分子量为19 kDa[55−56]。κ-酪蛋白分子中仅含有1个磷酸基团,2个SH基,二硫键含量占总酪蛋白的15%。在距离肽链的C端三分之一处可结合碳水化合物,如唾液酸、半乳糖苷、岩藻糖。另外在肽链的11位和88位上有2个半胱氨酸残基[57]。κ-酪蛋白对钙的敏感性低,一般不与钙结合,易发生糖基化作用[58]。牛乳中κ-酪蛋白易与其他酪蛋白结合,形成胶束,大部分的κ-酪蛋白是以酪蛋白胶束形式存在的[59]。有研究表明,κ-酪蛋白具有一定的免疫调节功能,其通过阻断NFκB途径,诱导巨噬细胞产生M2样表型,这些细胞可以显著减少Th1相关的促炎细胞因子和白细胞介素-2(IL-2)的释放,降低经κ-酪蛋白处理的巨噬细胞诱导适应性免疫反应的能力[60]。现已发现该蛋白主要存在两种变异型:即A和B,在大多数牛乳品种中A出现的频率相对更高,而B则与κ-酪蛋白中高比例的糖基化组分密切相关,并且影响着凝乳酶对酪蛋白的作用效果[61−62]。

图5 牛κ-酪蛋白A-1P的氨基酸序列[31]Fig.5 Amino acid sequence of bovine κ-CN A-1P[31]
2 牛乳酪蛋白分离纯化的方法
目前,牛乳中主要过敏原蛋白的分离方法较多:利用蛋白质等电点的不同而分离,包括等电点沉淀法和选择性沉淀法;利用选择性吸附不同而分离,包括疏水作用层析;利用过敏原在层析柱中带电性不同而分离,包括阴离子交换层析和阳离子交换层析;利用过敏原的分子质量不同而分离,包括膜技术和凝胶层析。在酪蛋白的分离纯化方法中,根据分离目的物的不同,也可将上述方法初步划分为胶束酪蛋白的初步分离和酪蛋白组分的提取纯化。除此之外,利用多种分离方法结合纯化酪蛋白已成为分离纯化技术发展的新方向。
2.1 胶束酪蛋白的初步分离
2.1.1 高速离心法 高速离心是实验室常用的酪蛋白粗提方法。酪蛋白胶束在高速离心的状态下沿径向分离,导致离心的酪蛋白颗粒化,形成沉淀析出。与其他分离方法不同,酪蛋白在高速离心过程中,胶束结构不会被破坏,因此可以重新分散,其性质与原胶束的性质基本相似。葛攀玮等[63]利用高速离心法提取纯化3种市售牛奶中的酪蛋白,并对所提取的酪蛋白进行聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定分析,其平均浓度为2.02 mg/mL,分子量为28 kDa。牛欣等[64]将鲜乳高速离心得到酪蛋白,并以分离得到的酪蛋白为原料,从流变学特性、粒径、Zeta电位和透光度等几个指标研究了其在不同 pH 下的变化情况。高速离心法所得沉淀是不纯的,需经过再悬浮和再离心2~3次,才能取得较纯的蛋白颗粒。
2.1.2 凝乳酶诱导分离法 凝乳酶是一种天冬氨酸内切蛋白酶,可高特异性地水解κ-酪蛋白。κ-酪蛋白对维持酪蛋白胶束的稳定起到了至关重要的作用,它能防止酪蛋白胶束凝聚。利用凝乳酶有限地水解κ-酪蛋白,破坏酪蛋白胶束的稳定,导致结构解体和凝乳的形成。凝乳可进一步分离出各酪蛋白组分。
凝乳酶诱导分离法操作简单,是常用的酪蛋白粗提方法,但是利用该方法提取的酪蛋白纯度不高,需与选择性沉淀法等分离方法结合,进一步分离出各酪蛋白组分。Huppertz等[65]用凝乳酶处理脱脂乳样品,再利用低温酸性条件下αs-酪蛋白和β-酪蛋白溶解度的不同,进一步分离酪蛋白组分。使用该方法提取的β-酪蛋白含量大约占脱脂乳样品中总酪蛋白含量的7%,纯度较高。由于κ-酪蛋白被高度特异性水解,所以该方法不利于后续提纯κ-酪蛋白。
2.1.3 等电点沉淀法 等电点沉淀法是利用蛋白质在等电点处溶解度最低这一化学特性而开发的分离方法。蛋白质在溶液中具有两性电离的现象,当溶液pH与其等电点相等时,蛋白质处于兼性分子的状态,净电荷为零,分子间静电斥力较小,更容易相互碰撞凝聚,形成沉淀析出[66]。利用这一性质,可以通过调节溶液pH来达到分离不同蛋白质组分的目的。
等电点沉淀法可以快速地分离牛乳酪蛋白,方法简单,易于操作,对设备要求不高,是实验室制备酪蛋白的常用方法。蒋红玲等[67]以脱脂乳为原料,加入磷酸缓冲盐溶液(PBS)后,用1moL/L 的HCl将溶液pH调节至4.6,析出酪蛋白沉淀,取得了较好的分离纯化效果,其纯度>90%。宋宏新等[68]采用新鲜牛乳为原料,利用等电点沉淀法分离出粗品酪蛋白,再通过水洗净化除杂和有机溶剂脱脂等步骤制得牛乳酪蛋白,通过凯氏定氮法和SDS-PAGE凝胶电泳分析比较酪蛋白组分差异,获得酪蛋白的纯度与得率分别为91.13%和86.75%。利用此方法分离出的酪蛋白纯度能满足后续实验的需要,常与其他分离方法结合以进一步分离纯化酪蛋白组分。
2.2 酪蛋白组分的提取纯化
2.2.1 选择性沉淀法 选择性沉淀法是利用蛋白质对某些物理或化学因素敏感性的不同,而有选择地使之变性沉淀,从而达到分离提纯的目的。αs-酪蛋白比β-酪蛋白具有更多的磷酸丝氨酸基团,在碱性条件下,带有更多的净负电荷,因此αs-酪蛋白对Ca2+的亲和性比β-酪蛋白更高[69]。而在酪蛋白组分中,β-酪蛋白疏水性最强,但是其溶解度受温度的影响较大。当温度较低时(≤4 ℃),即使溶液pH在其等电点处,β-酪蛋白也还是拥有较高的溶解度。通过低温分离后再加热的方法,可获得β-酪蛋白组分。κ-酪蛋白在含三氯乙酸(TCA)的尿素溶液中有较高的溶解度[70],可利用这一性质将其与其他酪蛋白组分分离。
选择性沉淀法是等电点沉淀法的一种改进方法,能够将牛乳中分离出的胶束酪蛋白进一步分离纯化,从而得到各种酪蛋白组分。Thomas等[71]以牛乳中分离出的胶束酪蛋白为原料,采用选择性沉淀的方法,分离各酪蛋白组分。利用该方法得到的αs-和β-酪蛋白组分纯度均达到95%以上,而κ-酪蛋白纯度为54%,得率为83%。虽然该方法步骤较多,但是得到的酪蛋白组分纯度高,且对过程稍加改进便可用于中试规模分离酪蛋白,所以选择性沉淀法是最常用的酪蛋白分离纯化方法之一。
2.2.2 疏水作用层析法 蛋白质表面一般含有疏水基团和亲水基团,疏水作用层析是利用蛋白质表面某一部分具有疏水性,与同样带有疏水性的层析介质在高盐浓度的条件下相结合。在洗脱时,将盐浓度逐渐降低,根据蛋白质组分的疏水性不同而逐个洗脱纯化。疏水性弱的蛋白组分,在较高离子强度的溶液中被洗脱下来,当离子强度降低时,疏水性强的蛋白才被洗脱[72]。疏水作用层析法分离酪蛋白,以尿素为流动相,将待分离的样品吸附在疏水性层析介质上,然后线性或阶段降低离子强度,选择性的将样品解吸。
牛乳酪蛋白各组分疏水性差别较大,β-酪蛋白疏水性最强,α-酪蛋白次之,κ-酪蛋白疏水性最弱[73],因此可以有效地分离各酪蛋白组分。Emilia等[74]使用TSK-Gel Ether-5PW疏水色谱柱分离和测定各酪蛋白组分,得到的αs1-、αs2-、β-、κ-酪蛋白纯度分别为76.1%、85.0%、87.9%和65.5%。由于蛋白质与疏水性层析介质之间的作用力相对较弱,分离过程对蛋白质活性影响较小,更加有利于蛋白质的后续分析实验。该方法对疏水性层析介质的选择要求较高,需要依据目标蛋白的化学性质而定,结合能力太强的介质会使得蛋白很难洗脱,而结合能力太弱的介质无法达到分离出各蛋白组分的效果,所以这也是该分离方法的技术难点。
2.2.3 离子交换层析法 离子交换层析法是利用蛋白质分子表面所带电荷性质的不同而达到分离纯化目的的一种分离方法。利用该方法分离酪蛋白组分,是依据各种酪蛋白在特定的条件下,呈现不同的电荷强度,与离子交换剂的结合能力存在明显差别,用洗脱剂洗脱时,按结合能力的大小,由弱到强依次洗脱分离。离子交换层析法主要分为阴离子交换层析和阳离子交换层析,其中分离酪蛋白组分常用阴离子交换层析。
离子交换层析法具有良好的样品处理能力和广泛的适用性,适中的成本和高度的自动化使其成为应用最广泛的酪蛋白分离纯化技术之一。刘纳[75]以牛乳加工制得的干酪素为原料,将尿素沉淀法与离子交换层析法相结合对干酪素进行分级分离,最终得到的αs-酪蛋白相对纯度和回收率分别为75.4%与73.8%,β-酪蛋白相对纯度和回收率为87.9%与62.0%,κ-酪蛋白相对纯度和回收率为57.3%与49.8%。Johann等[76]通过Source 30Q阴离子交换树脂分离纯化各酪蛋白组分,每1.2 g全酪蛋白中可分离αs-酪蛋白456 mg、β-酪蛋白358 mg和κ-酪蛋白99 mg。虽然离子交换层析法具有许多优点,但是也存在一定的局限性。在工业生产中,洗脱剂中的盐浓度很难精准控制,所以只能采用分步洗脱而不是连续升高的盐梯度,分离效果会有所下降,但即使是用最为精确的控制条件,仅用离子交换层析这一单一方法,也很难得到纯度高的蛋白,需要与其他分离纯化技术相结合,比如疏水作用层析法。
2.2.4 高效液相色谱法 高效液相色谱法是一种常用的快速分离方法。其分离效率高,通常分析一个样品在15~30 min,有些样品甚至在5 min内即可完成。高效液相色谱分辨率较高,重复性好,色谱柱可以反复使用,样品不易被破坏,易回收,且自动化程度高。因此高效液相色谱法的应用较广,大部分有机化合物都可用高效液相色谱分析,特别是高沸点、大分子、强极性、热稳定性差的化合物的分离分析。
高效液相色谱法方便快捷,酪蛋白产物纯度高,可作为高精度研究的实验材料。随着牛乳致敏性研究的深入,该方法分离过敏原蛋白的应用也越来越广泛。刘梦云等[77]以C8色谱柱为分离柱,利用反相高效液相色谱法对乳粉中酪蛋白的4种组分(αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白)进行分离检测。4种酪蛋白的加标回收率在95.2%~100.6%之间,且纯度高。王娟等[78]采用Agilent Zorbax 300SB-C8色谱柱对牛乳样品进行检测,以三氟乙酸-水-乙腈为流动相梯度洗脱,在波长214 nm处测定牛乳蛋白组分。其中αs1-、αs2-、β-、κ-酪蛋白的回收率分别为94.3%、83.3%、91.9% 和 80.7%,纯度可达99%。
2.2.5 膜分离技术 膜分离是利用高分子膜的选择透过性,实现不同分子量蛋白质组分分离的技术。由于牛乳中各组分的分子量和粒径不同,大部分乳清蛋白、乳糖、矿物质和水能透过膜成为渗透液,而酪蛋白不能透过膜留在截留液中,从而实现酪蛋白的分离纯化[79]。应用于酪蛋白组分分离的膜技术主要为微滤(MF)和超滤(UF)。
膜分离技术选择性强,操作过程简单,适用范围广,是一种发展迅速的新兴分离技术。由于β-酪蛋白在低温条件下是单量体,随着温度的升高会变为聚合体,与原胶束的直径存在明显的差别,使用膜分离效果显著,所以膜分离技术也是中试规模分离纯化β-酪蛋白的常用方法。Johannes等[80]在50 ℃的条件下,将脱脂乳在孔径为0.1 mm的陶瓷膜上进行微滤,获得胶束酪蛋白浓缩物。进而经冷藏处理后,在温度≤5 ℃的条件下,使用孔径为0.3 mm的有机膜从冷藏浓缩物中微滤分离β-酪蛋白。进一步将β-酪蛋白渗透液加热至50 ℃,使β-酪蛋白自缔合,采用截留值为10 kDa的有机膜进行超滤。利用该方法获得的β-酪蛋白纯度为92.64%,产率最高为18.07%。值得注意的是,利用该方法分离蛋白之后,膜面易发生污染,致使膜分离性能降低,故需采用与工艺相适应的膜面清洗方法。
2.3 多种分离方法结合纯化酪蛋白
每种分离纯化酪蛋白的方法都具有其优势,但也存在一定的局限性。在实际应用中,单独使用一种分离方法纯化酪蛋白,其纯度和生物学性质可能不能满足后续实验的需要,而不同的分离纯化方法之间可能存在协同作用,达到优势互补的效果,所以多种分离方法相结合纯化酪蛋白,可以显著改善酪蛋白的分离效果。丛艳君等[81]使用等电点沉淀法,将脱脂乳pH调至4.2,得到的酪蛋白沉淀反复洗涤并冷冻干燥;再将得到的酪蛋白溶于含有尿素和二硫苏糖醇(DTT)的甲酸钠缓冲液,加至离子交换层析柱中,以NaCl为洗脱液进行梯度洗脱,最后使用10 kDa膜进行超滤以除去尿素和氯化钠,得到高纯度的αs1-酪蛋白、β-酪蛋白和κ-酪蛋白。Katharina等[82]先通过膜技术从牛乳中分离出胶束酪蛋白,再采用选择性沉淀法进一步分离,获得不同酪蛋白组分。其中β-酪蛋白的纯度与产率分别可达到89.6%和32%;而αs-和κ-酪蛋白的纯度分别为61%和43%。实验结果表明,相比于利用单一方法纯化酪蛋白,多种分离方法相结合纯化酪蛋白更具有竞争力。
3 前景与展望
酪蛋白是牛乳中最主要的蛋白质,是良好的蛋白补充剂及添加剂,但是其较高的致敏性同样不容忽视。分离出较高纯度的酪蛋白,是人们研究牛乳过敏的物质基础。目前,关于牛乳酪蛋白分离纯化的技术虽然很多,但仍然存在需要解决的问题。一些操作简便、成本较低的方法分离出的酪蛋白纯度很难满足后续实验的需要,而分离纯度高的分离纯化技术则需要较为精密的实验设备,成本较高。因此,牛乳酪蛋白的分离纯化技术有待于进一步研究。除了对现有技术的改良之外,还必须发展全新的分离技术,以期实现蛋白质分离和后续蛋白质组学分析全过程的自动化。与此同时,采用多种分离方法结合纯化酪蛋白也将成为今后的主要发展趋势。

