牛乳主要过敏原αS1-酪蛋白的纯化鉴定及其多克隆抗体的制备
何圣发,龙彩云,王 娇,熊 梦,赵江强,燕 燕,董亚萍,李 欣,陈红兵
(1.赣南医学院公共卫生与健康管理学院,江西赣州 341000;2.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;3.赣州市疾病预防控制中心,江西赣州 341000;4.南昌大学食品学院,江西南昌 330047;5.南昌大学中德联合研究院,江西南昌 330047)
牛乳具有丰富的营养物质,深受人们喜爱,但作为“八大过敏性食物”之一,由于摄入牛乳蛋白而引起的食物过敏现象也引起了国内外的广泛关注[1−4]。牛乳中有30 多种蛋白质可能会导致过敏,其中αS1-酪蛋白不仅含量最高,其致敏性也更强[5−7]。因此,αS1-酪蛋白被认为是牛乳中最重要的过敏原之一,可作为检测食品中是否含牛乳蛋白的一个重要标志物。而αS1-酪蛋白的纯化及其特异性多克隆抗体的制备是建立αS1-酪蛋白检测方法的物质基础。
αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白和κ-酪蛋白在牛乳中含量分别为12~15、3~4、9~11 和3~4 mg/mL,分子量分别为23.6、25.2、24.0 和19.0 kDa,等电点分别为4.9~5.0、5.2~5.4、5.1~5.4 和5.4~5.6[7]。这些理化性质为各种酪蛋白的分离纯化和鉴定提供了重要依据。例如,DEAE Sepharose Fast Flow、QSepharose 等阴离子交换层析(pH=7.0)是分离纯化酪蛋白的常用方法[8−12],根据αS1-酪蛋白的等电点最低及蛋白含量最高,可大致判断αS1-酪蛋白的出峰时间最晚,且峰面积较大。另外,由于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)通常能较准确地指示蛋白质的分子量,因此是鉴定蛋白质最常用的方法[13−15]。然而,研究发现酪蛋白在SDS-PAGE中的迁移速度要比理论值更慢,尤其是由于αS1-酪蛋白的水合粒径较大,导致其在SDS-PAGE 中位于34.5 kDa,远高于其实际分子量[16]。Treweek 等[17]通过质谱技术证明αS1-酪蛋白在SDS-PAGE 中的位置高于αS2-酪蛋白。但目前有些研究仅根据各酪蛋白的分子量及其在SDS-PAGE 中的理论分布来判断纯化结果,导致各研究结果存在较大差异[8−11]。另外,虽然有少数研究通过质谱、标准品对照等方法对纯化的αS1-酪蛋白进行鉴定,但未给出纯化样品的SDS-PAGE 图[12,17−18],从而无法给相关的纯化研究提供准确、直观的参考。因此,有必要在充分利用各酪蛋白理化性质的基础上,结合其他技术方法对分离纯化的αS1-酪蛋白进行综合准确鉴定,以确保纯化获得的αS1-酪蛋白的可靠性,并提供分离纯化的色谱图和SDS-PAGE 图,为相关研究提供科学、直观的参考。
除了利用目标蛋白的理化性质对其进行鉴定外,免疫学方法、质谱方法等技术可进一步为蛋白质的鉴定提供有力保障。其中,免疫学技术是利用抗原与抗体特异性结合的特性来鉴别抗原蛋白,具有特异性强、灵敏度高、操作简单、经济、快速等优点[19−21]。抗体是免疫学鉴定抗原蛋白的关键,在未获得目标蛋白质而无法制备相应抗体时,可以通过化学合成或原核表达等方法制备含目标蛋白质某些序列或全部序列的多肽或蛋白质,并制备相应的抗体[22−25],再利用这些抗体对纯化的目标蛋白质进行免疫学鉴定。另外,将质谱技术与酶解和液相色谱等方法联合,得到蛋白质谱图后,通过检索数据库,可以灵敏、准确、高通量地鉴定蛋白质,是蛋白质鉴定的“金标准”,广泛用于蛋白质等物质的鉴定与检测[26−28]。
本研究将通过DEAE Sepharose Fast Flow 阴离子交换层析对牛乳酪蛋白的各蛋白质组分进行分离,基于4 种酪蛋白的理化性质,结合SDS-PAGE、免疫学方法和质谱技术等方法对纯化的αS1-酪蛋白进行综合鉴定,并制备特异性识别αS1-酪蛋白的兔多克隆抗体(polyclonal antibody againstαS1-casein,pAb-αS1-CN),为αS1-酪蛋白免疫学检测方法的建立提供物质基础,也为其他过敏原蛋白的纯化与鉴定提供参考。
1 材料与方法
1.1 材料与仪器
8 周龄的雄性新西兰大白兔 赣州蓉江新区潭东镇天予养殖场;牛乳酪蛋白、α-酪蛋白、α-乳白蛋白、β-乳球蛋白、弗氏完全佐剂、弗氏不完全佐剂、HRP 标记羊抗兔IgG(HRP-IgG)二抗 美国Sigma公司;DEAE Sepharose Fast Flow 阴离子柱材 美国GE 公司;TMB 底物试剂盒、预染蛋白Markers美国Thermo Fisher Scientific 公司;三羟甲基氨基甲烷(Tris)、甘氨酸、透析袋(分子截留量3500 Da)北京索莱宝科技有限公司;40%的丙烯酰胺/甲叉双丙烯酰胺溶液(29:1) 上海生工生物工程股份有限公司;96 孔酶标板 无锡耐思生命科技股份有限公司。
ST16R 高速冷冻离心机、Varioskan LUX 多功能酶标仪 美国Thermo Fisher Scientific 公司;TH-500 梯度混合仪、BT-100 恒流泵、HD-3 紫外检测仪、HD-A 层析图谱采集分析仪、BS-100 自动部分收集器、层析柱(1.6 cm×50 cm) 上海沪西分析仪器厂有限公司;PB-30 pH计德国Sartorius 公司;Mini-PROTEAN Tetra 小型垂直电泳仪 美国Bio-Rad 公司;Amersham Imager 600 超灵敏多功能成像仪 美国GE 公司;FreeZone 2.5 L 立式冷冻干燥机 美国Labconco 公司;PL9620G 全自动洗板机 北京普朗新技术有限公司;MT60-4 恒温微孔板振荡器 深圳市优米仪器设备有限公司;MS-H-ProT磁力搅拌器 大龙兴创实验仪器(北京)股份公司。
1.2 实验方法
1.2.1 阴离子交换层析分离纯化牛乳αS1-酪蛋白 称取1 g 牛乳酪蛋白溶于50 mL 平衡缓冲液(50 mmol/L Tris-HCl,含有3.3 mol/L 尿素、20 mmol/L NaCl、10 mmol/L EDTA、0.12% [V/V]β-巯基乙醇,pH7.0),调pH 至7.0。采用DEAE Sepharose Fast Flow 阴离子交换层析分离纯化αS1-酪蛋白。先用平衡缓冲液平衡离子交换柱,然后加入10 mL 酪蛋白(20 mg/mL)。采用平衡缓冲液洗脱未被吸附的杂质,流速为2 mL/min;然后用含0.02~0.5 mol/L NaCl的平衡缓冲液进行连续洗脱,流速为1.5 mL/min。收集洗脱样品,6 mL/管。
1.2.2 SDS-PAGE 分析蛋白质纯度 SDS-PAGE 用来分析离子交换层析所得蛋白质的组分与纯度。SDS-PAGE 电泳采用4%的浓缩胶和12%的分离胶,凝胶厚度为1.0 mm,样品上样量为18 μL,Markers 上样量为3 μL。电泳采用恒流模式,浓缩胶电泳条件为10 mA、30 min,分离胶电流为20 mA,直至溴酚蓝跑至分离胶底端。电泳结束后,进行剥胶、考马斯亮蓝染色、甲醇乙酸溶液脱色等程序。脱色完全后,利用Amersham Imager 600 进行凝胶成像,通过ImageJ 软件分析蛋白纯度。
1.2.3 牛乳αS1-酪蛋白的鉴定 首先,按照课题组前期报道的方法[24],制备了特异性识别αS1-酪蛋白9 个IgE 表位的多克隆抗体,然后以该多克隆抗体为一抗,通过间接酶联免疫吸附实验(enzyme-linked immuno sorbent assay,ELISA)分析各峰样品的免疫学反应性。用包被液将各峰尖样品进行梯度稀释(不稀释、10 倍、100 倍、1000 倍),以包被液作为空白对照,每孔100 μL,3 个平行,4 ℃包被过夜。用PBST(PBS,含0.05% Tween-20)洗涤3 次后,每孔依次加入250 μL 3%的明胶、100 μL 一抗(稀释2 万倍)、100 μL HRP-IgG(稀释1 万倍),均于37 ℃、400 r/min振荡孵育1 h(若无特殊说明,ELISA 的孵育条件均为37 ℃、400 r/min 振荡孵育),每次孵育完后均用PBST 洗涤3 次。然后每孔加入100 μL TMB 工作试剂,孵育15 min 后,每孔加入50 μL 2 mol/L 的H2SO4终止反应。最后,450 nm 测吸光值(optical density at 450 nm,OD450nm)。
另外,进一步通过质谱技术对αS1-酪蛋白进行鉴定。将间接ELISA 确定为αS1-酪蛋白的样品进行SDS-PAGE,染色、脱色后,将最粗的条带切下,送上海生工生物工程股份有限公司(武汉)进行MALDITOF-TOF 质谱鉴定。
1.2.4 牛乳αS1-酪蛋白的冷冻干燥 对综合鉴定为αS1-酪蛋白的样品进行透析和冷冻干燥。首先,按照说明书处理透析袋:剪取合适长度的透析袋,先用2%(W/V)NaHCO3和1 mmol/L EDTA(pH8.0)煮沸10 min,再用1 mmol/L 的EDTA(pH8.0)煮沸10 min,每次煮完后均用超纯水彻底清洗透析袋。接着将αS1-酪蛋白样品倒入透析袋中,用流动的自来水透析过夜除盐,然后在磁力搅拌下用超纯水透析2 次,每次3 h。然后,通过离心收集透析所析出的沉淀,并放入−80 ℃进行冷冻。将αS1-酪蛋白样品进行冷冻干燥。最后,通过SDS-PAGE 分析冻干样品的纯度,其余样品保存于−80 ℃备用。
1.2.5 兔抗牛乳αS1-酪蛋白多克隆抗体的制备与特异性分析 按照课题组前期报道的方法[24],制备pAb-αS1-CN 并分析其特异性。选取2 只8 周龄的新西兰大白兔,雄性,分别标记为兔A 和兔B,饲养于动物房。喂养不含牛乳蛋白的食物,喂养一周无异常后,开始免疫,每次免疫前,耳缘静脉取血,用于监测抗体效价变化。用PBS 将αS1-酪蛋白配成2 mg/mL的溶液,将等体积的αS1-酪蛋白溶液和弗氏佐剂混合进行乳化,初次免疫用弗氏完全佐剂,加强免疫用弗氏不完全佐剂。采用背部皮下多点注射,每只兔子每次免疫 1 mL(1 mgαS1-酪蛋白)。每两周免疫一次。免疫过程中,通过间接ELISA 监测血清效价变化,当效价不变或出现下降时结束免疫。免疫结束后,通过颈动脉采血,先将血液置于室温1 h,然后置于4 ℃过夜,最后4500 g 离心5 min,收集上清液(血清),于−80 ℃保存备用。
通过竞争抑制ELISA 法分析pAb-αS1-CN 的特异性。在A 板中包被合适浓度的αS1-酪蛋白,4 ℃过夜。PBST 洗涤3 次后,用3%的明胶封阻,同时取一块新板B 进行封阻,孵育1 h。对A 板和B 板进行洗涤后,B 板每孔加入70 μL 的αS1-酪蛋白或其他过敏原蛋白(牛乳α-乳白蛋白、β-乳球蛋白、蛋清蛋白、花生蛋白、大豆蛋白),以及70 μL pAb-αS1-CN,3 平行,孵育1 h。然后,从B 板每孔中取100 μL加到A 板中,A 板孵育1 h。洗涤后,每孔加100 μL HRP-IgG 二抗,孵育1 h。其余步骤同1.2.3。
1.3 数据处理
采用Origin 8 绘制图形,通过SPSS 17 对数据进行单因素方差分析(ANOVA),P<0.05(*)和P<0.01(**)表示数据间差异显著。
2 结果与分析
2.1 牛乳αS1-酪蛋白的分离纯化
牛乳酪蛋白的DEAE Sepharose Fast Flow 阴离子交换层析图谱如图1 所示,共有4 个峰(A、B、C 和D)。由于αS1-酪蛋白在酪蛋白中的等电点最低(4.9~5.0)、含量最高[7],因此αS1-酪蛋白在pH=7 的缓冲液中所带电荷最大,需要更高的离子浓度才能将其洗脱下来,将是最后出峰,且峰面积最大。因此,结合酪蛋白的理化性质,可以初步推断D 峰为αS1-酪蛋白(图1)。
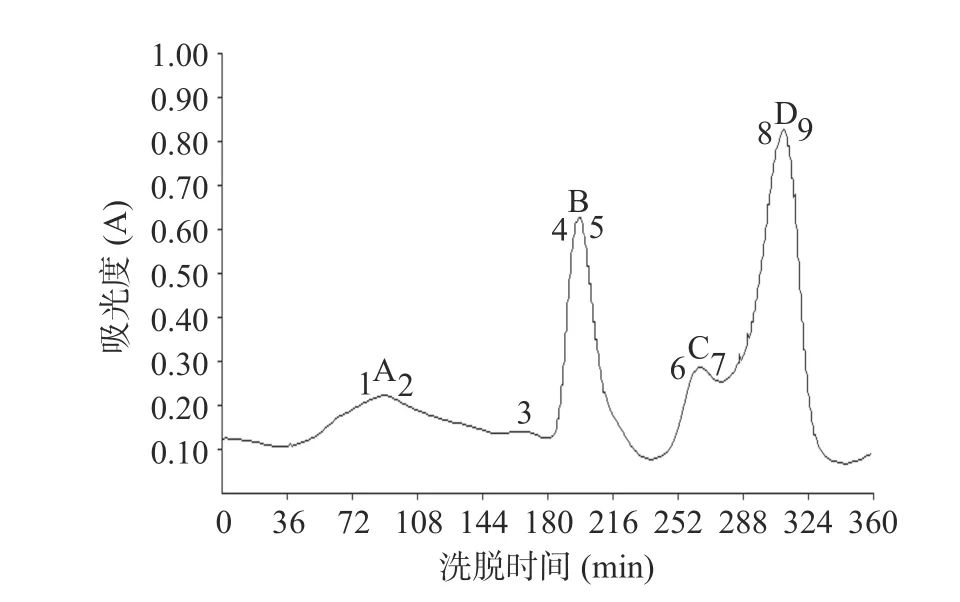
图1 牛乳酪蛋白的DEAE Sepharose Fast Flow 阴离子交换层析图谱Fig.1 Chromatogram of bovine casein using DEAE Sepharose Fast Flow anion-exchange chromatography
通过SDS-PAGE 对DEAE Sepharose Fast Flow阴离子交换层析的样品(图1,1~9)及牛乳蛋白进行组分分析,结果如图2 所示。从图2A 可知,A 峰样品(泳道1 和2)和B 峰样品(泳道4 和5)及泳道3 的条带位于25~30 kDa,C 峰(泳道6 和7)和D 峰(泳道8 和9)样品在35 kDa 左右,且C 峰样品的位置略低于D 峰,B 峰和D 峰样品的条带较粗。在牛乳蛋白中,αS1-酪蛋白不仅含量最高,其水合粒径也较大,在SDS-PAGE 中的移动速度较慢,导致αS1-酪蛋白在SDS-PAGE 中的实际位置(34.5 kDa)高于其实际分子量(23.6 kDa),也高于αS2-酪蛋白和β-酪蛋白的位置[7,16−17]。因此,结合文献报道和αS1-酪蛋白的理化性质,可以推测D 峰为αS1-酪蛋白,与阴离子交换层析图谱的分析结果一致。另外,脱脂牛乳、牛乳酪蛋白和牛乳α-酪蛋白(Sigma 标品)的电泳结果如图2B 所示,根据牛乳(泳道1)、酪蛋白(泳道2)和α-酪蛋白(泳道3)中的主要蛋白成分及其含量与分子量[7],可以初步推断a~f 分别为α-乳白蛋白、β-乳球蛋白、κ-酪蛋白、β-酪蛋白、αS2-酪蛋白和αS1-酪蛋白。由此可知,图2B 中的αS1-酪蛋白(f 条带)和αS2-酪蛋白(e 条带)的位置分别与图2A 泳道9(D 峰)和泳道7(C 峰)的条带位置一致。综上,通过综合分析牛乳各蛋白的理化性质(等电点和含量)及其在电泳图中的位置并结合文献报道,可以判断D 峰为αS1-酪蛋白。
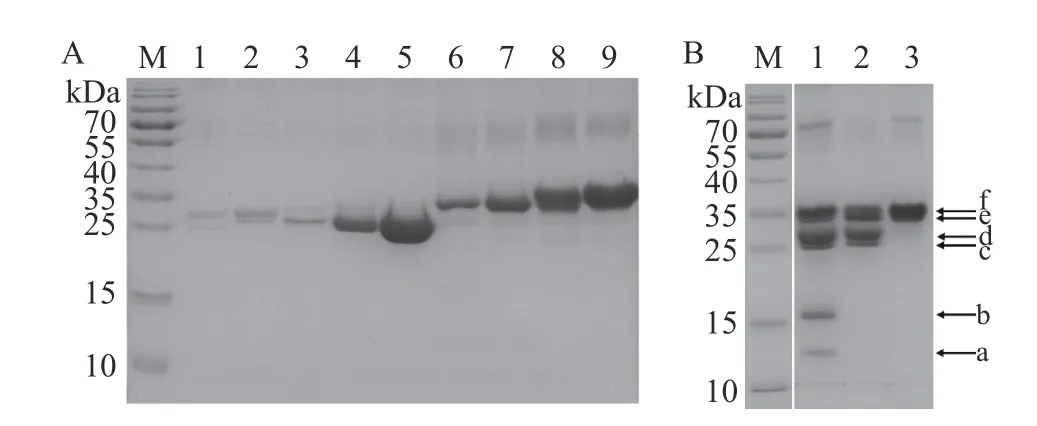
图2 DEAE Sepharose Fast Flow 阴离子交换层析分离牛乳酪蛋白和牛乳蛋白的SDS-PAGE 图Fig.2 SDS-PAGE profile of bovine casein purified by DEAE Sepharose Fast Flow and milk proteins
2.2 牛乳αS1-酪蛋白的免疫学方法鉴定
结合牛乳酪蛋白的理化性质和标准品对照,已初步判断D 峰为αS1-酪蛋白。为了进一步从免疫学角度确定αS1-酪蛋白的出峰位置,以αS1-酪蛋白的IgE 表位多克隆抗体为一抗,通过间接ELISA 分析了第22、49、66 和77 管样品(图1,A~D 的峰尖样品)与一抗的免疫反应性,结果如图3 所示。由于所用的一抗能特异性识别αS1-酪蛋白的多个IgE 表位,因此能与该抗体反应的样品则含有αS1-酪蛋白。从图3 可知,A 峰样品基本未与一抗反应,表明A 峰不含αS1-酪蛋白。未稀释的B 峰样品与一抗有明显反应,但稀释10 倍后没有反应,表明B 峰含有微量αS1-酪蛋白。C 峰样品在低稀释度时,有较强烈的反应,但稀释1000 倍时只有极轻微的反应,表明C 峰样品中含有少量αS1-酪蛋白。而不同稀释度的D 峰样品均与一抗有强烈反应,表明D 峰含有大量αS1-酪蛋白。另外,C 峰和D 峰样品与一抗的反应强度随样品稀释度的增加呈先增强后减弱趋势,产生该现象的原因可能是:a.高浓度的NaCl 和尿素会抑制抗原的包被效果[29],NaCl 和尿素的浓度随样品稀释度的增加而降低,因此这种抑制作用也会随样品稀释度的增加而减弱;b.样品中αS1-酪蛋白的浓度也随样品稀释度的增加而降低。由于样品中αS1-酪蛋白浓度和NaCl 与尿素浓度的降低对αS1-酪蛋白的包被效果具有相反作用,这可能导致C 峰和D 峰样品中αS1-酪蛋白的包被量随样品稀释度的增加呈先增加后降低的趋势,从而产生此现象。总之,从免疫学角度进一步证明D 峰为αS1-酪蛋白。
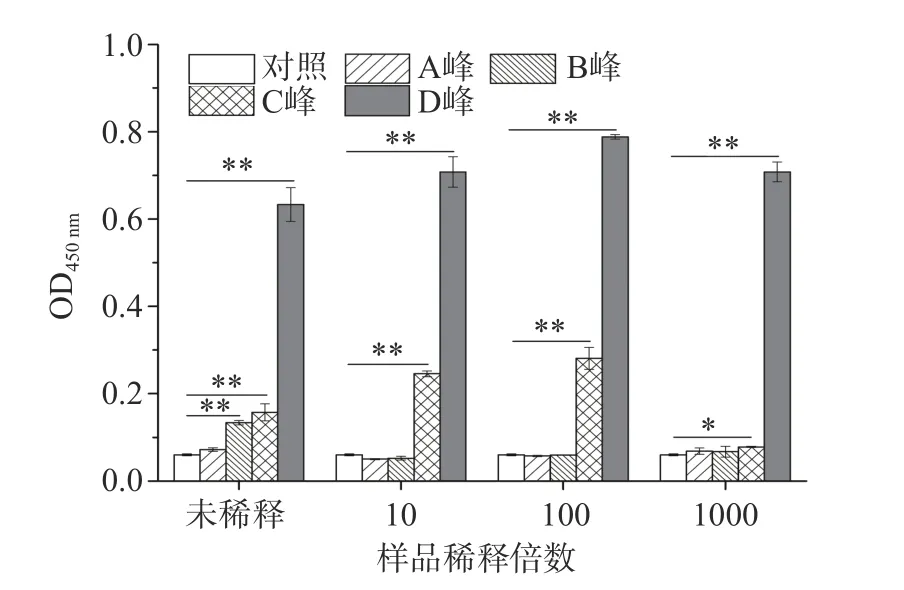
图3 间接ELISA 分析阴离子交换层析样品的免疫反应性(n=3)Fig.3 Analysis of immunoreactivity of bovine casein purified by DEAE Sepharose Fast Flow by indirect ELISA(n=3)
2.3 牛乳αS1-酪蛋白的质谱鉴定
虽然免疫学方法鉴定D 峰为αS1-酪蛋白,但为了确证图2A 泳道9 中含量最高的条带是否为αS1-酪蛋白,进一步对该条带进行质谱鉴定,结果如图4所示。根据质谱结果,在uniprot 数据库中共搜索到7 个蛋白,其中αS1-酪蛋白的分值最高(4395),而其他6 种蛋白质只有16~42 分,分值越高说明匹配度越高。二级质谱共鉴定出αS1-酪蛋白的7 条多肽(图4A~G),覆盖αS1-酪蛋白43.22%的氨基酸序列(图4H)。而从文献报道[30]和BLAST 序列对比分析可知,αS1-酪蛋白只与大豆蛋白(如Gly m5、P34)存在少量相似的氨基酸序列。因此,质谱结果可以确定图2A 泳道9 为αS1-酪蛋白。
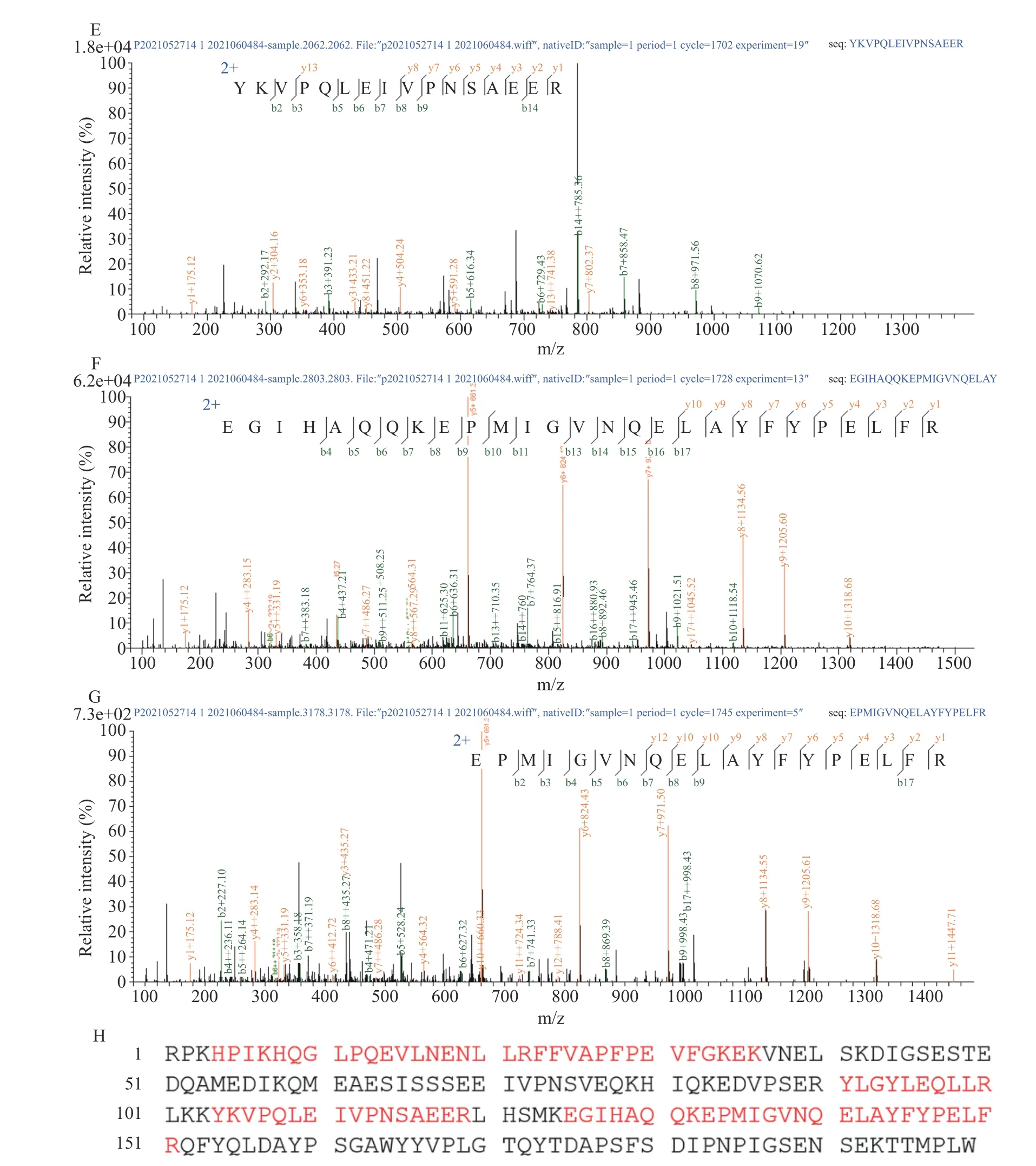
图4 泳道9(图2A)的二级质谱图及其在αS1-酪蛋白氨基酸序列中的覆盖区域Fig.4 Mass spectra and amino acid sequences in αS1-casein of lane 9 (Fig.2A)
2.4 牛乳αS1-酪蛋白的冻干样品纯度分析
虽然综合αS1-酪蛋白的理化性质、免疫学反应性、质谱技术等方法的结果确定D 峰为αS1-酪蛋白,但D 峰左侧样品中仍然含有少量αS2-酪蛋白(图2,泳道8)。因此,为了提高αS1-酪蛋白的纯度,通过SDS-PAGE 分析第75~83 管样品(D 峰,297~332 min)中αS1-酪蛋白的纯度,结果如图5A 所示。D 峰样品中αS1-酪蛋白的纯度随出峰时间推移,纯度先升高后下降,泳道1~3 中含有少量αS2-酪蛋白,而泳道8 和9 的αS1-酪蛋白含量较少。因此,收集78~81 管样品(泳道4~7)进行透析。另外,由于酪蛋白的水溶性较差[31],当透析除去尿素后,大部分αS1-酪蛋白会析出形成沉淀,只有少量αS1-酪蛋白和αS2-酪蛋白会溶解在水中。因此,为了进一步除去αS2-酪蛋白,提高αS1-酪蛋白的纯度,对透析后的样品进行离心,并收集沉淀进行冷冻干燥。最终,200 mg 酪蛋白可分离获得21.75 mgαS1-酪蛋白,按αS1-酪蛋白占酪蛋白的40%计算,αS1-酪蛋白的纯化得率为27.19%。冻干样品的纯度如图5B 所示,泳道1 基本是αS1-酪蛋白,几乎不含αS2-酪蛋白和其他牛乳蛋白,ImageJ 软件灰度分析显示αS1-酪蛋白的纯度高达94.26%。
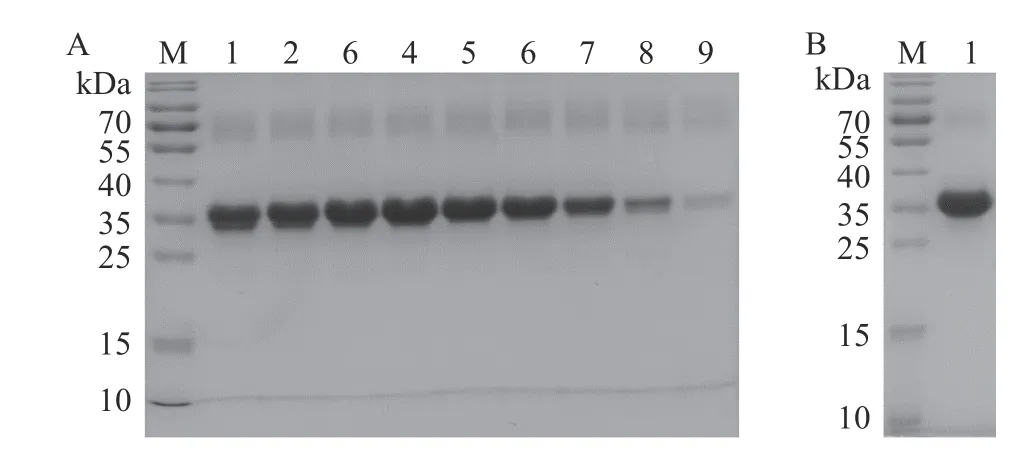
图5 αS1-酪蛋白透析前后的SDS-PAGE 图Fig.5 SDS-PAGE profile of αS1-casein before and after dialysis
国内外分离纯化αS1-酪蛋白的部分研究结果如表1 所示,本文和Treweek 等[17]均采取了质谱技术等方法从多方面综合确证了所纯化的蛋白质为αS1-酪蛋白,也有些研究以标准品或有证标准物质作为参考来鉴定所纯化的αS1-酪蛋白[12,18],但它们均未提供αS1-酪蛋白的电泳图,未能给相关研究提供更直观的参考。虽然大部分报道均认为αS1-酪蛋白在SDSPAGE 中的位置高于αS2-酪蛋白,但αS1-酪蛋白的具体位置却存在一定差异,结果如表1 所示。然而,也有部分研究仅根据酪蛋白分子量来判断αS1-酪蛋白在SDS-PAGE 中的理论位置,并认为αS1-酪蛋白(23.6 kDa)的位置低于αS2-酪蛋白(25.2 kDa)[9]或β-酪蛋白(24.0 kDa)[10],结果均与其他研究报道的不一致(表1),表明仅依据分子量是难以准确判断αS1-酪蛋白的纯化结果。此外,本研究所纯化的αS1-酪蛋白的纯度也高于大部分报道的纯度(表1),并对其进行了综合鉴定(图2~4),也展示了αS1-酪蛋白的阴离子交换层析图谱(图1)及其电泳图(图2 与图5),可为相关研究提供直观的参考。

表1 αS1-酪蛋白不同分离纯化方法的对比Table 1 Comparison of different methods for purifying αS1-casein
2.5 兔抗牛乳αS1-酪蛋白多克隆抗体的免疫学性质分析
首先,通过方正滴定法确定最佳抗原包被浓度和二抗稀释倍数,αS1-CN 的包被浓度梯度为4、2、1、0.5 μg/mL;A 兔的二免血清稀释梯度为5000 倍、1 万倍、2 万倍、4 万倍、8 万倍和16 万倍,同时以A 兔的阴性血清作为阴性对照;二抗的稀释梯度为5000 倍和1 万倍,选取OD450nm值为1.0 左右的抗原浓度和二抗稀释倍数为后续实验的工作浓度。根据表2 结果可知,当αS1-酪蛋白的被浓度为0.5 μg/mL,一抗稀释2 万倍,二抗稀释5000 倍时,OD450nm值为1.003。因此,αS1-酪蛋白的最佳包被浓度为0.5 μg/mL,二抗的最佳稀释度为5000 倍。
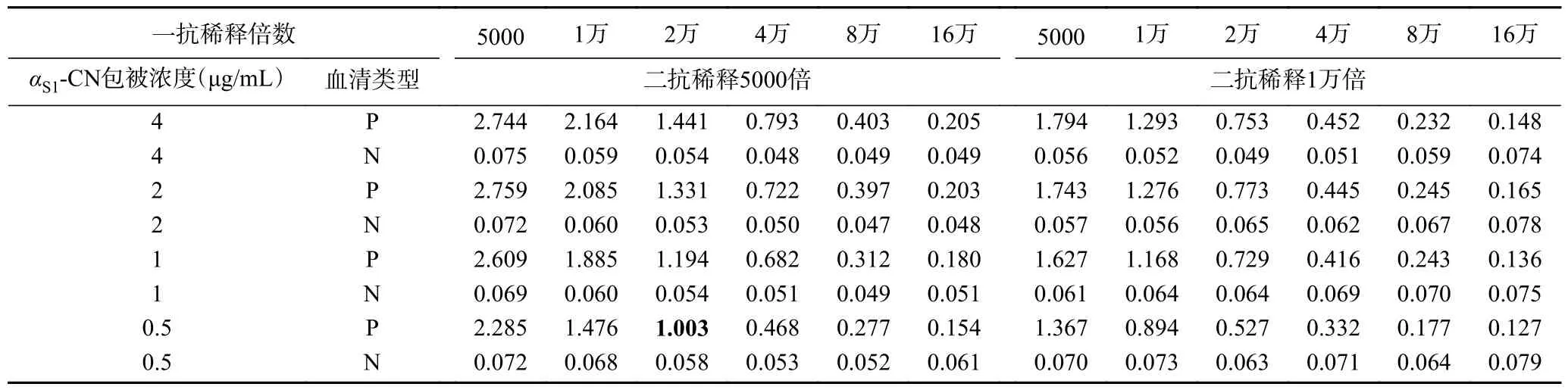
表2 间接ELISA 确定αS1-酪蛋白最佳抗原包被浓度和二抗稀释倍数Table 2 Determination of the best antigen coating concentration of αS1-casein and dilution multiple of HRP-IgG by indirect ELISA
根据方正滴定法确定的αS1-酪蛋白包被浓度和二抗稀释度,利用间接ELISA 监测A 兔和B 兔在免疫过程中抗血清效价的变化,结果如图6 所示。经过5 次免疫后,A 兔和B 兔的最终效价分别为128 万和32 万。A 兔的效价更高,用于后续实验。
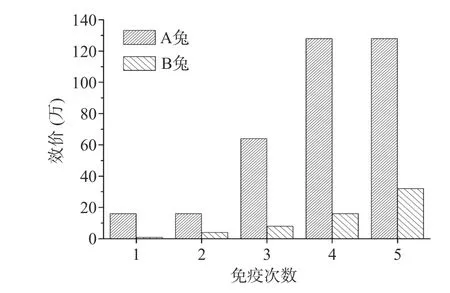
图6 A 兔和B 兔的血清效价Fig.6 The serum titre of rabbit A and rabbit B
以αS1-酪蛋白为包被抗原,以αS1-酪蛋白、α-乳白蛋白、β-乳球蛋白、蛋清蛋白、花生蛋白、大豆蛋白为竞争蛋白,通过竞争抑制ELISA 分析pAb-αS1-CN的特异性,结果如图7 所示。αS1-酪蛋白半抑制浓度(50% inhibition concentration,IC50)为2.38 μg/mL,除了与大豆蛋白有轻微交叉反应外,与其他4 种竞争蛋白均无交叉反应。国内外研究从氨基酸序列对比、动物实验、过敏患者血清实验等方面也证实αS1-酪蛋白与大豆蛋白(如Gly m 5、P34 等)存在交叉反应[30,33−35]。在本研究中,当大豆蛋白浓度为100 μg/mL 时的抑制率为14.41%,低于αS1-酪蛋白浓度为0.25 μg/mL 时的17.52%。由此可推测pAbαS1-CN 与大豆蛋白的交叉反应率低于0.25%。因此,所制备的pAb-αS1-CN 具有高特异性。

图7 pAb-αS1-CN 与食物过敏原蛋白的交叉反应(n=3)Fig.7 Cross-reactivity of pAb-αS1-CN with food allergen proteins (n=3)
3 结论
本研究采用DEAE Sepharose Fast Flow 阴离子交换层析对牛乳αS1-酪蛋白进行了分离纯化,结合酪蛋白的理化性质、SDS-PAGE、免疫学技术和质谱技术对纯化的αS1-酪蛋白进行了综合鉴定,结果表明在4 种酪蛋白中,αS1-酪蛋白的出峰时间最晚、峰面积最大,在SDS-PAGE 中的位置最高。利用酪蛋白不易溶于水的特点,进一步通过透析除去样品中的微量αS2-酪蛋白,最终获得了纯度高达94.26%的αS1-酪蛋白,纯化得率为27.19%。所制备的兔抗αS1-酪蛋白多克隆抗体除了与大豆蛋白存在轻微交叉反应(<0.25%)外,与其他过敏原蛋白没有交叉反应,表明具有高特异性。本研究对纯化的αS1-酪蛋白进行了综合确证,并获得了高纯度的αS1-酪蛋白及其高特异性多克隆抗体,将为αS1-酪蛋白免疫学检测方法的建立提供物质基础,也为其他过敏原蛋白的分离纯化与鉴定提供参考方法。

