不同加工方式对羊肚菌水提液鲜味及抗氧化性能的影响
卢 琪,薛淑静,杨 德,王少华,李 露
(湖北省农业科学院农产品加工与核农技术研究所,湖北武汉 430064)
羊肚菌又称羊蘑、羊肚菜、羊肚蘑等,属子囊菌门羊肚菌科[1],是一种名贵的珍稀食用菌。羊肚菌因味道鲜美,营养丰富,富含蛋白质、多肽、多糖、酚类、维生素和微量元素等,同时兼具营养和药用价值而广受人们的欢迎[2−4]。相关研究证明,羊肚菌具有多种功能活性,如抗氧化、调节免疫力、抗肿瘤、降血脂、降固醇、保肝健胃等[5−7]。此外,羊肚菌因富含氨基酸和呈味核苷酸,味道鲜美,具有风味产品加工潜力。
近年,我国羊肚菌菌种驯化已取得有效进展,种植技术日益成熟,使得国内羊肚菌种植面积日益增加,产量逐年大幅提升[8−9]。目前,国内羊肚菌主要以鲜品、冻品和干品形式在市场上流通,相关精深加工产品主要以羊肚菌辅与禽肉,制作成菌肉汤料包的形式[10−11]。羊肚菌菌汤清淡、细腻、鲜味十足,深受大众喜爱,而羊肚菌菌汤的加工方式和风味成分尚无详细研究。如何通过加工手段获取优质的羊肚菌菌汤是本文研究的关键。
加工手段对羊肚菌营养成分和呈味物质释放的影响是羊肚菌菌汤提质升级的关键。热处理是食用菌菌汤加工的常用手段。随着加工手段的变革,非热加工如超高压、均质及超声处理也常用于食品加工。目前,热加工对羊肚菌菌汤成分影响的研究,仅限于温度、料液比等因素的探讨[9],然而非热加工对羊肚菌品质的影响尚有欠缺。
本文拟采用热加工(70、90 ℃)和非热加工(室温、超声、均质和超高压),处理不同粒径的羊肚菌,制备水提液。对比各水提液的鲜味及抗氧化性能,筛选出最优处理工艺,以期为羊肚菌的精深加工提供参考。
1 材料与方法
1.1 材料与仪器
羊肚菌(Morchella esculenta) 于2019 年12月采收于湖北武汉;呈味核苷酸(5’-CMP、5’-UMP、5’-XMP、5’-GMP、5’-IMP 和5’-AMP)、抗坏血酸、2,2-二苯基-1-苦基肼基(DPPH)、1,3,5-三(2-吡啶基)-2.4.6-三嗪(TPTZ) 源叶生物科技有限公司;游离氨基酸 Sigma-Aldrich 公司;ABTS 试剂盒 上海碧云天生物技术有限公司;甲醇 Fisher 公司。
Multiskan GO 酶标仪 美国Thermo Fisher 公司;LC-20AT HPLC 系统 日本Shimadzu 公司;L-8900 氨基酸分析仪 日本Hitachi 公司;XHF-DY高速均质机 宁波新芝生物科技有限公司;KQ5200DE 超声波清洗仪 昆山市超声仪器有限公司;HPP-650 超高压设备 天津华泰森淼生物工程技术股份有限公司;YR-6L 超微粉碎机 济南银润包装机械有限公司;winner 3003 激光粒度分析仪济南微纳科技有限公司。
1.2 实验方法
1.2.1 不同粒径羊肚菌菌粉制备 新鲜羊肚菌经50 ℃热风干燥后,粉碎,过80 目筛,再进行超微粉碎0、10 和30 min。三种处理对应的羊肚菌粉末粒径D90分别为(180.79±2.05)、(35.52±1.08)和(6.28±0.17)μm,用P1、P2 和P3 代表上述粒径的样品。
1.2.2 羊肚菌水提液制备 采用热加工和非热加工制备羊肚菌水提液。菌粉(1.0 g)经蒸馏水(30 mL)浸泡0.5 h 后,进行下述处理:a.热处理,上述混合物置于磁力搅拌器,70 和90 ℃条件下700 r/min 搅拌1 h。处理结束后样品立即用冷水冷却,抽滤;b.超声处理(UT),上述混合物置于超声清洗仪,40 kHz 下于室温下提取1 h,冷却,抽滤;c.均质(HG),上述混合物置于均质机,18000 r/min 条件下室温处理3 min,间歇处理2 次,合并冷却后抽滤;d.超高压处理(HHP),上述混合物置于超高压装置内,500 MPa 室温保持10 min;冷却后抽滤;e.室温(RT),上述混合物置于磁力搅拌器,700 r/min 搅拌1 h,抽滤,以该处理为对照。
1.2.3 5’-核苷酸分析 采用HPLC 检测羊肚菌水提液中5’-核苷酸[12−13]。将上述上清液过0.22 μm 有机滤膜,进样分析。流动相为A:20 mmol/L 磷酸盐缓冲液(pH5.9)和B:100%甲醇,比例为97:3(A:B,v:v)。流速 0.5 mL/min,进样量为10 μL,运行30 min,在254 nm 处进行紫外检测。通过各成分的标准曲线进行定量分析,结果折算为每100 克菌粉中5’-核苷酸毫克数(mg/100 g DW)。
1.2.4 游离氨基酸(FAA)分析 采用氨基酸分析仪检测羊肚菌水提液中FAA 含量[14]。将5.0 mL 上清液与相同体积的10%三氯乙酸混合,并在室温下放置2 h,10000 r/min 离心5min,收集上清,调整pH 至2.2,过0.22 μm 滤膜,注入氨基酸分析仪进行分析。结果折算为每100 克菌粉中FAA 毫克数(mg/100 g DW)。
1.2.5 等鲜度EUC 计算 由鲜味氨基酸(Glu 或Asp)与5’-核苷酸之间的相互作用计算等鲜度EUC,根据以下方法计算,表示为每100 g 样品中谷氨酸钠的含量(g)[15−16]:
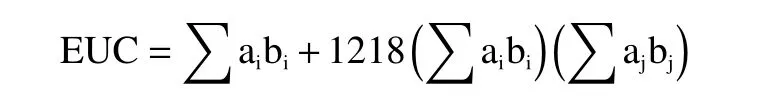
其中,ai是鲜味氨基酸(Glu 或Asp)的浓度(g/100 g);aj是鲜味5’-核苷酸(5’-GMP、5’-AMP、5’-IMP 或5’-XMP)的浓度(g/100 g);bi是鲜味氨基酸的鲜味相对浓度(Asp,0.077 和Glu,1);bj是5'-核苷酸的相对鲜味浓度(5’-IMP,1;5’-GMP,2.3;5’-AMP,0.18;5’-XMP,0.61);1218 是协同作用常数。
1.2.6 抗氧化能力分析 参考前人的研究,分别采用DPPH、FRAP 和ABTS 法,综合评价羊肚菌水提液的抗氧化能力[17−19]。DPPH 自由基清除能力和FRAP 铁离子还原能力均以每毫升水提液中抗坏血酸当量表示(μmol AAE/mL),ABTS 自由基清除能力以每毫升水提液中Trolox 当量表示(μmol TE/mL)。
1.3 数据处理
实验数据重复三次取平均值。采用Duncan 分析进行样本差异性分析(IBM SPSS Statistics 20.0),P<0.05 为显著性差异。采用HemI(Heatmap Illustrator,version 1.0)用于热图分析。
2 结果与分析
2.1 各处理条件下羊肚菌水提液5’-核苷酸含量
通过HPLC 分析,羊肚菌水提液中主要包含5’-CMP、5’-UMP、5’-XMP、5’-GMP、5’-IMP 和5’-AMP 等6 种5’-核苷酸,这几种成分标品的色谱图如图1 所示,水提液中各5’-核苷酸含量详见表1。70 ℃-P1、P2 的水提液中5’-核苷酸总含量(1432.34、1473.88mg/100 g DM)要显著(P<0.05)高于其它处理(682.53 mg/100 g DM~1221.00 mg/100 g DM)。5’-GMP 是食用菌呈鲜味物质的主要贡献成分[20],该成分在90 ℃热处理条件下的含量(128.31 mg/100 g DM~194.36 mg/100 g DM)显著(P<0.05)高于其它处理(7.50 mg/100 g DM~79.14 mg/100 g DM),推测高温处理有利于5’-GMP 溶出至水提液。
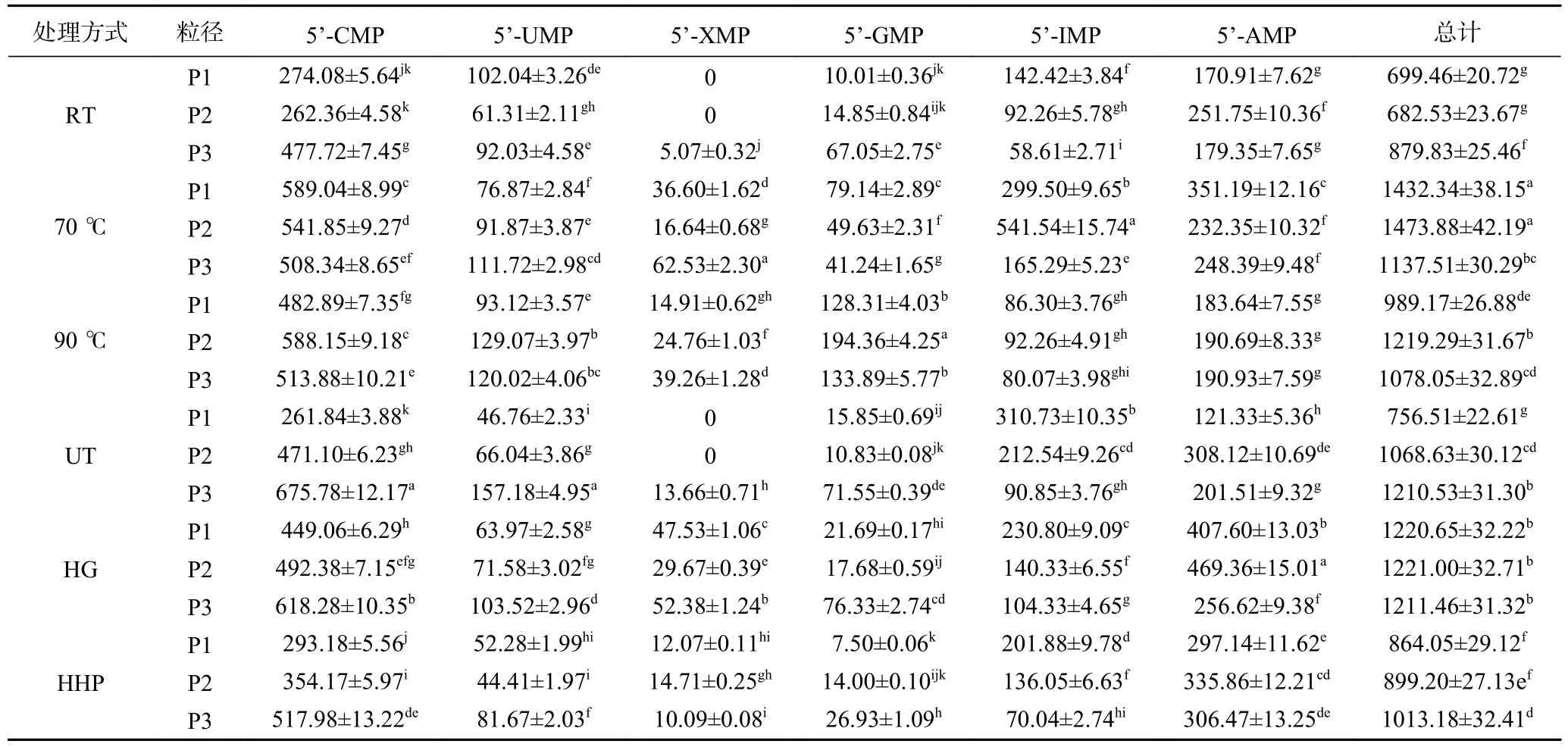
表1 不同加工方式对羊肚菌水提液中5’-核苷酸含量的影响 (mg/100 g DM)Table 1 Effects of different processing methods on 5’-nucleotide content in Morchella esculenta water extract (mg/100 g DM)
图1 5’-核苷酸标准品的液相色谱图Fig.1 HPLC chromatogram of 5’-nucleotide standards
70、90 ℃和HG 处理条件下,5’-核苷酸总含量随着粒径的减小呈现先增后减的趋势,而UT 和HHP 处理中5’-核苷酸总含量随着粒径的减小而增加。推测过度粉碎的菌粉(P3)在70、90 ℃和HG处理下,可能导致5’-核苷酸的破坏,而相对温和的非热处理UT 和HHP,会进一步促进菌粉(P3)中5’-核苷酸的溶出。与未超微粉碎相比(P1),超微粉碎(P2 或P3)不同程度地提升羊肚菌水提液5’-核苷酸含量。5’-IMP 是除了5’-GMP 外的鲜味贡献成分,5’-IMP 经过脱氨基作用生成5’-AMP,具有抑制苦味突出甜味的作用[21]。本研究中70 ℃-P2 中5’-IMP含量最高(541.54 mg/100 g DM),而HG-P2 中5’-AMP含量最高(469.36 mg/100 g DM),可能是由于HGP2 条件下5’-IMP 能更有效地转化为5’-AMP。5’-CMP 和5’-UMP 对食用菌鲜味成分无贡献,二者均在UT-P3 中含量丰富。5’-XMP 对食用菌鲜味的贡献介于5’-IMP 和5’-AMP 之间,该成分占5’-核苷酸中含量较低,RT 和UT 处理中仅在超微粉P3 中微量检测到,而70 ℃-P3 中5’-XMP 的含量最高,也仅占5’-核苷酸的5.50%,该结论与前人的研究结果一致[22]。
2.2 各处理条件下羊肚菌水提液离氨基酸(FAA)含量
游离氨基酸能为食用菌水提液提供鲜味成分和愉悦的口感。不同加工方式得到羊肚菌水提液中游离氨基酸含量如表2 所示。超高压(HHP)是一种非热处理技术,能保持食品的感官特性和营养价值,该技术能通过破坏细胞壁、提高细胞膜通透性来提高有效成分的溶出[23]。三种粒径下,超高压技术处理得到的羊肚菌水提液中总游离氨基酸的含量(4264.19 mg/100 g DM~5882.81 mg/100 g DM)要显著高于其它处理(P<0.05),其中鲜味氨基酸(1513.28 mg/100 g DM~2191.22 mg/100 g DM)和甜味氨基酸含量(1075.68 mg/100 g DM~1684.18 mg/100 g DM)尤为丰富。本研究的水提液中尚未检测到脯氨酸(Pro)、精氨酸(Arg)和蛋氨酸(Met),而张楠等[9]在羊肚菌的菌柄中检测到上述成分。范婷婷等[24]在人工栽培的羊肚菌中未发现脯氨酸(Pro)和色氨酸(Trp),但在野生羊肚菌中各类氨基酸均能检测到。推测产生上述差异的原因可能与羊肚菌的检测部位、提取方式、种植手段和种植环境有关。
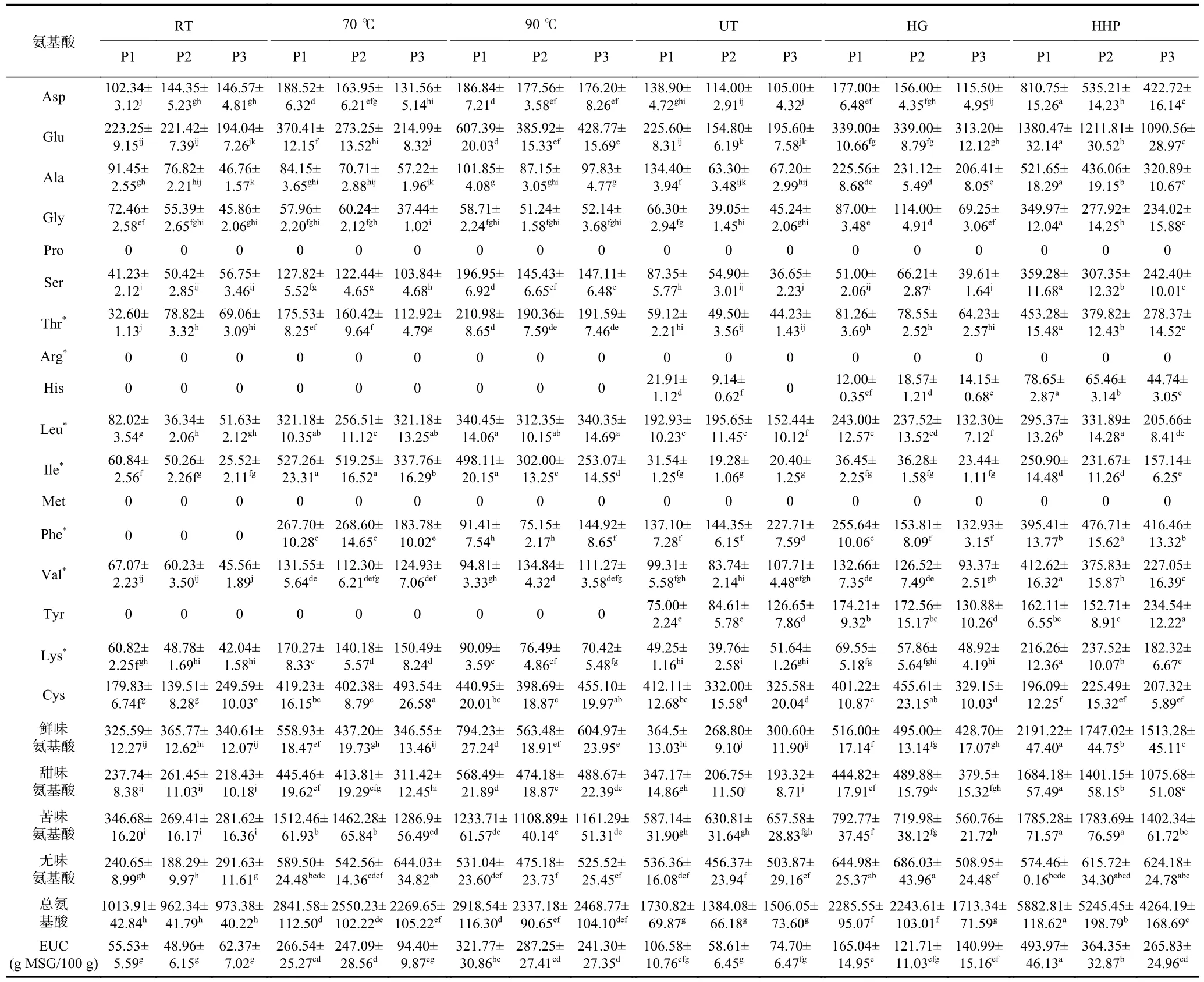
表2 不同加工方式对羊肚菌水提液中游离氨基酸含量的影响 (mg/100 g DM)Table 2 Effects of different processing methods on FAA content in Morchella esculenta water extract (mg/100 g DM)
各处理条件下,超微粉碎均降低了游离氨基酸的总含量,尤其70 ℃、UT、HG 和HHP 处理中游离氨基酸的总含量随着粒径的减小而呈降低的趋势,其中HHP-P1 中游离氨基酸总含量最高。P1 条件下各处理的总游离氨基酸含量最高,排序为:HHP>90 ℃>70 ℃>HG>UT>RT。水提液加热过程中发生Strecker降解和Maillard 反应,降低水提液中FAA 含量,但同时也能通过加热促进蛋白质水解,也可能增加水提液中FAA 含量[25]。本研究中除了HHP 外,各粒径条件下,热处理水提液中FAA 的含量要高于其它处理,推测是加热过程中其蛋白质水解产生的氨基酸含量高于其氨基酸降解量,其中热处理水提液中鲜味氨基酸Asp,甜味氨基酸Ser、Thr,苦味氨基酸Leu、Ile,无味氨基酸Lys、Try 含量丰富。前人对新鲜的羊肚菌进行热处理制作菌汤研究,其中必需氨基酸中Thr 和Lys 含量丰富,与本研究结果一致[10],而其他非热处理获取羊肚菌水提液成分的相关研究相对欠缺。
RT 和HHP 处理中,鲜味氨基酸分别占32.01%~38.11%,33.31%~37.25%,是FAA 中的主要成分,而其它处理中鲜味氨基酸仅占12.26%~27.21%。相对于非热处理,热处理(70、90 ℃)增加了水提液中苦味氨基酸的比例32.27%~57.33%。通过等鲜度EUC 的计算,各处理的EUC 值为48.96~493.97 g MSG/100 g,HHP 处理下,各粒径菌粉的EUC 值(265.83~493.97 g MSG/100 g)要显著高于(P<0.05)其它处理(48.96~287.25 g MSG/100 g),其中,RT 处理下EUC 值最低(48.96 g MSG/100 g)。除RT 外,超微粉碎虽然提升羊肚菌水提液5’-核苷酸含量,但降低了提取液中呈鲜味氨基酸和总游离氨基酸(FAA)含量,使得菌粉的EUC 值从106.58 g MSG/100 g~493.97 g MSG/100 g 降低至74.70 g MSG/100 g~364.35 g MSG/100 g,推测超微粉碎可能破坏了羊肚菌的鲜味。由此,P1 条件下羊肚菌EUC 最佳,排序为:HHP>90 ℃>70 ℃>HG>UT>RT,与总FAA 含量排序一致。鲜味氨基酸和5’-核苷酸能够协同作用增强样品鲜味[26],本研究中Glu 含量丰富且鲜味相对浓度为1,是水提液中主要的鲜味贡献成分,热处理过程中此类成分大量游离,其含量远高于其它处理(除HHP 外)。热加工提升了水提液EUC 值,但仍显著小于HHP 处理(P<0.05),HHP 处理丰富了水提液鲜味成分且HHP-P1 的EUC值最高(493.97 g MSG/100 g)。
2.3 羊肚菌水提液成分的热图分析
为了更直观表述18 种处理方法中羊肚菌水提液中的氨基酸和核苷酸分布情况,采用热图分析法对结果进行分析。如图2 所示,热图中越接近蓝色表示成分含量越低,越接近红色表示成分含量越高。由图可见,各处理中超高压处理HHP 中各氨基酸含量较为丰富,尤其鲜味氨基酸谷氨酸含量尤其显著。为了进一步比较各加工手段对成分含量的影响,利用热图进行聚类分析。除超高压处理外,其它加工手段可单独聚为一簇,说明加工特性能直接影响羊肚菌水提液的成分分布。具体而言,超高压处理HHP 单独聚为一类,该处理中各成分含量丰富,鲜味突出。热加工(70 和90 ℃)聚为一大类,鲜味次之。其它非热处理(UT-P1 除外),聚为一类,鲜味较差。就处理方法对羊肚菌水提液鲜味成分影响的排序为:超高压处理>热处理>其它非热处理。
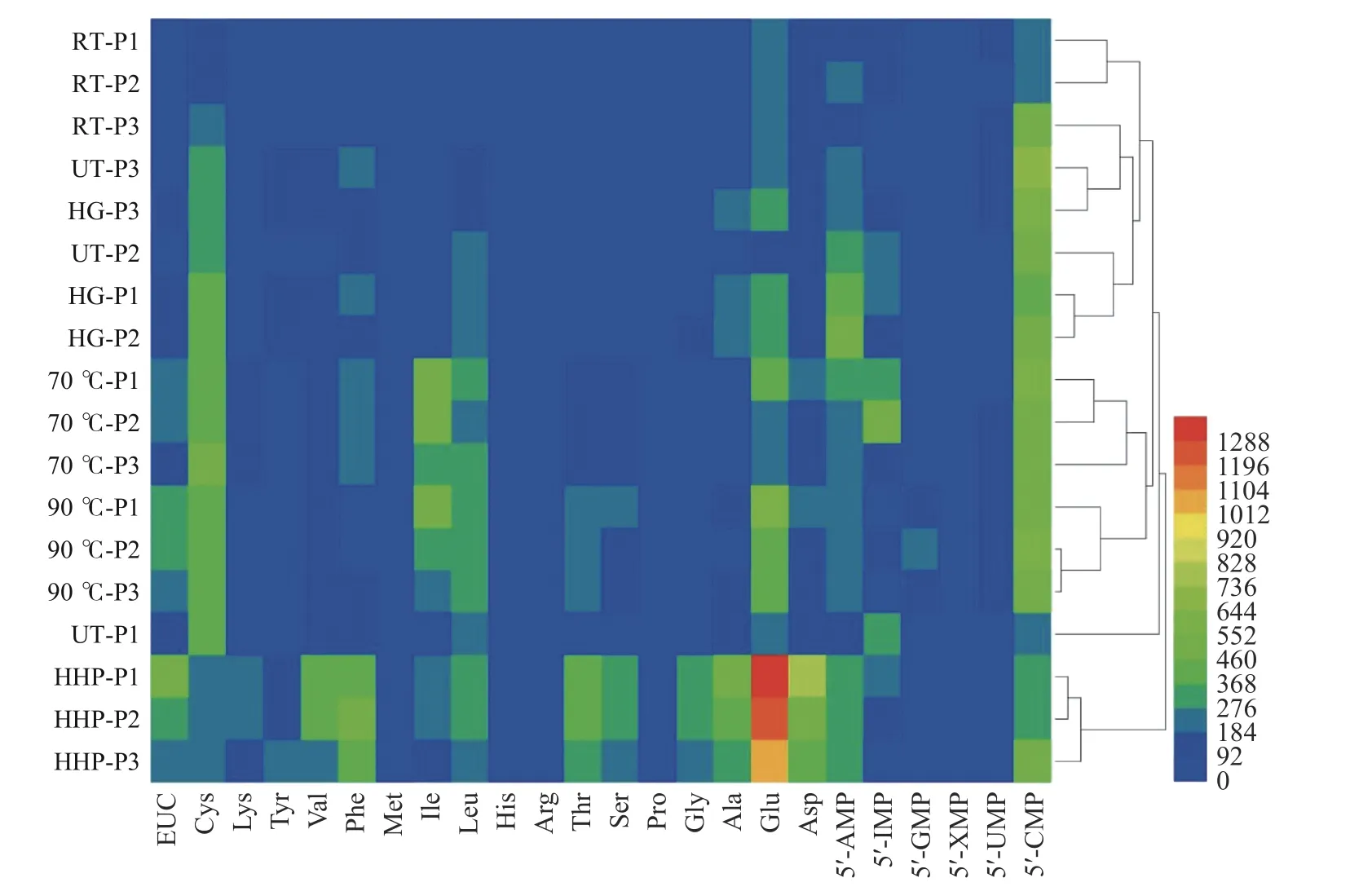
图2 羊肚菌水提液中氨基酸和核苷酸含量的热图分析Fig.2 Heat map analysis of free amino acid and nucleotide content in the water extracts of Morchella esculenta
2.4 抗氧化能力分析
本研究通过DPPH、FRAP 和ABTS 三种手段,综合评价各羊肚菌水提液的抗氧化能力,如表3所示。其中,DPPH 法代表了样品清除自由基的能力,FRAP 法展现了体系的还原能力,而ABTS 法反映体系的总抗氧化能力[27]。本研究中除了热处理外,其它非热加工(RT、UT、HG 和HHP)水提液的DPPH、FRAP 和ABTS 值均随着菌粉的粒径减小而呈下降趋势,可能是由于超微粉碎过程中的剧烈处理破坏了菌粉中的天然活性成分,如酚类、甾醇、氨基酸等。热处理常被证明能破坏食品体系的抗氧化能力[28−29],本研究热处理同样降低了水提液的抗氧化能力,同一粒径下热处理水提液的FRAP和ABTS 值均要低于其它处理。HHP 处理下,各粒径水提液的抗氧化能力均要优于其它处理,推测HHP处理更有利于抗氧化成分在水提液中溶出。HHPP1 具有最高的抗氧化能力,该处理下羊肚菌水提液的DPPH、FRAP 和ABTS 值要显著(P<0.05)高于其它处理。
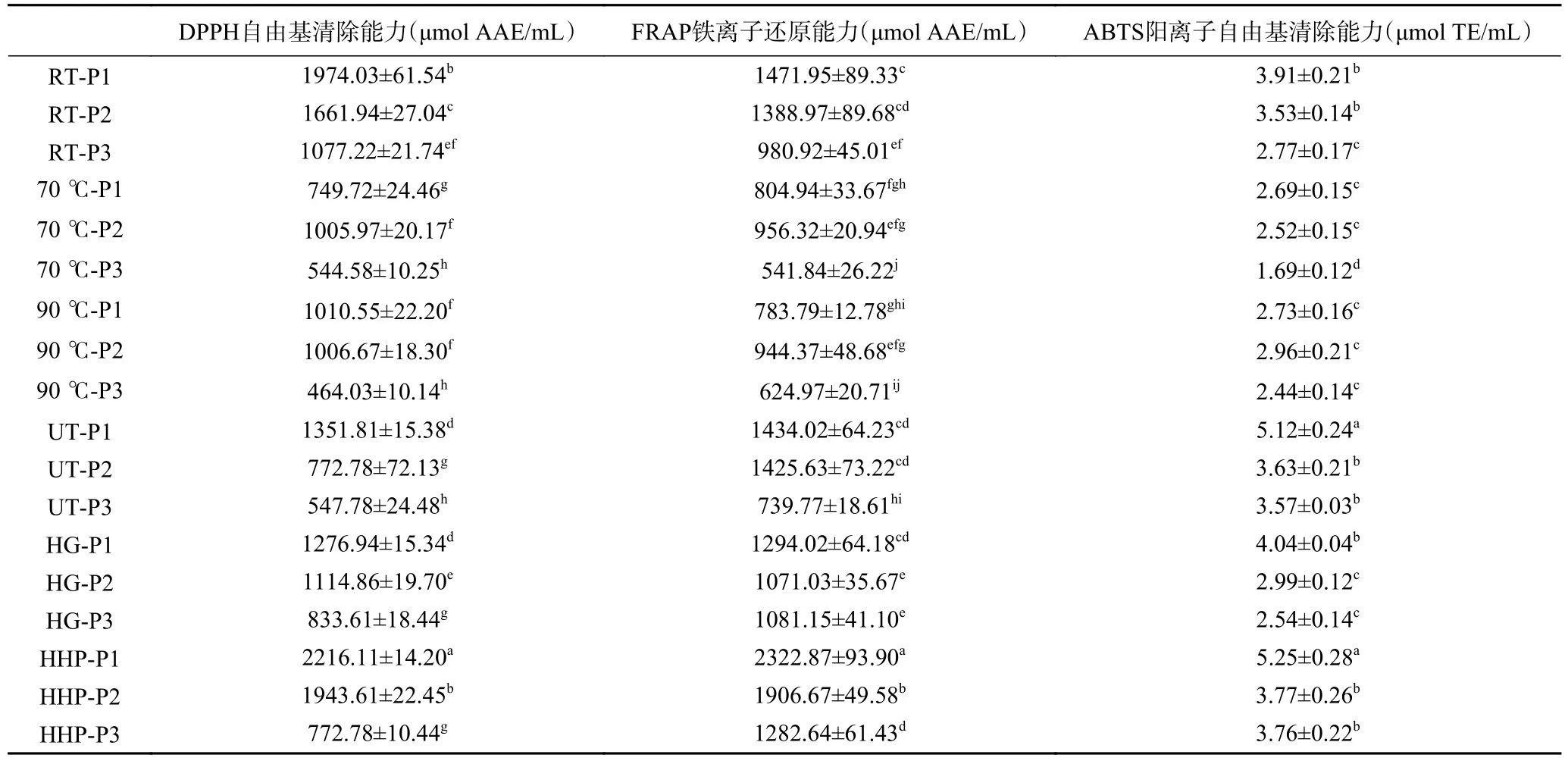
表3 不同处理条件下羊肚菌提取液抗氧化能力对比Table 3 The comparison of antioxidant abilities of Morchella esculenta extracts processed by different methods
3 结论
本文研究结果表明,超微粉碎处理组(P2 或P3)不同程度地提升了羊肚菌水提液中5’-核苷酸含量,但超微粉碎对羊肚菌水提液中FAA 总含量具有破坏性,未超微粉碎条件下(P1)各处理FAA 总含量最高,排序为:HHP>90 ℃>70 ℃>HG>UT>RT;90 ℃热处理条件下,羊肚菌水提液中鲜味主要贡献成分成分5’-GMP 的含量显著(P<0.05)高于其它处理,而非热处理HHP 显著(P<0.05)提升了肚菌水提液中鲜味氨基酸含量,使得该处理条件下各组羊肚菌水提液均有最优的EUC 值;热处理整体降低了羊肚菌水提液抗氧化能力。最终研究结果发现,HHP-P1 具有最高EUC 值和抗氧化能力,适用于羊肚菌水提液加工。本研究为羊肚菌的精深加工提供参考。

