六味地黄汤对IgA肾病大鼠α-SMA及FN表达的影响
六味地黄汤对IgA肾病大鼠α-SMA及FN表达的影响
彭亚军1,李旭华1,何泽云1*,廖春来1,何雅琴1,胡淑娟2
(1.湖南中医药大学第一附属医院,湖南长沙410007;2.湖南中医药大学,湖南长沙410208)
〔摘要〕目的观察六味地黄汤对IgA肾病大鼠α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)及纤维连接蛋白(fibronectin,FN)表达的影响,进一步探讨其可能作用机制。方法SD大鼠40只随机分为正常对照组、模型组、雷公藤多苷片组,六味地黄汤组。除正常对照组外均采用牛血清白蛋白+脂多糖+四氯化碳方法建立实验性IgA肾病模型。造模成功后分组干预连续灌胃4周,分别在每周末检测尿蛋白定量及尿红细胞计数,第4周末处死各组大鼠,进行肾功能检测。采用免疫组化、Western blot检测各组α-SMA及FN蛋白表达,进行半定量分析。结果各组尿蛋白定量及尿红细胞计数比较,模型组较正常组显著升高(P<0.05),而六味地黄汤组与模型组比较显著降低(P<0.05),差异有统计学意义;各组α-SMA和FN表达,模型组较正常组表达显著升高(P<0.05),而六味地黄汤组较模型组表达下降,(P<0.05)差异有统计学意义。结论六味地黄汤可减少IgA肾病大鼠尿蛋白及尿红细胞数,改善其肾功能,可能与通过下调α-SMA及FN表达相关。
〔关键词〕IgA肾病;六味地黄汤;α-平滑肌肌动蛋白;纤维连接蛋白
Effects of Liuwei Dihuang Decoction onthe Expression of α-SMA and FN in IgA Nephropathy Rats
PENG Yajun1,LI Xuhua1,HE Zeyun1*,LIAO Chunlai1,HE Yaqin1,HU Shujuan2
(1. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007,China;2. Hunan University of Chinese Medicine, Changsha, Hunan 410208,China)
〔Abstract〕Objective To observe the effects of Liuwei Dihuang Decoction on the expression of α-SMA and fibronectin (FN) in IgA nephropathy rats, and further investigate its possible mechanism. Methods Forty SD rats were equally randomly divided into 4groups: the normal group, model group, tripterygium glycosides tablets group and Liuwei Dihuang Decoction group. IgAN rat models were established with bovine serum albumin (BSA), lipopolysaccharide (LPS) and carbon tetrachloride (CCl4). The successfully established models were given 4weeks of continuous perfusion. The proteinuria and urinary red blood cell count were detected every week, respectively. At fourth weekend, all the rats were killed for kidney function test. The α-SMA and FN protein expression of each group were detected by using immunohistochemistry and Western blot, and semi-quantitative analysis was made. Results The urine protein and urine red blood cell countsin each group were compared, the model group was higher significantly than that of normal group(P <0.05), while compared with mode group, Liuwei Dihuang Decoction group was decreased significantly(P <0.05), the difference was statistically significant.The α-SMA and FN expression in model group were increased than that in the normal group, while the expression of Liuwei Dihuang decoction group was decreased comparing with the model group(P<0.05), the difference was statistically significant. Conclusion Liuwei Dihuang Decoction can reduce the urine protein and urine red blood cell count of IgA nephropathy rats and improve the kidney function, which may be related with down-regulation of α-SMA and FN expression.
〔Keywords〕IgA nephropathy; Liuwei Dihuang Decoction;α-smooth muscle actin; fibronectin
IgA肾病是一组以肾小球系膜区IgA沉积、同时伴有系膜细胞增生和系膜基质扩张为主要病理改变的原发性肾小球肾炎,其临床表现多种多样,主要表现为血尿,可伴有不同程度的蛋白尿、高血压和肾功能受损,是导致终末期肾病常见的原发性肾小球疾病之一[1]。IgA肾病的病因及发病机制均尚未明确,多种因素可导致IgA肾病的发生发展,而系膜细胞增殖及细胞外基质(extracellular matrix,ECM)沉积是导致肾小球硬化甚至肾功能衰竭的主要因素。临床及实验研究表明[2-3]六味地黄丸为防治慢性肾脏病有效方药之一,本实验将通过研究六味地黄汤对IgA肾病大鼠α-平滑肌肌动蛋白(αsmooth muscle actin,α-SMA)及纤维连接蛋白(fibronectin,FN)表达的影响,探讨其可能作用机制,为其临床运用提供进一步理论依据。
1 材料与方法
1.1实验动物
清洁级雄性SD正常大鼠40只,体质量(150± 20)g,购于长沙斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2011-0003。
1.2实验药物
六味地黄汤(熟地黄24g、山茱萸12g、山药12g、泽泻9g、茯苓9g、牡丹皮9g),均购自湖南中医药大学第一附属医院药剂科,经水煎、过滤、浓缩至1g/mL,置4℃冰箱保存。雷公藤多苷片,生产厂家:江苏美通制药有限公司,批号:Z32021007。
1.3主要试剂
牛血清白蛋白(bovine serum albumin,BSA),美国MBCHEM公司;四氯化碳(carbon tetrachloride,CCl4),脂多糖(lipopolysaccharide, LPS),美国Sigma公司;兔抗大鼠α-SMA单克隆抗体,美国Cell Signaling Technology公司;兔抗大鼠FN单克隆抗体,美国Abcam公司;大鼠Anti-beta-Actin单克隆抗体,康为世纪生物技术有限公司;免疫组化试剂盒PV6300、SABC试剂盒及DAB显色试剂盒均采购于北京中杉金桥生物技术有限公司;尿蛋白定量、血肌酐及尿素测定试剂盒均采购南京建成生物工程研究所。
1.4主要仪器
RT-1904C半自动生化仪,美国雷杜;R/S 2003UF尿沉渣分析仪,美国戴西斯;电泳仪,美国Bio-Rad公司;转膜仪,美国Bio-Rad公司;WD-9405A脱色摇床,沃德生物医学仪器公司;倒置显微镜IX51,日本Olympus公司;IPP6.0医学图像分析系统,美国Media Cybermetics公司;Gel pro4.0图像分析软件,美国Media Cybermetics公司。
1.5分组、造模及给药
大鼠按随机数字表法分为正常对照组、模型组、六味地黄汤组、雷公藤多苷组,每组10只。除正常对照组外,其他组根据文献[4],运用BSA+LPS+ CCl4方法建立实验性IgA肾病模型,方案如下:口服免疫原BSA 400mg/kg隔天灌胃,持续6周;皮下注射蓖麻油0.5mL+CCl40.10mL,每周1次,持续9周;并联合运用LPS(分别于第6、8周以LPS 0.05mg尾静脉注射)。造模成功后连续灌胃4周,六味地黄汤组予以六味地黄汤灌胃,剂量为6.75g/kg生药,相当于60kg体质量成人每天75g生药的等效剂量,模型组及正常组用等体积蒸馏水灌胃,雷公藤多苷片组6mg/(kg·d)溶于等体积生理盐水灌胃,各组每天灌胃1次。
1.6观察指标及方法
1.6.1尿红细胞及尿蛋白定量检测每周末用代谢笼收集尿液,用量筒测定尿量,采用CBB法检测尿蛋白定量,将收集尿液5mL先以1500转/min离心5min,倾取上清液,用管底的沉渣以尿沉渣分析仪进行分析尿红细胞计数。
1.6.2肾功能检测采用美国雷杜半自动生化仪,苦味酸法检测血肌酐,酶偶联速率法检测尿素氮。
1.6.3免疫组织化学法检测实验结束后取左肾皮质,置入40g/L多聚甲醛液中于4℃下固定24h,常规脱水,石蜡包埋后行冠状位切片,片厚3~4μm。切片常规脱蜡至水;置于二甲苯前用烤箱加热30min;经30%H2O2甲醇处理,室温孵化20min以灭活内源性过氧化物酶;微波炉加热修复抗原;每张切片滴加一滴山羊血清封闭,置于湿盒中封闭30min;滴加一抗α-SMA或FN(工作浓度约为1:200)后放置于免疫组化保湿盒37℃孵育2h;充分漂洗;加入相应生物素化二抗;37℃孵育30min,PBS洗涤;DAB显色:苏木素轻度复染,脱水,透明,中性树胶封片。光镜下观察,阳性染色细胞胞浆或胞膜出现黄色或棕黄色颗粒,胞核呈蓝色。采用IPP6.0医学图像分析系统,每个组分别选取5张切片,每张切片随机选取5个肾皮质视野,测定阳性着色平均光密度(OD)值进行图像分析。
1.6.4Western blot法检测从-80℃取100mg肾组织皮质放入研钵中,用研磨棒碾碎成粉末,最后将碾碎的组织粉末转移至加入1mL裂解液的EP管中,4℃,12000转/min,离心5min,取上清液,采用BCA法蛋白浓度的测定;SDS-PAGE转膜印迹;用5%脱脂奶粉室温封闭1h;用PBST配置的封闭液稀释α-SMA(1:1000)、FN(1:1000),betaactin(1:1500),4℃中孵育过夜,孵育结束后用TBST在室温下脱色摇床上洗3次;二抗用PBST稀释至适当浓度,孵育步骤同一抗,二抗室温下孵育1h后,用PBST在室温下脱色摇床上洗3次;应用ECL法进行显影检测。采用图像分析软件Gel pro4.0进行平均光密度值(integrated optical density,IOD)分析。用以所测得的各指标的平均光密度值与相应的内参照平均光密度值的比值代表目的蛋白的相对表达量。
1.7统计方法
2 结果
2.1一般情况观察
造模后,模型组大鼠造模前4周饮食饮水、毛发色泽、活动度、外界反应情况均未见明显变化;在造模第4周模型组个别大鼠不同程度的食欲差、毛色杂乱、精神萎靡蜷缩,活动度下降,在第6周后上述情况有所改善,第4周模型组死亡1只,其原因不明,正常对照组大鼠饮食饮水精神及活动度均正常,无大鼠死亡。
2.2各组大鼠给药后尿红细胞计数变化情况
模型组在第1、2、3及4周末尿红细胞计数均显著高于正常对照组(P<0.05);六味地黄汤组第1周末尿红细胞计数与模型组及雷公藤多苷片组比较无显著变化,差异无统计学意义(P>0.05);六味地黄汤组在第2、3、4周末与模型组相比较,尿红细胞计数低于模型组,且差异有统计学意义(P<0.05);六味地黄汤组在第2、3、4周末与雷公藤多苷片组相比,尿红细胞计数均高于雷公藤多苷片组,差异有统计学意义(P<0.05);六味地黄汤组第4周末与第1周末前后比较,尿红细胞计数明显减少,差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠尿红细胞计数变化情况 (±s,个/μL)

表1 各组大鼠尿红细胞计数变化情况 (±s,个/μL)
注:与正常对照组比较△P<0.05;与模型组比较□P<0.05;与雷公藤多苷片组比较#P<0.05;与六味地黄汤组第1周比较▲P<0.05。
组别 第1周 第2周 第3周 第4周正常对照组模型组雷公藤多苷片组六味地黄汤组8.1±1.6320.4±15.4△308.1±17.8316.9±15.98.7±2.2335.0±21.6△289.9±15.7305.4±15.1#□9.6±1.8334.0±32.9△263.7±22.9281.4±18.3#□10.5±2.7344.1±21.16△187.7±16.5238.1±15.5#□▲
2.3各组大鼠给药后24小时尿蛋白定量变化情况
模型组在第1、2、3及4周末尿蛋白定量均显著高于正常对照组(P<0.05);六味地黄汤组第1周末尿蛋白定量与模型组及雷公藤多苷片组比较无显著变化,差异无统计学意义(P>0.05);六味地黄汤组在第2、3、4周末与模型组相比较,尿蛋白定量显著低于模型组,且差异有统计学意义(P<0.05);六味地黄汤组在第2、3、4周末与雷公藤多苷片组相比,尿蛋白定量均高于雷公藤多苷片组,差异有统计学意义(P<0.05);六味地黄汤组第4周末与第1周末前后比较,尿蛋白显著减少且差异有统计学意义(P<0.05)。见表2。
表2 各组大鼠给药后24小时尿蛋白定量变化情况(±s,mg)

表2 各组大鼠给药后24小时尿蛋白定量变化情况(±s,mg)
注:与正常对照组比较△P<0.05;与模型组比较□P<0.05;与雷公藤多苷片组比较# P<0.05;与六味地黄汤组第1周比较▲P<0.05。
组别 第1周 第2周 第3周 第4周正常对照组模型组雷公藤多苷片组六味地黄汤组2.01±0.4116.62±1.65△14.01±0.9115.26±0.881.83±0.3818.48±1.15△11.96±1.3213.56±1.19#□1.91±0.2619.54±1.42△10.65±0.5412.92±1.32#□1.97±0.2021.56±1.66△9.27±0.8512.57±1.29#□▲
2.4各组大鼠给药后肾功能测定
六味地黄汤组及雷公藤多苷片组BUN、Cr含量较模型组无明显下降,差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠给药后肾功能比较 (±s)

表3 各组大鼠给药后肾功能比较 (±s)
组别n BUN(mmol/L)Cr(umol/L)正常对照组模型组雷公藤多苷片组六味地黄汤组10910103.92±0.678.03±0.867.05±0.787.42±0.5032.35±5.1372.50±4.7366.20±3.5069.64±2.31
2.5各组大鼠肾脏组织α-SMA及FN表达情况
2.5.1各组免疫组织化学检测α-SMA及FN表达与分析正常对照组肾小球、肾小管及肾间质α-SMA及FN基本不表达;模型组肾小球系膜区、肾小管及间质均有大量棕褐色阳性表达,雷公藤多苷片组及六味地黄汤组肾小球系膜区及小管间质均较模型组表达弱;经半定量分析,六味地黄汤组α-SMA及FN表达与模型组相比明显降低,且差异有统计学意义(P<0.05);与雷公藤多苷片组相比,六味地黄汤组α-SMA及FN表达较高,且差异有统计学意义(P<0.05)。见表4,图1-2。
表4 各组大鼠肾脏组织α-SMA表达平均光密度比较 (±s)

表4 各组大鼠肾脏组织α-SMA表达平均光密度比较 (±s)
注:与模型组比较*P<0.05;与雷公藤多苷片组比较#P<0.05。
组别正常对照组模型组雷公藤多苷片组六味地黄汤组F值n 1091010α-SMA OD值259.07±12.40736.85±79.68590.88±40.77654.74±36.82*#13.245FN OD值19.23±3.99120.81±8.2981.46±10.08104.81±9.36*#16.746
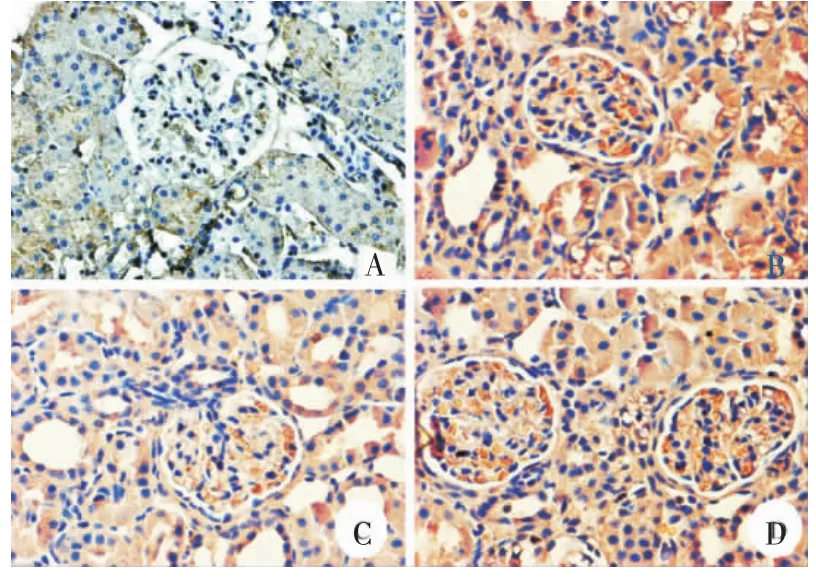
图1 各组免疫组化α-SMA光镜图(×400)

图2 各组免疫组化FN光镜图(×400)
2.5.2各组Western blot检测α-SMA及FN表达与分析正常对照组α-SMA及FN蛋白表达水平低,与模型组、雷公藤多苷片组、六味地黄汤组比较,差异有统计学意义(P<0.05);与模型组相比较,六味地黄汤组α-SMA及FN蛋白表达下降,差异有统计学意义(P<0.05);六味地黄汤组α-SMA及 FN蛋白表达较雷公藤多苷片组升高,差异有统计学意义(P<0.05)。见图3,表5。
表5 各组大鼠肾脏组织α-SMA蛋白相对表达量比较(±s)

表5 各组大鼠肾脏组织α-SMA蛋白相对表达量比较(±s)
注:与模型组比较*P<0.05;与雷公藤多苷片组比较#P<0.05。
组别正常对照组模型组雷公藤多苷片组六味地黄汤组F值n 1091010α-SMA/β-actin 0.172±0.0480.797±0.1110.461±0.0750.648±0.090*#9.231FN/β-actin 0.167±0.0611.182±0.2170.732±0.1100.929±0.080*#7.453

图3 各组大鼠肾组织Western blot检测α-SMA及FN蛋白表达电泳图
3 讨论
IgA肾病发病机制尚不明确,多种因素可导致IgA肾病的发生发展,可能的遗传因素、上呼吸道感染所产生的细胞因子以及其他未知的因素导致免疫球蛋白IgA的血清含量增加以及O-糖链的糖基化异常、而不能被正常清除,循环到达肾脏,通过肾小球毛细血管孔径较大的内皮连接,沉积系膜区,激活系膜细胞,导致系膜细胞增殖和分泌表型的改变,从而导致系膜细胞分泌大量的物质,调节炎症反应,以及肾小球微循环和ECM的沉积,影响肾小球功能[5]。
研究表明[6],细胞外基质合成增加或降解减少,均可导致肾小球或肾间质过度沉积,最终形成肾小球硬化或肾间质纤维化。正常情况下,肾小球系膜细胞维持收缩、吞噬和保持ECM正常代谢功能,但在病理情况下,系膜细胞受到一些因素的刺激后可发生明显增殖,并产生细胞因子和ECM,细胞因子又能进一步刺激系膜细胞进一步增殖和产生更多的ECM,导致ECM积聚[7]。体内外实验均表明,肾小球系膜细胞在一定条件下可发生表型转化,转化为肌成纤维细胞(myofibroblast,MFB)[8]。肌成纤维细胞具有平滑肌细胞和成纤维细胞的特性,既具有收缩功能,又能产生胶原和ECM成分,α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)是肌成纤维细胞表型标志,体内静息状态的成熟肾小球系膜细胞没有或极少表达α-SMA,但是,在IgA肾病时,肾小球系膜细胞表达α-SMA明显增加,并出现增殖和分泌大量ECM。Silva GE[9]等研究表明α-SMA等观察指标与IgA肾病预后相关。同样Yao J[10]等从74例IgA肾病患者发现病理等级及临床指标均与α-SMA表达正相关,α-SMA的表达可作为评估IgA肾病预后的标志物。
作为活化成纤维细胞,MFB合成胶原等ECM的能力更强,MFB首先分泌纤维连接蛋白(fibronectin FN),为其他ECM成分的沉积和胶原纤维的形成提供支架,之后分泌Ⅰ和Ⅲ胶原,LN和蛋白聚糖等。FN是一种非胶原性的a2糖蛋白[11]。纤维连接蛋白先与纤维蛋白、纤维蛋白原及胶原结合,才可将其他胶原沉积于肾小球及小管间质,FN作为这些细胞外基质成分之间的中心环节而起作用,同时其也是一种重要的调理介质,通过与整合素的结合介导细胞增值与器官硬化过程中起着重要作用[12]。Federica[13]研究证实FN1突变后引起肾小球FN的沉积,导致纤维连接蛋白肾小球病的发生。同样Chen H[14]报道了10例纤维连接蛋白肾小球病纤维连接蛋白染色肾小球阳性100%,均说明了FN沉积对导致慢性肾小球疾病具有重要作用。
六味地黄丸是古方经典滋阴补肾之剂,被广泛运用于慢性肾脏病防治。本实验结果显示,从六味地黄汤组尿蛋白定量及红细胞计数与模型组比较,均较模型组降低(P<0.05),但较雷公藤多苷片组高,这也提示六味地黄汤可在一定程度上减少IgA肾病大鼠尿蛋白及尿红细胞,这与国内一些临床研究[15]一致。同时在一定程度上改善肾功能。通过对各组α-SMA及FN半定量分析发现,模型组肾小球系膜区、肾小管及间质均有大量棕褐色阳性表达及Western blot检测α-SMA及FN增多,这也提示模型组大鼠肾脏系膜细胞及上皮细胞发生了表型转化,从成纤维细胞向肌成纤维细胞转化,同时分泌大量细胞外基质,而六味地黄汤组α-SMA及FN表达平均光密度、Western blot检测α-SMA及FN,与模型组相比,均明显降低,且差异有统计学意义(P<0.05)。与雷公藤多苷片组相比,六味地黄汤组免疫组化及Western blot检测FN、α-SMA表达均较高,且差异有统计学意义(P<0.05),结合雷公藤多苷对其尿蛋白、尿红细胞及肾功能的影响,这也进一步说明雷公藤多苷片治疗IgA肾病具有较好疗效,由于我们对六味地黄汤其治疗观察时间短、且无剂量分层,能否达到与雷公藤多苷片一样的疗效,还有待进一步研究。
综上所述,六味地黄汤可在一定程度上减少I-gA肾病大鼠尿蛋白及尿红细胞数,改善其肾功能,其机制可能通过下调α-SMA及FN表达,而达到减少肾脏ECM等沉积,一定程度上延缓肾小球及间质的纤维化,其影响其表达的调控因素或信号传导途径,有待进一步探讨。
参考文献:
[1]王海燕.肾脏病学[M].北京:人民卫生出版社.2012:993.
[2]戴冰,吴沁璇,肖子曾.六味地黄汤水提醇溶部位对2型糖尿病大鼠胰岛及肾脏组织形态结构的影响[J].湖南中医药大学学报,2015,35(4):21-23.
[3]陈丽,周忠志,何泽云.六味地黄丸对慢性肾脏病研究的新进展[J].湖南中医药大学学报,2013,33(8):104-106.
[4]汤颖,娄探奇,成彩联,等.实验性IgA肾病模型的改进[J].中山大学学报(医学科学版), 2006,27(2):185-186.
[5]Rifai A. IgA nephropathy:immune mechanisms beyond I-gA mesangial deposition[J].Kidney Int,2007,72:239-241.
[6]魏晴雪,万毅刚,赵青,等.肾脏细胞外基质降解的分子机制及中药干预作用[J].中国中药杂志,2013,38(4):524-535
[7]Razzaque MS,Taguchi T.Cellular and molecular events leading to renal tubulointerstitial fibrosis [J].Med Electron Microsc,2002,35(2):68.
[8]Kitamuran M,Mitari T,Nagasawa R,et al.Differentiated phenotype of glomerular mesan- gial cells in nodular cultre[J].Am J Physiol,7996,270:614-622.
[9]Silva GE, Costa RS, Ravinal RC, et al. Mast cells, TGF-beta1and alpha-SMA expression in IgA nephropathy[J]. Dis Markers,2008,24(3):181-190.
[10]Yao J, Ke Z, Wang X, et al. Epithelial-mesenchymal transition and apoptosis of renal tubular epithelial cells are associated with disease progression in patients with IgA nephropathy[J]. Mol Med Rep,2014,10(1):39-44.
[11]程红新,杨晓萍,蒋雅红.纤维连接蛋白在肾间质纤维化大鼠肾组织中的表达[J].中国组织工程研究,2012,16(31):5837-5838.
[12]Li JH, Zhu HJ, Huang XR, et al. Smad7inhibits fibrotic effect of TGF-Beta on renal tubular epithelial cells by blocking Smad2activation [J]. J Am Soc Nephrol,2002,13(6):1464-1472.
[13]Federica, C Roberta, D Federica B, ea tl. Mutations in FN1cause glomerulopathy with fibronectin deposits[J]. Proc Natl Acad Sci USA. 2008,105(7): 2538–2543.
[14]Chen H, Bao H, Xu F, et al.Clinical and morphological features of fibronect In glomer- ulopathy: a report of ten patients from a single institution[J]. Clin Nephrol,2015,83(2):93-99.
[15]卓启忠,罗静.加减六味地黄汤治疗IgA肾病肝肾阴虚临床研究[J].河南中医,2013,35(4):529-530.
(本文编辑杨瑛)
〔通讯作者〕*何泽云,男,教授,博士生导师,E-mail:hzy2005@zjy.edu.cn。
〔作者简介〕彭亚军,男,博士,从事慢性肾脏病防治研究。
〔基金项目〕湖南省科技厅项目基金(2013SK3099)。
〔收稿日期〕2015-09-04
〔中图分类号〕R285.5;R692.3+1
〔文献标识码〕A
〔文章编号〕
doi:10.3969/j.issn.1674-070X.2015.11.006

