L-抗坏血酸辛酸酯的酶法合成及性质研究
张淑青 操丽丽 吴学凤 莫玉稳 潘丽军
L-抗坏血酸辛酸酯的酶法合成及性质研究
张淑青 操丽丽 吴学凤 莫玉稳 潘丽军
(合肥工业大学生物与食品工程学院安徽省农产品精深加工重点实验室,合肥 230009)
在叔丁醇体系中,Novozym 435固定化脂肪酶催化L-抗坏血酸和中链脂肪酸正辛酸发生酯化反应合成L-抗坏血酸辛酸酯(L-AO),在底物(L-抗坏血酸)浓度0.2 mol/L、底物摩尔比6∶1、脂肪酶用量20%、反应温度55℃、分子筛添加量60 mg/mL条件下反应12 h,L-抗坏血酸酯化转化率可达85.6%。DSC分析结果表明L-AO具有较低的结晶温度和较高的结晶焓,使其在低温时不易结晶析出。油溶性测定结果显示,L-AO在植物油中的溶解度远远大于L-抗坏血酸棕榈酸酯(L-AP),较高的油溶性有利于扩展其在油脂及脂溶性产品中的应用。羟自由基清除能力以及对油脂的抗氧化性能试验结果表明L-AO具有较强的抗氧化能力,是一种很有潜力的油溶性抗氧化剂。
正辛酸 L-抗坏血酸 脂肪酶 L-抗坏血酸辛酸酯 DSC 油溶性 抗氧化活性
随着食品工业的高速发展,人民生活水平的不断提高,食品和食品添加剂的安全性越来越受到重视。用以延缓油脂及含油食品酸败劣变的化学合成类抗氧化剂,如二丁基羟基甲苯(BHT)、丁基羟基茴香醚(BHA)、叔丁基对苯二酚(TBHQ)等因可能具有致癌性而受到人们的质疑[1],天然类抗氧化剂高效、低毒的特性受到越来越多的关注。L-抗坏血酸脂肪酸酯是近年来研究较多的一种新型绿色抗氧化剂[2-3],主要以长链脂肪酸尤其是棕榈酸和硬脂酸为酰基供体[4-5]。其中,L- 抗坏血酸棕榈酸酯(L -ascorbyl palmitate,L-AP)已得到世界卫生组织等机构的认可,并被多国药典收载,作为食品添加剂广泛应用于食用油、含油食品及肉制品中[6]。但L-抗坏血酸长链脂肪酸酯较高的熔点使得其在油脂及脂溶性产品中的溶解度并不理想,温度较低时容易结晶析出,从而影响其抗氧化活性。
本研究通过非水相固定脂肪酶催化,将低熔点的中链脂肪酸正辛酸引入到L-抗坏血酸的第六位羟基上,得到L-抗坏血酸辛酸酯(L-ascorbyl octanoate,L-AO),考察各因素对合成效果的影响,并对产物的热性能、油溶性及抗氧化性进行了研究,以期为L-抗坏血酸中链脂肪酸酯的后续研究及生产提供参考。
1 材料与方法
1.1 材料与设备
L-抗坏血酸(纯度≥99.7%)、正辛酸(纯度≥99.0%)、4A分子筛、水杨酸、硫酸亚铁、过氧化氢:国药集团化学试剂有限公司;叔丁醇、叔戊醇、丙酮、乙腈、乙酸乙酯、二氯甲烷、正己烷:无锡市展望化工试剂有限公司,以上均为分析纯;色谱级甲醇:美国天地色谱试剂公司;超纯水:实验室自制;商品化固定化脂肪酶Novozym 435、Lipozyme TL IM、Lipozyme RM IM:美国诺维信公司;食用油:市售。
SHY-2A型水浴恒温振荡器:江苏金坛市金城国胜实验仪器厂;HPLC系统:美国Waters公司;Q2000型差热示差扫描量热仪:美国TA仪器公司;T6新世纪型紫外可见分光光度计:北京普析通用仪器有限责任公司。
1.2 试验方法
1.2.1 L-AO的酶法合成条件优化
称取一定量的正辛酸、L-抗坏血酸及固定化脂肪酶于干净的具塞锥形瓶中,加入反应介质和4A分子筛,塞紧塞子,用保鲜膜密封,于恒温振荡器中反应。以L-抗坏血酸酯化转化率为指标,考察酶的种类、反应介质、反应时间、底物(L-抗坏血酸)浓度、底物摩尔比(正辛酸∶L-抗坏血酸)、脂肪酶用量(以L-抗坏血酸的质量计)、反应温度、分子筛添加量对合成效果的影响。在最优合成条件下,考察脂肪酶的重复使用效果。
1.2.2 L-抗坏血酸酯化转化率的测定
反应结束后,将反应液过滤、稀释、过膜,采用高效液相色谱法(HPLC)检测反应液中产物的含量,计算L-抗坏血酸的酯化转化率。HPLC检测参数[7]如下:色谱柱Waters Symmetry®C18(5 μm,3.9×150 mm);检测器光电二极管阵列检测器(Waters 2996);流动相甲醇/水=70/30;进样量5 μL;流速1 mL/min;柱温25℃。L-抗坏血酸酯化转化率(y)的计算公式[8]:
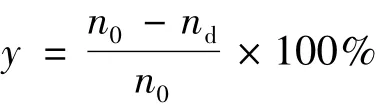
式中:nd为未反应完的L-抗坏血酸的物质的量/mol;n0为反应初始加入的L-抗坏血酸的总物质的量/mol。
1.2.3 L-AO的分离纯化
反应液经固液分离,除去酶、分子筛,再经减压蒸馏除去反应介质,所得粗产物用乙酸乙酯溶解,加水洗涤,分液,有机层真空旋转蒸发所得经正己烷结晶、正己烷-二氯甲烷(3∶1)混合溶剂重结晶、真空干燥得成品。
1.2.4 L-AO纯度的测定
参考GB 16314—1996中关于测定L-AP纯度的碘量法测定产物的纯度[9]。
1.2.5 L-AO的DSC分析
采用差示扫描量热仪(DSC)对L-AO的热性能进行分析研究。N2为尾吹气,液氮降温,升温速率10℃/min,降温速率5℃/min,温度范围0~100℃。并与L-AP作比较。
1.2.6 L-AO油溶性的测定
将过量的L-AO置于不同油品中,常温下振荡或超声一段时间,待溶解达到平衡,过滤除去未溶解的L-AO,通过碘量法[9]测定其在各油品中的溶解度,并与L-AP作比较。
1.2.7 L-AO对羟自由基清除能力的测定
利用水杨酸捕捉Fenton反应产生的羟自由基产生有色物质的原理,参考Smironff等[10]的方法测定L-抗坏血酸辛酸酯对羟自由基清除能力。取9 mmol/L硫酸亚铁溶液1 mL,加1 mL 9 mmol/L 水杨酸-乙醇溶液(50%),混匀后加入1 mL不同浓度的L-AO乙醇溶液为处理样,对照样加入1 mL无水乙醇,最后加入0.03%H2O21 mL启动反应,37℃保温30 min,于510 nm处测定吸光度。同时与VC、TBHQ、PG(没食子酸丙酯)、L-AP、VE比较清除能力。对羟自由基的清除率按公式计算:
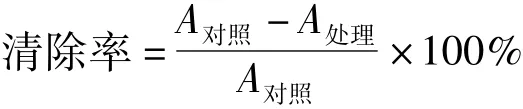
1.2.8 L-AO对油脂的抗氧化性能的测定
采用烘箱法[11]测定L-AO对油脂的抗氧化性能。准确称取160 mg L-AO,配成16 mg/mL乙醇溶液,移取100μL样品液到8 g油样中,配成抗氧化剂添加量为0.02%的试样。转入(40±0.5)℃的烘箱中加速氧化,并按GB/T 5538—2005每隔4 d测定过氧化值(POV)[12]。同时与TBHQ、BHT、BHA、PG、L-AP、VE比较抗氧化性能。
2 结果与讨论
2.1 L-AO的合成工艺优化
2.1.1 酶的种类对L-抗坏血酸酯化转化率的影响
由图1可知,Novozym 435固定化脂肪酶催化合成L-AO效果较好,而其余2种固定化脂肪酶几乎无效果,故选择Novozym 435脂肪酶。

图1 酶的种类对L-抗坏血酸酯化转化率的影响
2.1.2 反应介质对L-抗坏血酸酯化转化率的影响
反应介质的极性对酶的活性和稳定性有直接的影响,极性过大会破坏酶的水化层,致使酶失活;极性过小,L-抗坏血酸的溶解度大大降低,也不利于反应的进行[13]。
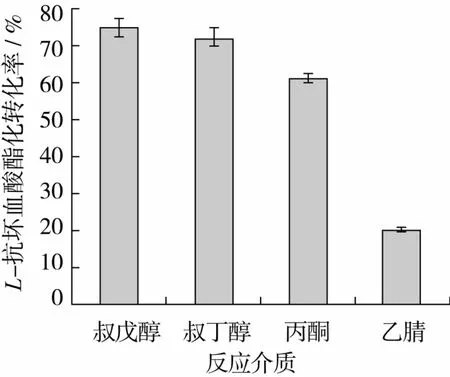
图2 反应介质对L-抗坏血酸酯化转化率的影响
由图2可知,极性适中的叔戊醇、叔丁醇、丙酮酯化转化率较高,极性较大的乙腈则较低,其中叔戊醇和叔丁醇效果最好,考虑到沸点低的叔丁醇在后续的真空旋转蒸发除溶剂的过程中相对容易且耗能低,且价格比叔戊醇低一半左右,故选择叔丁醇作为反应介质。
2.1.3 反应时间对L-抗坏血酸酯化转化率的影响
反应时间不仅影响催化效率,而且还关系到产品的质量和脂肪酶的活性。反应时间过短,反应不充分,产品得率低,造成底物的浪费;但是反应时间过长,部分酶活丧失,产品颜色发黄,增加资源的浪费及设备的磨损。因此,选择合适的反应时间至关重要[14]。
由图3可知,12 h以内随着时间的延长,L-抗坏血酸酯化转化率逐渐升高,12 h后增长缓慢并趋于平衡,时间再延长转化率还有下降的趋势,这可能是由于分子筛吸附造成的产物损失导致的。故反应时间选12 h。
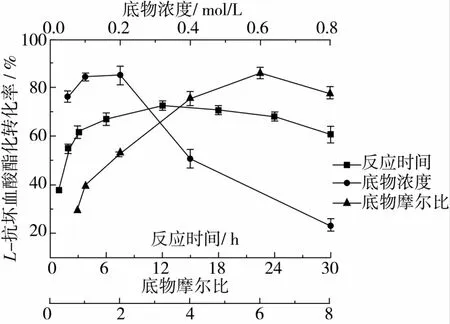
图3 反应时间、底物浓度、底物摩尔比对L-抗坏血酸酯化转化率的影响
2.1.4 底物浓度对L-抗坏血酸酯化转化率的影响
底物浓度小,酶促反应达到平衡所需时间短,但产量低;底物浓度过大,酶促反应达到平衡所需时间长,且转化率低,产量也不会很高。故选择合适的底物浓度十分关键,应综合考虑时间、转化率和产量等因素。
由图3可知,底物浓度小于0.2 mol/L时,随着底物浓度的增加,其与固定化脂肪酶的接触面积也会增加,L-抗坏血酸酯化转化率不断提高。但当底物浓度继续增加时,L-抗坏血酸酯化转化率反而降低,这可能是因为随着底物浓度的增加,固定化脂肪酶的作用位点被包裹住,而且反应生成的水也会对固定化脂肪酶的催化活性有很大影响,从而大大限制了L-AO的生成。因此选择L-抗坏血酸的浓度为0.2 mol/L。
2.1.5 底物摩尔比对L-抗坏血酸酯化转化率的影响
酯化反应是可逆反应,依照反应平衡原理,要提高其中一种底物L-抗坏血酸的酯化转化率,可以通过增加另一底物正辛酸的浓度使反应朝正反应方向进行,在L-抗坏血酸和脂肪酸的酯化反应中,提高酰基供体的浓度对提高脂肪酶的催化稳定性也有一定的作用[15]。
如图3所示,当正辛酸与L-抗坏血酸的摩尔比从0.8∶1上升至6∶1时,L-抗坏血酸酯化转化率不断提高,继续增加正辛酸浓度,转化率不再上升,主要原因是随着底物摩尔比的增加,固定化脂肪酶的结合位点逐渐趋于饱和,且过量的正辛酸增加了空间位阻。故选择底物摩尔比为6∶1比较合适。
2.1.6 脂肪酶用量对L-抗坏血酸酯化转化率的影响
由图4可知,当脂肪酶用量小于20%时,随着脂肪酶用量的增加,L-抗坏血酸酯化转化率逐渐增大,主要原因是随着酶用量的增加,底物与酶的接触面积增大,催化反应速率加快,L-抗坏血酸辛酸酯的产率提高。继续增加脂肪酶用量,L-抗坏血酸的转化率趋于平衡。故选择脂肪酶用量为20%。
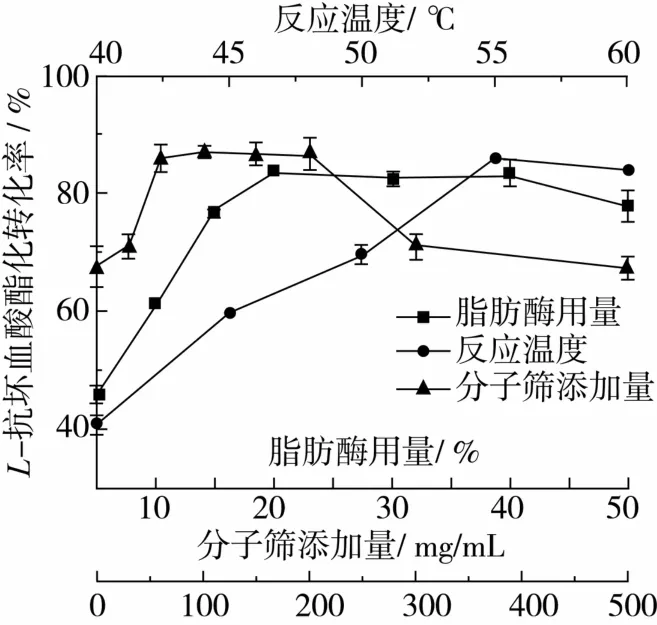
图4 脂肪酶用量、反应温度、分子筛添加量对L-抗坏血酸酯化转化率的影响
2.1.7 反应温度对L-抗坏血酸酯化转化率的影响
温度对脂肪酶的催化活性有很大的影响。温度升高,酶活提高,反应速率加快,反应达到平衡所需时间缩短,另一方面,温度会影响酶的稳定性,过高的温度会导致酶变性失活,反应速率随之下降。故选择合适的反应温度十分重要。
如图4所示,反应温度在40~55℃范围内,随着温度的升高,L-抗坏血酸酯化转化率迅速提高,但随着温度的继续上升,转化率呈现下降趋势。根据Novozym 435脂肪酶的产品使用要求,反应体系温度应控制在60℃以下。此外,L-抗坏血酸的连烯二醇结构对温度比较敏感,高温易被破坏。因此,选择最佳反应温度为55℃。
2.1.8 分子筛添加量对L-抗坏血酸酯化转化率的影响
对非水相酶促反应而言,适量的水对酶活的维持是必需的[14]。酯化反应的开始,体系中水分活度较低,酶活未被完全激发,随反应的进行,水分活度增大,酶活提高,但当反应进行到一定的程度后,过量的水会引起酶分子内部“水簇”的形成,改变酶的活性结构,导致酶活降低[16]。因此,控制反应体系各个阶段的水分活度十分关键。通过添加适量的4A分子筛可以有效控制体系的水分活度,从而使酶活处于较高的状态。
由图4可知,分子筛添加量在60~200 mg/mL溶剂时,L-抗坏血酸酯化转化率较高,较未添加分子筛高出20%左右,继续增加用量,转化率下降,这可能是因为大量分子筛导致水分活度过低,破坏了脂肪酶的水化层,酶活降低,或者是因为分子筛的吸附作用导致产物损失。故选择分子筛添加量为60 mg/mL,此时转化率可达85.6%。
2.1.9 脂肪酶使用次数对L-抗坏血酸酯化转化率的影响

图5 脂肪酶使用次数对L-抗坏血酸酯化转化率的影响
由图5可知,随脂肪酶使用次数的增加,L-抗坏血酸酯化转化率先稍有增加后逐渐下降,最高转化率为第2次使用时的88.3%,使用第10次时转化率仍保持在75%以上。Novozym 435固定化脂肪酶在重复使用次数较多的情况下仍能保持较好的催化效果,有利于降低生产成本。
2.2 L-AO的纯度测定及DSC分析
根据最佳合成条件,在叔丁醇反应体系中,由Novozym 435固定化脂肪酶催化合成粗产物,经有机溶剂萃取结晶法分离纯化后得到的产物为白色有光泽的针状晶体,用碘量法测定产物的纯度为96.5%。
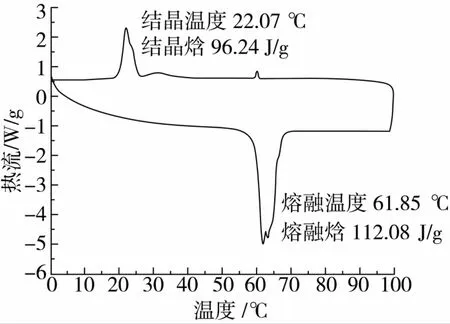
图6 L-AO的DSC分析

图7 L-AP的DSC分析
由图6和图7可知,在升温过程中,L-AO的熔融峰出现在61.85℃,熔融焓为112.05 J/g,比LAP的熔融焓123.18 J/g低;在降温过程中,L-AO的结晶峰出现在22.07℃,结晶焓为96.24 J/g,较L-AP的27.58 J/g高出很多。L-AO较低的熔融温度、熔融焓、结晶温度和较高的结晶焓使得其在油脂及脂溶性产品中有较高的溶解度,且当温度较低时不易结晶析出。另外,L-AO较宽的结晶区间使得分离纯化结晶步骤中温度的控制非常重要,否则很容易形成黏稠的膏状固体,不利于后续分离[14]。
2.3 L-AO油溶性的测定
由图8可知,L-AO在各类植物油中的溶解度均远远大于L-AP。其在大豆油、花生油、菜籽油、葵花籽油及稻米油中的溶解度分别为933、1 708、1 311、1 157、1 689 mg/kg,均为L-AP 的5~7倍,尤其在玉米油中的溶解度为1 995 mg/kg,约为L-AP(145 mg/kg)的14倍,可见在L-抗坏血酸结构中引入中链脂肪酸,有利于增加其油溶性,扩展其在油脂及脂溶性产品中的应用。虽然L-AO的极性大于L-AP,但其较小的相对分子质量和较短的碳链使其具有较小的空间位阻,可能有助于其溶解于油脂中。同时,较低的熔融温度、熔融焓也可能是其油溶性远大于L-AP的原因。
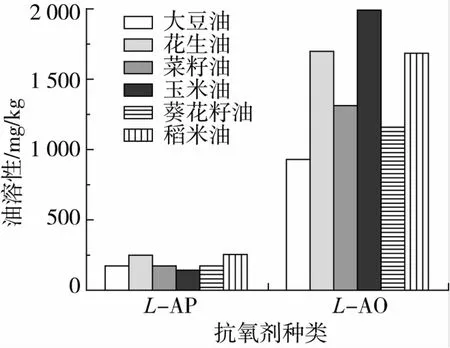
图8 L-AO及L-AP在不同植物油脂中的溶解度
2.4 L-AO对羟自由基清除能力的测定
羟自由基是引发脂肪过氧化的重要活性氧,羟自由基清除率是反应抗氧化性能的一个重要指标[17]。
图9可知,在一定质量浓度范围内,VC、TBHQ、L-AP和L-AO对羟自由基的清除能力随质量浓度的增加而增强,基本呈量效关系,清除能力大小依次为:TBHQ>VC>L-AO >L-AP,最终趋于平衡;PG和VE对羟自由基的清除能力较弱,在0.2~1.4 mg/mL质量浓度范围内,清除率最高分别只有32%、14%。VC、L-AO、L-AP对羟自由基的清除能力依次降低是因为在相同质量浓度条件下具有抗氧化活性的连二烯醇结构所占比重依次下降[13]。
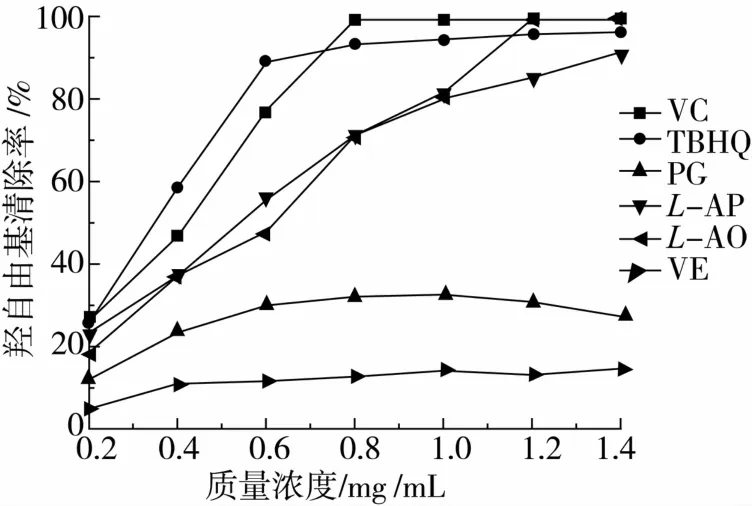
图9 L-AO的羟自由基清除能力
2.5 L-AO对油脂的抗氧化性能的测定
由图10可知,在强制氧化作用下,随着强制氧化时间的延长,各油样的过氧化值(POV)均呈上升趋势,其中空白油样上升趋势尤为显著,添加各类抗氧化剂的油样的POV值均比空白对照低,说明各类抗氧化剂对大豆油的氧化有一定的抑制作用,其抗氧化能力大小依次为:TBHQ>L-AO>L-AP>PG>BHT>BHA>VE。最初的24 d内,添加PG、BHT、BHA的油样的POV值基本呈线性上升,氧化开始进行,而添加TBHQ、L-AP和L-AO的油样的POV值基本不变,说明L-AO可以有效地延缓油脂的氧化起始,对油脂的抗氧化性能较强,基本可以达到TBHQ的效果,但之后POV值稍有增加,可能是因为其自身热稳定性不如TBHQ所导致的。
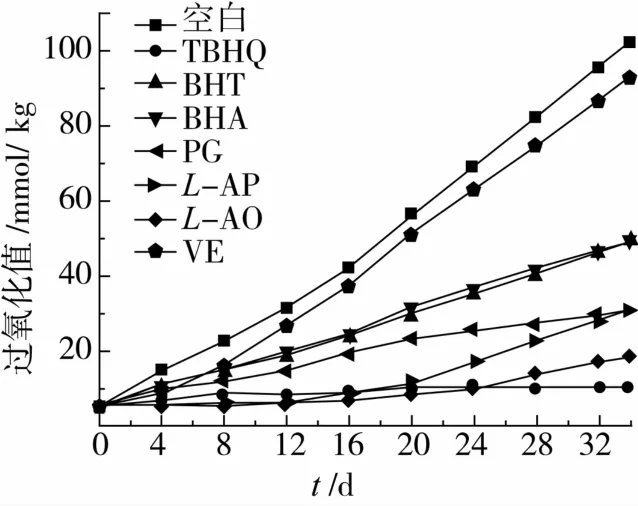
图10 L-AO与其他抗氧化剂在大豆油中的抗氧化性能比较
3 结论
3.1 本研究以中链脂肪酸正辛酸为酰基供体,对L-AO的酶法合成工艺条件进行优化。选取Novozym435为催化酶,叔丁醇为反应介质,考察各因素对L-抗坏血酸酯化转化率的影响,得到最佳工艺条件为:底物浓度0.2 mol/L,底物摩尔比6∶1,脂肪酶用量20%,反应温度55℃,分子筛添加量60 mg/mL,此条件下反应12 h,L-抗坏血酸酯化转化率可达85.6%。采用有机溶剂萃取结晶法分离纯化得到产物为白色晶体,纯度96.5%。
3.2 L-AO的DSC分析结果表明,相较于L-AP,L-AO具有较低的熔融温度、熔融焓、结晶温度和较高的结晶焓,使其具有较高的脂溶性,且在低温时不易结晶析出。油溶性测定结果显示,L-AO在植物油中的溶解度远远大于L-AP,正辛酸的引入,大大提高了L-抗坏血酸的油溶性,有利于扩展其在油脂及脂溶性产品中的应用。
3.3 L-AO对羟自由基的清除能力较强,仅次于TBHQ与VC。对油脂的抗氧化性能试验中,24 d内添加L-AO油样的POV值基本不变,表明LAO可以有效地延缓油脂的氧化起始,其对油脂的抗氧化性能较强,基本可以媲美TBHQ。因此,LAO是一种很有潜力的油溶性抗氧化剂,有广泛的应用前景。
[1]邹志飞.食品添加剂的毒性研究概览[C]//第四届第二次中国毒理学会食品毒理学专业委员会与营养食品所毒理室联合召开学术会议论文集.北京:中国毒理学会食品毒理学专业委员会,2008:81-102
Zou Z L.Review on the toxicity of food additives[C]//The fourth session of the second toxicology,professional committee of the Chinese society of toxicology food and nutrition food toxicology room joint academic conference proceedings.Beijing:Food toxicology Specialized Committee of Chinese society of toxicology,2008:81-102
[2]Chang SW,Yang CJ,Chen F Y,et al.Optimized synthesis of lipase-catalyzed L-ascorbyl laurate by Novozym®435[J].Journal of Molecular Catalysis B:Enzymatic,2009,56(1):7-12
[3]彭杨,穆青,魏微,等.超声辅助脂肪酶催化L-抗坏血酸脂肪酸酯的合成[J].食品科学,2011,32(12):101-105
Peng Y,Mu Q,Wei W,et al.Synthesis of ascorbyl fatty acid esters from lard by ultrasound-assisted lipase catalysis[J].Food Science,2011,32(12):101 -105
[4]Burham H,Rasheed R A G A,Noor N M,et al.Enzymatic synthesis of palm - based ascorbyl esters[J].Journal of Molecular Catalysis B:Enzymatic,2009,58(1-4):153-157
[5]雷琳.L-抗坏血酸硬脂酸酯的合成条件探索[J].广东化工,2009,36(6):72-73
Lei L.Study on Synthesis Condition of L-ascorbyl Stearate[J].Guangdong Chemical Industry,2009,36(6):72 -73
[6]中国人民共和国卫生部.GB 2760—2011食品安全国家标准、食品添加剂使用标准[S].北京:中国人民共和国卫生部,2011
Ministry of Health of the People's Republic of China.GB 2760-2011 National food safety standard-standards for uses of food additives[S].Beijing:Ministry of Health of the People's Republic of China,2011
[7]蔡水根,陶冠军,秦昉,等.L-抗坏血酸月桂酸酯的酶法合成、分离及其性质[J].食品工业科技,2008,29(10):211-215
Cai SG,Tao G J,Qin F,et al.Enzymatic synthesis,separation and properties of L - ascorbyl laurate[J].Science &Technology of Food Industry,2008,29(10):211 -215
[8]宋秋红,王熙,田平芳.酶催化合成维生素C脂肪酸酯的反应条件优化[J].北京化工大学学报(自然科学版),2009,36(6):77 -81
Song QH,Wang X,Tian PF.Optimization of the enzymatic synthesis of L - ascorbyl fatty acid esters[J].Journal of Beijing University of Chemical Technology (Natural Science),2009,36(6):77 -81
[9]中国国家标准化管理委员会.GB 16314-1996食品添加剂L-抗坏血酸棕榈酸酯[S].北京:中国国家标准化管理委员会,1996
Standardization Administration of the People's Republic of China.GB 16314-1996 Food Additives:L-ascorbyl palmitate [S].Beijing:Standardization Administration of the People's Republic of China,1996
[10]Smironff N,Cumbes Q J.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060
[11]余泗莲,余彬,祝显虹,等.异VC山茶油脂肪酸酯的抗氧化性能研究[J].中国食品添加剂,2012(6):161-164
Yu SL,Yu B,Zhu X H,et al.Study on the antioxidation activity of D - isoascorbyl camellia oil fatty acid esters[J].China Food Additives,2012,(6):161-164
[12]GB/T 5538—2005 动植物油脂过氧化值测定[S]. 北京:中国国家标准化管理委员会,2005
GB/T 5538—2005 Determination of peroxide value plant and animal oils and fats[S].Beijing:Standardization Administration of the People's Republic of China,2005
[13]李卓,晏日安,曾永青.超声波强化酶法合成L-抗坏血酸癸酸酯及其抗氧化性研究[J].食品工业科技,2013,34(2):204-209
Li Z,Yan R A,Zeng Y Q.Synthesis of lipase-catalyzed L-ascorbyl decanoate in ultrasonic field and determination of its antioxidant activity[J].Science & Technology of Food Industry,2013,34(2):204 -209
[14]曹刘霞.非水相酶催化合成L-抗坏血酸油酸酯、结构表征及性质研究[D],郑州:河南工业大学,2011
Cao L X.Biosynthesis of L-ascorbyl oleate catalyzed by lipase in non-aqueous phase and study on its structure and properties[D].Zhengzhou:Henan University of Technology,2011
[15]张洪勇,钱俊青.叔戊醇体系中酶法合成L-抗坏血酸脂肪酸酯的研究[J].高校化学工程学报,2011,25(6):1010 -1015
Zhang H Y,Qian JQ.Study of enzymatic synthesis of L-ascorbyl fatty acid esters in tert- amyl alcohol[J].Journal of Chemical Engineering of Chinese Universities,2011,25(6):1010 -1015
[16]Affleck R,Xu Z F,Suzawa V,et al.Enzymatic catalysis and dynamics in low - water environments[J].Proceedings of the National Academy of Sciences of the United States of America,1992,89(3):1100 -1104
[17]王园,惠爱玲,潘见,等.L-抗坏血酸肉桂酸酯的合成及其抗氧化活性研究[J].现代食品科技,2013,29(6):1337 -1341
Wang Y,Hui A L,Pan J,et al.Synthesis of L-ascorbic acid cinnamic acid ester and its antioxidant activities[J].Modern Food Science and Technology,2013,29 (6):1337-1341.
Research on Enzymatic Synthesis and Property of L-Ascorbyl Octanoate
Zhang Shuqing Cao Lili Wu Xuefeng Mo Yuwen Pan Lijun
(School of Biotechnology and Food Engineering,Hefei University of Technology,Key Laboratory for Agriculture Product Deep-processing of Anhui Province,Hefei 230009)
The esterification of n-octanoic acid with L-ascorbic acid and medium-chain fatty acid n-caprylic acidin the presence of immobilized lipase(Novozym435)as the catalyst and tert-butanol as the solvent to obtain L-ascorbyl octanoate(L-AO)was studied.The conversion rate of L-ascorbic acid could reach 85.6%under the conditions of concentration of L -ascorbic acid 0.2 mol/L,substrate molar ratio 6∶1,enzyme dosage 20%,reaction temperature 55℃,molecular sieve dosage 60 mg/mL and reaction time 12 h.DSCanalysis results indicated that L-AO has lower crystallization temperature and higher crystal enthalpy,which make it not easily to crystallize out at low temperatures.And the oil solubility analysis resluts indicated that the solubilities of L-AO in the vegetable oils are far greater than that of L-ascorbic palmitate(L-AP),the higher oil-solubility of L-AObenefits to extend its application in oils and fat-soluble products.The antioxidant activities of L-AO were studied by hydroxyl radical system and further evaluated by adding into the soybean oil.The hydroxyl radical scavenging activity and oxidation resistence test results of grease indicated that L-AO had strong oxidation resistance and L-AO was demonstrated to be a potential oil-soluble antioxidants.
n-octanoic acid,L-ascorbic acid,Lipase,L-ascorbyl octanoate,DSC,oil solubility,antioxidant activity
TS202.3
A
1003-0174(2016)07-0107-07
“十一五”国家科技支撑计划(2010BAD01B07),农业科技成果转化资金项目(2013GB2C300217)
2014-11-18
张淑青,女,1990年出生,硕士,农产品生物化工
潘丽军,女,1955年出生,教授,农产品资源综合利用

