酵母菌发酵对小麦麸皮成分的影响研究
崔晨晓 朱科学 郭晓娜 彭 伟 周惠明
酵母菌发酵对小麦麸皮成分的影响研究
崔晨晓 朱科学 郭晓娜 彭 伟 周惠明
(江南大学食品学院,无锡 214122)
研究用酵母菌发酵小麦麸皮来降低植酸,增加可溶性阿拉伯木聚糖(SAX)和总酚含量以改善小麦麸皮营养价值。通过测定发酵pH和总滴定酸(TTA)及小麦麸皮成分(淀粉、蛋白质、膳食纤维、SAX、植酸、总酚含量)的变化,以研究发酵温度(25、30、35 ℃)和时间(12、24、36、48 h)对小麦麸皮的影响。结果表明,小麦麸皮经发酵后,pH略有下降,TTA上升;蛋白质显著增加;淀粉和膳食纤维下降;SAX和总酚含量均呈现先上升后下降的趋势,最大分别增加了212%和49.4%;植酸显著降低,在35℃、48 h发酵后最大下降了43.3%。经酵母菌发酵后,发酵酸度和小麦麸皮成分有显著变化。
酵母菌 小麦麸皮 发酵 成分
小麦麸皮是面粉厂加工的主要副产品,2010年我国小麦的产量为1.15亿t,小麦麸皮的产量高达2 000万t[1]。小麦麸皮中富含蛋白质、膳食纤维、叶酸、维生素B、矿物质、多酚类物质[2],因此全麦食品的营养价值高,但其中植酸含量较高,阻碍体内矿物质吸收。小麦麸皮的加工改性大多集中在物理化学方法上,如超高压[3]、超微粉碎[4],挤压膨化[5],这些方法虽然对小麦麸皮有一定的改性作用,但大多集中于物理性质方面,而且成本高,而对于其成分的影响少有研究,因此研究者把小麦麸皮的改性着眼于微生物发酵上。
微生物发酵能够改善麸皮物理特性[6],国外学者的研究集中在发酵对小麦麸皮营养成分的改变,研究发现,用酵母菌或者乳酸菌对小麦麸皮进行液体发酵,改善了麸皮的营养成分,增加可溶性AX和酚酸含量,提高小麦麸皮的抗氧化活性[7-8],再将其回添到面包中,可以改善面包品质,增大比容,延缓老化,延长保质期[7]等重要作用。但是,液体发酵时水分较多,有利于其他杂菌生长,而对于微生物固体发酵小麦麸皮的研究相对较少。
本研究用酵母菌固态发酵小麦麸皮,研究发酵温度和时间对发酵pH和TTA及小麦麸皮成分(蛋白质、淀粉、膳食纤维、可溶性阿拉伯木聚糖、植酸、多酚、木聚糖酶活性)的影响,为其应用到面制品中提供参考。
1 材料与方法
1.1 材料和仪器
小麦麸皮:江苏苏中制粉有限公司;即发活性干酵母:安琪酵母公司;植酸钠、木聚糖:sigma公司;福林酚试剂:国药集团。
HYP-1008消化炉:上海纤检仪器有限公司UV-1100紫外可见分光光度计:北京瑞利分析仪器公司;真空冷冻干燥机:美国Labconco公司。
1.2 试验方法
1.2.1 小麦麸皮的发酵
取100 g小麦麸皮,加入100 g去离子水,1.25 g干酵母,在烧杯中混合均匀,在25、30、35℃的恒温恒湿箱中分别培养12、24、36、48 h。一部分样品进行pH和TTA测定,剩余样品冷冻干燥,进行成分分析。
1.2.2 pH和TTA测定
根据AACC 方法02 -52 -01[9],称取10 g发酵小麦麸皮加入到90 mL无CO2的蒸馏水中混合均匀,磁力搅拌器搅拌30 min,静置10 min后,用pH计测定小麦麸皮的pH;悬浮液用0.1 mol/L的NaOH溶液滴定,pH计测定滴定终点pH 8.5,所消耗的NaOH溶液的毫升数即为总酸度TTA。
1.2.3 蛋白质和淀粉测定
蛋白质的测定:根据GB 5009.9—1985,定氮系数6.25;淀粉的测定:根据GB/T 5009.4—1985;膳食纤维的测定:根据GB/T 5009.88—2008。
1.2.4 SAX含量测定
采用Douglas SG[10]方法。向50 mL离心管中加入0.4 g小麦麸皮和20 mL去离子水,磁力搅拌器搅拌提取30 min,静置后,4 500 r/min 离心10 min,取上清液1 mL于20 mL具塞试管中,并加入1 mL去离子水,向试管中加入10 mL反应液(5 mL 20%间苯三酚-乙醇溶液、110 mL冰醋酸、2 mL浓盐酸、1 mL 17.5 g/L葡萄糖),于沸水浴中反应25 min,冰水混合物终止反应,立即测定其552 nm和510 nm吸光值的差值。以建立的木糖标准曲线来计算SAX含量。
1.2.5 木聚糖酶活性测定
根据DNS法[11],取1 g小麦麸皮样品于50 mL离心管中,加入10 mL醋酸钠缓冲液(0.5 mol/L,pH 5.0),混合均匀,放入30℃水浴锅中反应60 min,6℃,10 000 r/min离心20 min,取上清液。向试管中加入0.5 mL适量稀释的酶液和1%木聚糖底物溶液0.5 mL,混合均匀,迅速放入40℃的水浴锅中保温30 min,加入1.5 mLDNS溶液,立即沸水浴显色10 min,冷却后用蒸馏水定容到10 mL,在540 nm处测定吸光值。1个酶活力单位U定义为:每分钟底物转化为1μmol木糖所需的酶量。以木糖标准根据标准曲线计算酶活。
1.2.6 植酸含量测定
根据Haug等[12]方法,0.05 g小麦麸皮样品加入到50 mL离心管中,并加入20 mL 0.5 mol/L的盐酸,提取植酸3 h,4 000 r/min离心15 min,取上清液1 mL,加入2 mL硫酸铵铁,沸水浴30 min,冰水混合物终止反应,4 500 r/min离心15 min,取上清液2 mL,加入3 mL双吡啶进行颜色反应,519 nm处测定吸光值。以植酸标准根据标准曲线计算植酸含量。
1.2.7 总酚含量测定
取小麦麸皮0.4 g于50 mL离心管中,加入在70℃预热过的70%甲醇溶液5 mL,用玻璃棒充分搅拌均匀润湿,立即移入70℃水浴锅中,浸提10 min(每隔5 min搅拌1次),浸提后冷却至室温,在4 000 r/min下离心20 min,将上清液转移至10 mL容量瓶中。残渣再用5 mL70%甲醇溶液提取1次,重复上述操作。合并提取液定容至10 mL容量瓶中,摇匀,用锡纸包好贮存在4℃冰箱中备用。
取1.0 mL总酚提取液于试管中,加入5.0 mL的福林酚试剂,摇匀。反应5 min内,加入4.0 mL 7.5%Na2CO3溶液,室温下避光放置60 min,在765 nm处测定吸光值。以没食子酸(gallic acid)为标样,制作标准曲线,多酚含量表示为mg没食子酸/g小麦麸皮。
1.2.8 数据处理
用SPSS17.0、Excel 2013处理数据,用软件Excel 2013绘图。每次试验重复3次,取平均值。
2 结果与讨论
2.1 pH和TTA变化
小麦麸皮经酵母菌在25、30、35℃发酵后,pH只是略有下降,从6.5分别下降到6.20、6.24、6.09,而TTA则从3.0 mL分别增加到5.78、5.78、6.9 mL(图1)。表明酵母菌在发酵过程中,只有少量的乳酸和醋酸产生[14],因酵母菌有较强的产气能力,其产酸能力较弱。在发酵后期(24~48 h),较高的发酵温度(35℃)下,小麦麸皮pH下降较大,而在较低温度(25、30℃)发酵时,pH变化较为平缓,Katina K等[2]也得到类似的结果。产生这一现象的原因是在较高温度(35℃)下,小麦麸皮中本身存在的乳酸菌摆脱了酵母菌的抑制作用,得到了一定程度的生长繁殖,产生了乳酸(乳酸菌产酸能力强),使得小麦麸皮pH下降,这在酵母菌菌落计数时得到了验证(数据中未显示),在酵母菌菌落计数时,只有在35℃发酵48 h的平板中检测到了乳酸菌等杂菌,其他发酵温度和时间下只有酵母菌正常生长,这证明了发酵过程中,酵母菌是优势菌,抑制了小麦麸皮中本身存在的菌种生长,只有在高温度(35℃)和长时间(48 h)时杂菌才摆脱酵母菌抑制。
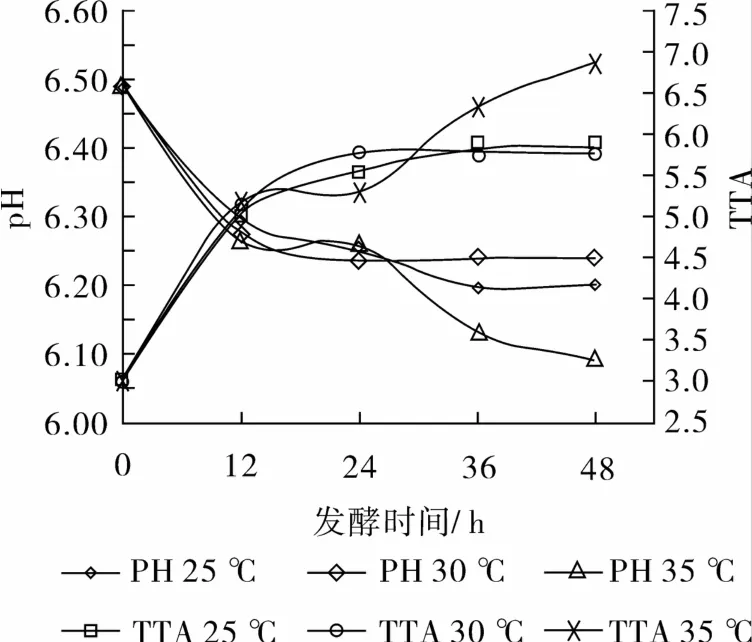
图1 发酵过程中pH和TTA变化
2.2 发酵温度和时间对小麦麸皮中蛋白质、淀粉、膳食纤维含量的影响
表1为小麦麸皮中的蛋白质、淀粉和膳食纤维在发酵前后的变化情况。随着发酵时间的延长,蛋白质呈上升趋势,而淀粉和膳食纤维呈下降趋势,且各发酵时间之间均有显著差异。经25、30、35℃发酵后,蛋白质质量分数从19.16%分别增加到23.42%、23.28%、23.37%,且均在发酵48 h时达到最大,分别增加了22.23%、21.50%、21.97%。其原因是酵母菌在生长代谢过程中利用环境中的无机氮源合成有机氮,这间接说明酵母菌在小麦麸皮基质中生长良好,与Hartikainen等[14]结果一致。

表1 发酵温度和时间对小麦麸皮蛋白质、淀粉、膳食纤维的影响
发酵后淀粉含量显著减少,经25、30、35℃发酵后,淀粉质量分数从17.23%分别下降到15.36%、13.79%、11.60%,且均在发酵48 h时含量达到最低,分别降低了10.85%、20.14%、32.68%,主要是因为酵母菌利用了淀粉为碳源,使得淀粉含量下降;发酵温度越高,淀粉含量降低越多,因为在较高温度时,淀粉酶的活性较高,使得淀粉降解较快。
膳食纤维含量显著减少,经25、30、35℃发酵后,膳食纤维从49.01%分别下降到46.01%、46.28%、45.85%,且均在发酵48 h时含量达到最低,分别降低了6.12%、5.57%、6.45%,主要原因是酵母菌在发酵过程中分解了细胞壁,使得膳食纤维含量降低。
2.3 发酵温度和时间对小麦麸皮中SAX含量和木聚糖酶活的影响
不同发酵温度和时间下小麦麸皮中SAX含量测定结果见图2。发酵过程中木聚糖酶活性的变化见表2。经酵母菌发酵,小麦麸皮中SAX含量显著高于对照组,在30℃经24 h发酵时其含量最高为1.242 g/100 g,增加了212%,这个结果与Katina K等[7]液体发酵的结果相似。
发酵温度一定时,随着时间延长,SAX含量呈现先增加后减少的趋势,且均在发酵24 h时其含量达到最大,分别为1.173、1.242、1.239 g/100 g。发酵能够增加SAX含量的原因是小麦麸皮经发酵,木聚糖酶活性受到抑制[7],发酵后木聚糖酶活均在0.10 U/mL左右,低于对照组[(0.160±0.006)U/mL]在发酵前期(0~24 h),低活性的木聚糖酶使得发酵后SAX含量处于较高水平,在发酵后期(24~48 h),木聚糖酶作用于SAX使其转化为单糖,使得SAX含量下降[7],并且发酵温度越高,其含量下降越快,尤其是48 h时其趋势较为显著,其原因是高温时木聚糖酶活性较低温时高,使得更多的SAX转化成单糖,随发酵温度从25~35℃过程中,发酵48 h的酶活分别为0.097、0.108、0.113 U/mL(表2),酶活性随温度升高而增加。

图2 SAX含量

表2 木聚糖酶活
2.4 发酵温度和时间对小麦麸皮中植酸含量的影响
不同发酵温度和时间下小麦麸皮中植酸含量测定,结果见图3。经酵母菌发酵,植酸含量显著降低,在35℃发酵48 h植酸下降最多,为43.3%。Coda等[15]也指出微生物发酵能够降低小麦麸皮中植酸含量。随着发酵时间的延长,植酸含量下降,在25~35℃下经48 h发酵分别使植酸下降了28.34%、39.6%、43.3%。
在发酵前期(0~24 h),植酸下降较快,在25~35℃下经24 h发酵,植酸含量分别下降了19.9%、37.74%、29.5%,因为此时植酸酶活性较高,降解植酸效果显著;同时发酵产生的少量乳酸使得pH下降较大(图1),植酸在酸性条件下容易降解[16]。但在发酵后期(24~48 h),植酸降解较为缓慢,只是略有下降,因为植酸酶活性下降,同时pH变化平缓,然而在温度为35℃时的发酵后期,植酸又有较大的下降,这与在35℃下发酵后期pH有较大的下降的结果相符合。

图3 植酸含量
2.5 发酵温度和时间对小麦麸皮中多酚含量的影响
由图4可看出,经酵母菌发酵,小麦麸皮中多酚含量有显著增加,12 h发酵后多酚含量即有明显的增加,在35℃经24 h发酵后,多酚含量最高,为4.854 mgGAE/g,增加了49.4%。

图4 多酚含量
在相同发酵温度下,多酚含量均随着发酵时间的延长,呈现先增加后减少的趋势。在25℃时,经过36 h发酵多酚含量达到最大,为4.425 mg GAE/g,
而在30℃和35℃时,均在发酵24 h时多酚含量即达到最大,分别为4.529、4.854 mgGAE/g,再继续发酵,多酚含量下降。多酚类物质由于发生了游离、聚合和沉淀反应,因此其含量下降[2]。在发酵前期(0~24 h),经过相同的发酵时间,多酚含量均随着发酵温度升高而增加,且在发酵24 h时这种趋势尤为明显。而在发酵后期(24~48 h),温度升高对于多酚含量的变化没有明显趋势,因为在发酵前期,酵母菌快速生长,温度越高,酵母菌生长越快,因而35℃时酵母菌生长繁殖最快,其代谢产生的分解细胞壁的解聚酶(多糖降解酶、酯酶、糖苷酶)较多,且这些酶在较高温度时活性较高,高活性的解聚酶破坏结合态酚酸与阿拉伯木聚糖相结合的酯键,使细胞壁中的结合态酚酸和AX释放出来,因此,随着发酵温度的升高,多酚含量也增加。此结果与SAX增加的结果相一致。
3 结论
酵母菌发酵后,pH略有下降,TTA增加;小麦麸皮中蛋白质含量增加,而淀粉和膳食纤维含量随发酵时间延长显著下降,最大分别下降了32.68%和6.45%,不同发酵时间之间均有显著差异。
经酵母菌发酵,小麦麸皮中的SAX、总酚含量均有显著增加,木聚糖酶活性和植酸含量均降低。在适当的温度(30℃)和时间(24 h)下发酵,小麦麸皮中的SAX含量最高,是空白组的3倍左右,但当发酵时间过长(36 h、48 h),SAX含量减少;植酸含量随着发酵时间的延长而降低,最大下降了43.3%。多酚在35℃经24 h发酵后含量最高,增加了49.4%。
经酵母菌发酵,小麦麸皮成分得到改善,为其应用到面制品中提供参考。
[1]姚惠源.我国谷物加工学科的发展新走向[J].粮食加工,2010,35(1):10 -13 Yao Huiyuan.New development trend of grain processing discipline in China[J].Grain Processing,2010,35(1):10 -13
[2]Katina K,Laitila A,Juvonen R,et al.Bran fermentation as a means to enhance technological properties and bioactivity of rye[J].Food Microbiology,2007,24:175 -186
[3]李梦琴,王跃,赵杨,等.小麦麸皮超高压处理条件优化及其微观结构观察[J]. 食品与机械,2011,27(4):10 -14
Li Mengqin,Wang Yue,Zhao Yang,et al.Optimization on treatment by ultra-high-pressure to wheta bran and its microstructure observation with SEM[J].Food & Machinery,2011,27(4):10 -14
[4]王跃,李梦琴.超微粉碎对小麦麸皮物理性质的影响[J].现代食品科技,2011,27(3):271 -274
Wang Yue,Li Mengqin.Effects of Superfine Grinding on the Properties of Wheat Bran[J].Modern Food Science and Technology,2011,27(3):271 -274
[5]王兆生,刘传福,董海洲,等.麦麸加酸挤压改性及其对其理化特性的影响[J]. 中国粮油学报,2010,25(3):11 -15
Wang Zhaosheng,Liu Chuanfu,Dong Haizhou,et al.Extrusion Modification of Wheat Bran with Adding Acid and Effects on Physicochemical Property[J].Journal of the Chinese Cereal and Oils Assciation,2010,25(3):11 -15
[6]解春艳,郭红珍,史振霞,等.茶薪菇发酵对麦麸膳食纤维品质和生物活性的影响[J]. 食品科学,2013,34(1):230 -233
Xie Chunyan,Guo Hongzhen,Shi Zhenxia,et al.Effect of Agrocybe chaxingu fermentation Physico-chemical Properties and Bioactivity of Wheat Bran Dietary Fiber[J].Food Science,2013,34(1):230 -233
[7]Katina K,Juvonen R,Laitila A,et al.Fermented wheat bran as a functional ingredient in baking[J].Cereal Chemistry,2012,89(2):126 -134
[8]Zhang L X,Gao W Y,Chen X T,et al.The effect of bioprocessing on the phenolic acid composition and antioxidant activity of wheat bran[J].Cereal Chemistry,2014,91(3):255-261
[9]American Association of Cereal Chemists International.AACC approved methods 02-52.01 Hydrogen-ion activity(pH):E-lectrometric method[S].St Paul,MN:The Association,2000
[10]Douglas SG.A rapid method for the determination of pentosans in wheat flour[J].Food Chemistry,1981,7:139 -145
[11]Yao D,Ma P,Wang Y,et al.Optimization of extraction process for xylan from corncob by response surface methodology[J].Food Science,2011,32(8):111 -115
[12]Haug W,Lantzsch H J.Sensitive method for the rapid determination of phytate in cereals and cereal products[J].Journal of the Science of Food and Agriculture,1983,34:1423 -1426
[13]Yu L,Perret J,Harris M,et al.Antioxidant properties of bran extracts from “Akron”wheat grown at different locations[J].Journal of Agricultural and Food Chemistry,2003,51(6):1566 -1570
[14]Hartikainen K,Poutanen K,Katina K.Influence of bioprocessed wheat bran on the physical and chemical properties of dough and on wheat bread texture[J].Cereal Chemistry,2014,91(2):115 -123
[15]Coda R,Rizzello CG,Curiel JA,et al.Effect of bioprocessing and particle size on the nutritional properties of wheat bran fractions[J].Innovative Food Science & Emerging Technologies,2014,25:19 -27
[16]Oliver B,Oliver A H J,Hugh J C,et al.The influence of fermentation processes and cereal grains in wholegrain bread on reducing phytate content[J].Journal of Cereal Science,2014,59:3 -8.
Study on Effect of Yeast Fermentation on the Components of Wheat Bran
Cui Chenxiao Zhu Kexue Guo Xiaona Peng Wei Zhou Huiming
(School of Food Science and Technology,Jiangnan University,Wuxi 214122)
In this study we took use of saccharomycetes to yeast the wheat bran to decrease the phytic acid,and increased the soluble arabinoxylans(SAX)content and the total phenols content to improve the nutritive values of the wheat bran.Researched the influence of the fermentation temperature and time on the properties of wheat bran by means of testing the yeast PH and TTA as well as the content change of the components of wheat bran (starch,protein,dietary fiber,soluble SAX,phytic acid,total phenols)The results showed after the wheat bran being yeasted,that pH decreased from 6.5 to 6.09 at largest,and TTA increased from 3.0 mL to 6.9 mL;the protein increased obviously of 22.23%at largest;and the starch and dietary fiber decreased of 32.68%、6.45%at largest;the SAX and total phenols content all showed a tendency of increasing first and then decreasing,with the increasing of 212%and 49.4%at largest;the phytic acid decreased obviously,with the decreasing of 43.3%at largest after 35℃ 48 h yeasting.The protein,SAX and total phenols content of wheat bran increased separately 17.07%,212.06%and 42.08%after 24 h yeasting under 30℃,while the starch,dietary fiber and phytic acid decreased separately 11.03%,4.31%and 33.80%.In a word,the components of the wheat bran had the pronounced changes after being yeasted by saccharomycetes.
saccharomycetes,wheat bran,yeast,components
S3
A
1003-0174(2016)07-0025-05
中国博士后科学基金面上项目(2014M560396),国家“十二五”科技支撑计划(2012BAD34B01)
2014-11-11
崔晨晓,女,1989年出生,硕士,食品科学与工程
周惠明,男,1957年出生,博士,教授,主食与方便食品

