辽宁绒山羊羔羊体外胚胎生产技术的研究
郭 丹,宋先忱,张兴会,豆兴堂,李丰田,赵艳娇(辽宁省畜牧科学研究院,辽阳 111000)
繁殖与生理
辽宁绒山羊羔羊体外胚胎生产技术的研究
郭 丹,宋先忱,张兴会,豆兴堂,李丰田,赵艳娇
(辽宁省畜牧科学研究院,辽阳 111000)
以4~8周龄的辽宁绒山羊母羔为研究对象,研究不同年龄阶段羔羊卵泡发育数量和发育质量的变化,同时还比较了不同基础液作为受精液对体外受精和早期卵裂的影响,并尝试研究了在早期胚胎的发育培养液中添加EDTA的效果。结果表明:6~8周龄母羔的卵母细胞体外成熟率和受精率均显著高于4~6周龄母羔;利用SOF液作为受精体系的基础液时体外受精的效果更好,卵裂率达42.47%;在早期胚胎的发育液中添加10μmol/L EDTA可有效提高16细胞以上的胚胎数。
辽宁绒山羊;羔羊;超数排卵;体外受精;胚胎移植
幼畜体外胚胎移植(juvenile in vitro embryotransfer,JIVET)技术是利用幼龄母畜卵巢对激素诱导卵泡发育敏感,卵母细胞生产效率高于成年母畜数倍的生理特点,采用外源促性腺激素处理幼龄母畜,诱导卵巢卵泡超数发育,将活体取卵、卵母细胞成熟、体外受精、胚胎移植等技术相结合而形成的幼畜体外胚胎生产的技术[1]。传统的超数排卵与胚胎移植(MOET)方案用于成年母羊,所需的一个世代间隔至少为12个月,将JIVET技术用于4~8周龄羔羊,可将世代间隔缩短至6~7个月。有效缩短家畜繁殖的世代间隔,充分发掘优良遗传性状母畜的繁殖潜能,提高畜群的遗传改良速度与生产效率,为家畜育种提供丰富的遗传资源。
1 试验材料
1.1 供、受体母羊
选择年龄4~8周龄、体重5~8 kg、体质健康、体况良好、精神状态佳的哺乳期羔羊10只,按照年龄分为2组,其中4~6周龄的羔羊为试验I组,6~8周龄的羔羊为试验II组,每组5只。同时选择20只体况良好、体格健壮的经产母羊作为胚胎移植的受体母羊,均由辽宁省辽宁绒山羊育种场有限公司提供。
1.2 主要仪器设备
活体采卵泵:Craft,英国;电子天平:AB135-S,瑞士;CO2培养箱:HERACELL150,美国;超纯水仪:Pulse1+PURELAB flex,美国ELGA;显微镜:Leica M165C,德国。
1.3 超数排卵及同期发情药物
促卵泡素FSH(100 IU/支,宁波第二激素厂产),促卵泡素FSH(400mg/瓶,加拿大产),孕马血清促性腺激素PMSG(1 000 IU/支,宁波市三生药业有限公司产),促黄体素LH(40mg/瓶,加拿大产)。
1.4 细胞体外培养药物
Medium 199(with Earle’ssalts):M3769,Sigma;FSH(加拿大产,400mg/瓶,批号:R9D19A);肝素:H01923,Bioszune分装;发情羊血清(ESS):绒山羊发情当天用常规血清制备法自制,56℃灭活处理30min;17β-雌二醇:E8875,Sigma分装;BSA:4919,Sigma分装;Mineraloil:M5904,规格500mL,Sigma分装;E2:E8875,Sigma分装;其他试剂除特殊说明外均购自Sigma公司。
1.5 培养液的配制
采卵液:M199+5mmol/LNaHCO3+10mmol/LHEPES+ 10mmol/LHEPES-Na+0.01g/L肝素钠+1%FCS+0.065g/L青霉素G钠+0.05 g/L链霉素钠。
卵母细胞成熟液:M199原液+15%ESS+10μg/mL FSH+10μg/mLLH+1μg/mLE2。
精子获能液:SOF(TALP)基础液+10%ESS+25μg/mL肝素+10μL/mL青链霉素。
受精液:SOF(TALP)基础液+6mg/mL BSA+1μg/mL亚牛磺酸钠+10μL/mL青链霉素。
胚胎发育液:SOF(TALP)基础液+1%非必需氨基酸(V/V)+1%必需氨基酸(V/V)+8mg/mL BSA+10μmol/L EDTA(EDTA组有,对照组没有)。
2 方法
2.1 羔羊的超排方案
羔羊超数排卵采取后腿内侧肌肉注射,分4针注射,第1针为国产的PMSG(300 IU),后3针为加拿大产的FSH(40mg),每针间隔12 h。超排药物均需统一用稀释液溶解后,用移液器按计量分装到EPPENDOF管内,冷冻保存,避免药物因反复冻融而导致药物成分的变化。
2.2 卵母细胞的采集
采卵方法为常规手术法,在超排处理最后一针结束后10~12h手术,采用活体采卵方法收集卵母细胞,用10mL注射器抽吸卵巢上2~6mm卵泡内的卵泡液,转移入离心管中,在无菌操作间用实体显微镜捡取卵丘-卵母细胞复合体(COCs)。
2.3 卵母细胞成熟培养
将获得的卵母细胞用采卵液漂洗干净后,按照细胞级别检出,将A、B级别的卵母细胞在成熟液中洗3次,移入100μL成熟液滴中(Nunc产35mm×10mm培养皿,液滴上覆盖矿物油,在培养皿中预先培养2 h),每个液滴放入15~20枚卵母细胞,置于5%CO2、饱和湿度和38.5℃的二氧化碳培养皿中,成熟培养24 h。
2.4 体外受精操作
2.4.1 精子获能 取0.25mL的细管冷冻精液(辽宁省辽宁绒山羊原种场有限公司提供)2~3管,在37℃恒温水浴锅中解冻,在显微镜下观察精液质量。取镜检合格的精液150~200μL,轻轻加入到含有800μL获能液的圆底玻璃试管中(38.5℃、5%CO2下平衡4 h),竖直轻轻地放入CO2培养箱内,使精子获能上游20~30min。
2.4.2 卵母细胞准备 将成熟培养24 h后的卵母细胞在0.1%的透明质酸酶液中反复吹打冲洗1次,除去部分卵丘细胞,保留2~3层卵丘细胞,再将卵母细胞转移到受精液中,用受精液洗涤2~3遍,将卵母细胞转移到含有受精液的四孔板中。四孔板每孔中含有400μL受精液,上覆盖矿物油,预先在38.5℃、5%CO2的条件下平衡4 h。每孔加入25~30枚卵母细胞。
2.4.3 体外受精操作 取微量圆底玻璃试管中的上清液,移入1.5mL的离心管中,1 000 r/min离心5min,弃上清,再加入200μL受精液悬浮,显微镜下再次检查精子活力和密度,根据精子密度取适量上清液,使精子密度为1×106个/mL,轻轻加入到含有卵母细胞的四孔板中,避免产生气泡,并将四孔板放入CO2培养箱,38.5℃、5% CO2、饱和湿度下,精卵受精作用20 h。
2.5 早期胚胎体外发育培养
精卵受精24 h后,将假定合子转移到胚胎发育洗涤液中,巴氏捡卵管轻轻吹打假定合子周围的卵丘细胞与粘附的精子,使之脱落。体式镜下配合捡卵管拨动假定合子,观察。将假定合子在胚胎发育液中洗涤2~3遍,转移到含胚胎发育液的四孔板中(每孔600μL发育液,上覆盖矿物油),每个微滴放入假定合子15~20枚,在38.5℃、5%CO2、饱和湿度下培养24 h后观察卵裂情况。
2.6 受体羊同期发情及胚胎移植
受体羊阴道埋植CIDR 15 d,撤去CIDR的同时每只受体羊注射PMSG 250 IU。于受体羊发情后2 d,采用手术法将发育到4~8细胞的体外胚胎移入受体羊卵巢上黄体发育良好的同侧输卵管内,每只受体移入体外受精胚胎2~3枚。统计移植受体的产羔结果。
2.7 统计分析
试验数据用SPSS 13.0软件One-Way ANOVA程序进行方差分析,差异显著性用t检验,P>0.05为差异不显著,P<0.05为差异显著,P<0.01为差异极显著。
3 结果与分析
3.1 羔羊不同周龄阶段对卵母细胞体外成熟培养的影响
从表1可见,两组平均回收的卵母细胞数可达59.5枚,说明本试验中所采取的超数排卵方案是较理想的。其中I组显著高于II组(P<0.05),平均回收卵母细胞数可达66.6枚,说明卵巢对激素的反应虽然存在差异,但是年龄对卵泡数量和胚胎生产的影响较大。结果表明,4~6周龄母羊的诱导卵泡发育效果较理想,6~8周龄母羊次之。而两组平均体外成熟的卵母细胞数为23.0枚,说明体外成熟培养体系也是成熟稳定的。从表2可以看出,虽然两组平均成熟的卵母细胞数差异并不显著(P>0.05),但II组的体外成熟率和卵裂率显著高于I组,说明6~8周龄母羊的体外发育能力比4~6周龄母羊的要强。因此,在选择供体羔羊时,尽量选择6~8周龄的母羊,效果会更好一些。
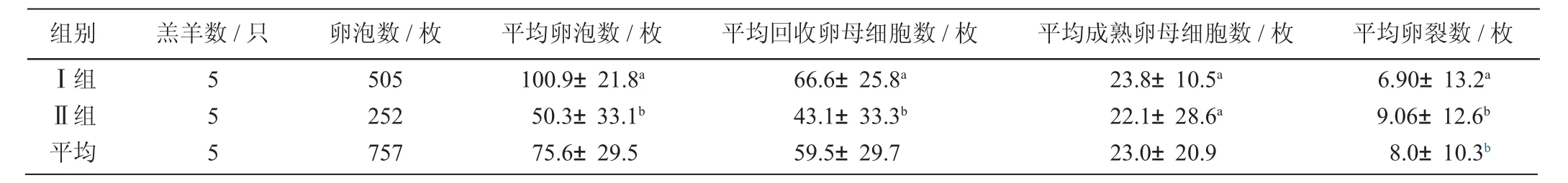
表1 羔羊不同周龄阶段对卵母细胞体外成熟的影响
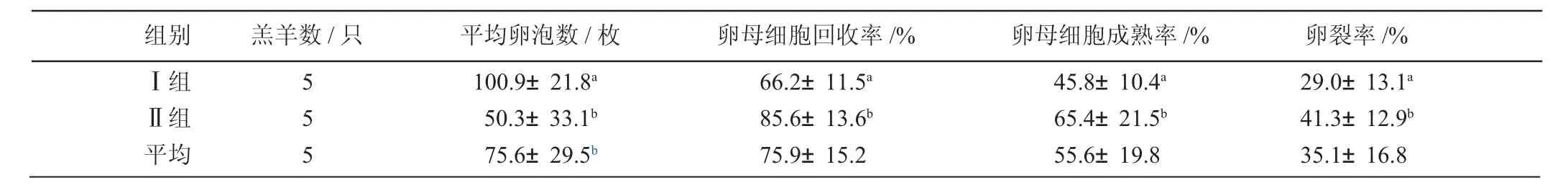
表2 羔羊不同周龄阶段超排处理后的发育情况
3.2 不同受精体系对卵裂及胚胎发育的影响
本试验采用了TALP基础液和SOF基础液作为受精体系的两种基础液,其他添加成分均一致。从表3可见,SOF受精体系卵裂率显著高于TALP(P<0.05)。因此,对于辽宁绒山羊羔羊体外胚胎的生产应选择SOF受精体系更为高效。

表3 受精体系对胚胎发育的影响
3.3 发育液中添加10μmol/LEDTA对幼羔早期胚胎体外发育的影响
EDTA作为一种抗氧化剂,可以清除胚胎代谢过程中所产生的有害自由基,有利于胚胎的体外发育[2]。因此,在本试验中,设计了添加10μmol/LEDTA的EDTA组和无添加的对照组。由表4可知,EDTA组受精卵48 h卵裂率(53.3%)显著高于对照组(37.3%)(P<0.05);体外受精IVF后第5天发育至16细胞以上胚胎的百分率(78.1%)也极显著高于对照组(45.4%)(P<0.01)。

表4 发育液中添加EDTA对羔羊卵母细胞体外胚胎发育的影响
3.4 幼羔超排生产体外胚胎移植产羔结果
试验共移植受体母羊20只,妊娠3只,产下4只羔羊,幼羔超排所生产体外胚胎进行胚胎移植的妊娠率15%,产羔率13%,其中3只健康状况良好(图1),1只为死羔。

图1 辽宁绒山羊羔羊体外胚胎生产照片
4 结论与讨论
4.1 供体母羔的年龄对体外成熟和体外受精效果的影响
供体羔羊个体差异对卵母细胞影响很大,尤其是其发育至囊胚的能力有很大差异。理想的供体羔羊在激素诱导处理时将产生大量的卵泡及有发育能力的卵母细胞。然而不同发育阶段的羔羊激素处理后卵巢的反应程度不一。Armstrong等[3]提出从幼龄羔羊收集卵母细胞,年龄在4~6周龄时较理想,这时处理卵泡数量多。Ptak等[4]认为1月龄羔羊卵巢反应最敏感,3月龄较弱,而2、5、7月龄时明显与1月龄不同。Earl等[5]报道了从8~9周龄激素诱导与4月龄非诱导羔羊所获卵母细胞体外发育率相似。O’Brien等[6]报道激素诱导3~6周龄羔羊获得的的卵母细胞的体外发育能力要比16~24周龄羔羊高。Morton等[7]观察到从16~24周龄未作激素诱导羔羊获得的卵母细胞发育至囊胚期的比率与成年母羊相近,但3~6周龄羔羊激素诱导后获得的卵母细胞的发育能力有所降低。这些研究比较了幼龄羔羊激素诱导与大龄对照羔羊所获卵母细胞的发育能力,确定了羔羊年龄与激素诱导处理的结果相关。总之,6~8周龄羔羊是采集大量卵母细胞,获得具有完善发育能力的卵母细胞的理想供体。然而,选择供体羔羊目前还没有特效方法。
4.2 不同受精体系对卵裂的影响
国外较多采用TALP液研究性成熟前山羊卵母细胞的体外受精,用添加了50μg/mL肝素的mDM液获能,用添加1μg/mL亚牛磺酸的TALP液受精[8]。张锁链等[9]采集种公羊新鲜精液,以0.5μM A-23187处理1min或在培养液中添加50μg/mL肝素获能,用2mM咖啡因、20μg/mLBSA的BO液做受精液,2~4细胞胚的卵裂率分别为28.6%和41.9%。武建朝[10]的研究结果表明,TALP受精液(卵裂率42.11%)比BO更适合母羔体外受精及卵裂。本试验结果显示,SOF受精体系更适合绒山羊母羔卵母细胞体外受精。
4.3 不同胚胎体外发育体系对早期胚胎发育能力的影响
许多研究认为,幼龄动物获得的胚胎发育速度减缓是体外胚胎成活率低的原因。另外,低的成活率都伴随着高比例的胚胎或胎儿损失以及干尸化情况的出现。Ptak等[11]报道,妊娠附植着床(40~60 d)及胎儿损失(80~100 d)使得628枚胚胎移植后仅有6%存活至妊娠期满,8%的分裂胚生产出健康成活的后代[11]。
Kelly等[2]证实,初情期前羔羊作供体所采集的卵母细胞具有产生后代的能力。本研究幼羔超排所生产体外胚胎移植后成功产下4只羔羊,进一步支持了上述研究结论,但移植产羔率仅15%,表明移植后的胚胎在发育过程中丢失率偏高[2]。幼羔生产体外胚胎进行移植后的胚胎丢失率(80%)高于成年母羊(60%)[11],其原因之一是幼羔体外生产的胚胎不能由母源基因组表达向胚胎基因组表达的顺利过渡[3]。
在早期胚胎发育过程中,某些基因的激活会引起水中有害自由基含量上升,导致有丝分裂异常,从而使体外胚胎发育阻滞。EDTA作为一种抗氧化剂,可以清除胚胎代谢过程中所产生的有害自由基,有利于胚胎的体外发育。因此,在本研究中开展了在发育液中添加EDTA对幼羔早期胚胎体外发育影响的研究,结果表明,EDTA组受精卵48 h卵裂率(53.3%)显著高于对照组(37.3%)(P<0.05);体外受精IVF后第5天发育至16细胞以上胚胎的百分率(78.1%)极显著高于对照组(45.4%)(P<0.01)。表明在早期胚胎发育液中添加10μmol/LEDTA有利于提高幼羔供体所生产体外胚胎的发育能力。
[1] Kennedy JP,Worthington CA,Cole ER.The postnataldevelopmentof the ovary and uterus of themerion lamb[J].Reprod Fertil,1994,36:275-282.
[2] Kelly JM,Kleemann DO,Walker SK.Enhanced effieiency in the prodution of offspring from 4 to 8 weeks old lambs[J].Theriogenology,2005,63(7):1876-1890.
[3] Armstrong DT.Effectsofmaternalageon oocytedevelopmentcompetence[J].Theriogenology,2001,55:1303-1322.
[4] Ptak G,LoiP,Dattrna M,et al.Offspring from one-month-old lambs:studieson the developmental capability of prepubertal oocytes[J].Bio Reprod,1999,61:1568-1574.
[5] Earl CR,Irvine B J,Roe JP,etal.Developmentof techniques for the prodution ofviableembryos from six to sevenweek old lambs[J].Proc AustSoc Anim Prod,1994,20:428.
[6] O’Brien JK,Beck N F G,MaxwellW M C,et al.Effect of hormone pretreatmeat ofprepubertalsheep on the prodution and developmental capacityofoocytes in vitro and in vivo[J].Reprod Fertile Dev,1997a,9:625-631.
[7] Morton K M1,Catt S L,Maxwell W M C,et al.Effects of lamb age. Hormone stimulation and response to hormone stiulation on the yield and in vitro developmental competenceofprepubertal lamb oocytes[J]. Reprod FertilDev,2005,17(6):593-601.
[8] Vegofia A,Ana R,Jimenez-Macedo,etal.Effect of oocyte diameter on meiotic competence,embryo developmeont,P34(cdc2)expression and MPF activity in prepubertal goatoocytes[J].Theriogenology,2007,67:526-536.
[9] 张锁链,刘东军,度洪式,等.羔山羊的超数排卵及体外受精[J].内蒙古大学学报:自然科学版,1994,25(2):205-208.
[10]武建朝.利用性成熟前山羊卵泡卵母细胞体外生产胚胎的研究[D].南京:南京农业大学,2007.
[11]Ptak G,Matsukawak,Palmieri C,et al.Developmental and functional evidenceof nuclear immaturity in prepubertaloocytes[J].Hum Reprod,2006,21(9):2228-2237.
Study on the in Vitro Em bryo Production of Liaoning Cashm ere Kids
GuoDan,Song Xianchen,Zhang Xinghui,etal
(Liaoning InstituteofAnimalHusbandry,Liaoyang111000,China)
In this study,4~8-week-old Liaoning cashmere female kidswere used to study the change of follicular quantity and quality,meanwhile theeffectsofdifferentbasison the in vitro fertilization and early cleavagewere compared,by theway,theeffect ofaddition of EDTA in themedium on early embryo developmentwas studied.The results showed that the oocytematuration rate and fertilization rate of 6~8-week-old kidswere significantly higher than those of 4~6-week-old kids;SOF solution was better than TALP for the in vitro fertilization and the cleavage rate reached 42.47%;the addition of EDTA at the concentration of 10 μmol/L could effectively improve thenumberof16-cellormoreembryos.
cashmere kid;superovulation;embryo;in vitro fertilization;transfer
S827.3
A
2095-3887(2015)04-0020-04
10.3969/j.issn.2095-3887.2015.04.006
2015-05-22
辽宁省自然科学基金项目(201202110);辽宁省自然科学基金项目(2013020068);辽宁省自然科学基金项目(2014020179)
郭丹(1981-),女,高级畜牧师,硕士。研究方向:绒山羊育种。

