5个绵羊品种Cytb基因序列多态性及系统进化研究
徐尚荣(青海省畜牧兽医科学院,西宁 810016)
5个绵羊品种Cytb基因序列多态性及系统进化研究
徐尚荣
(青海省畜牧兽医科学院,西宁 810016)
利用克隆测序方法对杜泊羊、藏羊、小尾寒羊、哈萨克羊和阿勒泰羊DNA细胞色素b基因全序列进行克隆和测序,并对基因特点和系统发育进行分析。结果表明:5个绵羊品种线粒体细胞色素b基因全长1 140 bp,基因特点显示A+T含量(58.6%)比G+C(41.4%)含量高,表现出一定的碱基偏好,转换多于颠换,表现较高的转换偏向;基于线粒体细胞色素b基因构建了5个绵羊品种的NJ树,表明阿勒泰羊与哈萨克羊亲缘关系最近,杜泊羊与阿勒泰羊亲缘关系最远。
绵羊;细胞色素b基因(Cytb);系统进化
高等动物线粒体是共价闭合的环状双链DNA分子,具有较高的突变率和母系遗传特征,其中细胞色素b (Cytb)基因是线粒体基因中研究较为清楚的遗传标记,特别适合种内、种间及种以上分类阶元的进化研究[1-6]。
杜泊羊原产于南非,是由无角陶赛特羊和黑头珀翔羊杂交,经大量杂交选育而形成的肉用新品种羊。因其适应性强,早期生长发育快,遗传性稳定,胴体质量好,被誉为“钻石级”肉用绵羊而闻名于世[7-8];藏羊、小尾寒羊、哈萨克羊和阿勒泰羊具有优良种质特性,是我国优良地方绵羊品种[9]。
巩元芳等[10]用DNA(mtDNA)细胞色素b基因研究了几个地方绵羊品种线粒体多态性,表明我国地方绵羊品种的起源可能是单一的。管松等[11]研究了中国西南地区5个地方绵羊群体mtDNA遗传多样性,得出西藏绵羊有3个母系来源,云南绵羊有2个母系来源。张传生等[12]研究了5个绵羊品种线粒体DNA基细胞色素b(Cytb)基因片段,推测出其中4个品种绵羊具有共同的母系祖先。因此,mtDNA Cytb基因可以作为一种遗传标记,用来研究绵羊的起源进化以及亲缘关系。本研究以杜泊羊、藏羊、小尾寒羊、哈萨克羊和阿勒泰羊为材料,测定5个绵羊品种mtDNA Cytb基因序列,并进行对比分析,以期为绵羊品种的起源分化及遗传亲缘关系研究提供理论依据。
1 材料与方法
1.1 材料
实验用杜泊羊、藏羊和小尾寒羊血液采自青海,哈萨克羊和阿勒泰羊血液采自新疆,各30只,所采血样均为6mL,ACD抗凝,-20℃冻存。
1.2 方法
1.2.1 基因组DNA提取 基因组总DNA的提取,按照天根生物有限公司动物组织DNA提取试剂盒说明书操作。
1.2.2 引物设计与线粒体DNA细胞色素b基因片段的扩增 在GenBank下载绵羊Cytb基因的序列(登录号为:NC009510),用DNAMAN进行比对,查出保守序列,利用primer5设计引物,根据目的基因Cytb、pGM-T载体的特点,设计两端含有限制性内切酶EcoRⅠ酶切位点的引物,正链为:5′-atgatcaacatccgaaaaacc-3′,反链为:5′-tcttcattttaggaggt-3′。
PCR扩增反应体系:各绵羊DNA样品1μL(75 ng/μL),10×Buffer 2.5μL,2.5 mmol/L的dNTP 2μL,25 mmol/LMgCl21μL,正向引物和反向引物(10μmol/L)各为1μL,TaqDNA聚合酶0.3μL(5U/μL),加灭菌双蒸水至25μL。未加DNA样品为阴性对照。反应程序为:94℃,2min预变性;94℃、60 s,44℃、60 s,72℃、90 s,35个循环;最后72℃延伸5min。扩增产物用1.0%的琼脂糖凝胶电泳检测扩增效率。
1.2.3 纯化与测序 用北京百泰克生物技术有限公司回收试剂盒进行纯化与回收,将Cytb的PCR纯化产物与pGM-T连接并转化感受态DH5a,进行蓝白斑鉴定,筛选阳性克隆,并命名为PGM-T-Cytb。对阳性克隆进行PCR和EcoR I酶切鉴定,对鉴定正确的质粒送由上海生工进行测序。
1.2.4 序列分析和系统发育树的构建运用ClustalX软件将测得序列进行比对,辅以人工校正。利用MEGA 3.1软件对各绵羊品种Cytb基因序列进行种内和种间差异评估[13-14],用邻接(Neighbour-Joining,NJ)法构建系统发育树,系统发育树各分支的置信度由1 000次自举法(Bootstrap)检验。
2 结果
2.1 PCR扩增结果与酶切鉴定
根据所设计的引物对杜泊羊、藏羊、小尾寒羊、哈萨克羊和阿勒泰羊5个绵羊品种进行mtDNA Cytb基因的PCR扩增。结果扩增出了预期的PCR产物(见图1),蓝白斑筛选后对阳性克隆进行酶切鉴定(见图2)。
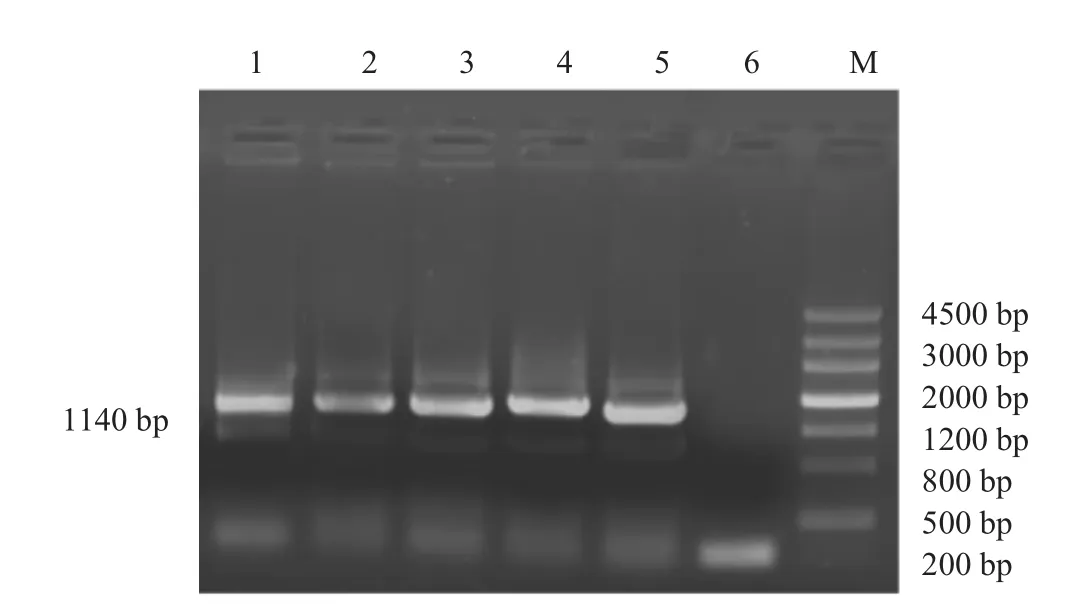
图1 mtDNA Cytb基因的PCR扩增产物

图2 PGM-T-Cytb的酶切鉴定
2.2 mtDNA Cytb基因序列变异特点
对本实验测定的杜泊羊、藏羊、小尾寒羊、哈萨克羊和阿勒泰羊的细胞色素b基因序列进行比对。同源比对并剪切非目的序列后得到1 140 bp的同源基因序列。在研究的5个绵羊品种序列中,A、T、C、G碱基的平均含量分别为31.5%、27.1%、28.5%和12.9%(见表1)。A+T的含量为58.6%,显著高于G+C的含量41.4%。其中G的含量在第3位密码子上较低,阿勒泰羊为2.9%、藏羊为3.2%、杜泊羊为3.4%;第2位的T含量较高,平均为42.1%。测定的5个绵羊品种Cytb基因序列共发现15个变异位点分别位于207、292、309、328、393、396、476、495、696、735、813、933、939、990、997,占分析位点总数的1.13%。这些变异位点包含13个转换和2个颠换,其中T-C的转换比A-G转换发生的多,A-T颠换高于C-G颠换,未检测到A-C和T-G的颠换,核苷酸的替换主要以转换为主,转换多于颠换,表现较高的转换偏向。
2.3 5 个绵羊品种间的遗传距离
使用MEGA软件的nucleotide Kimura2-parameter模型计算5个绵羊品种间的遗传距离(见表2)。从Kimura双参数距离可以看出,不同绵羊品种之间的距离差异比较大,从0.000 76~0.012 43,其中哈萨克羊与阿勒泰羊间的Kimura双参数(2-parameter)遗传距离最小(0.000 76)、杜泊羊与哈萨克羊间的Kimura双参数(2-parameter)遗传距离最大(0.012 43)。

表1 5个绵羊品种细胞色素b基因的密码子组成%

表2 5个绵羊品种细胞色素b基因序列的双参数距离
2.4 5 个绵羊品种系统发育树的构建
利用本实验测定的杜泊羊、藏羊、小尾寒羊、哈萨克羊和阿勒泰羊的细胞色素b基因序列,通过MEGA 3.1软件基于Kimura两参数距离采用邻位相接法(NJ)(见图3),构建5个品种绵羊的系统发育树。哈萨克羊与阿勒泰羊序列聚集在一起,提示它们可能起源同一母系。哈萨克羊、阿勒泰羊序列与藏羊序列交错聚在一起(BCL=100%),说明它们的亲缘关系比较近。
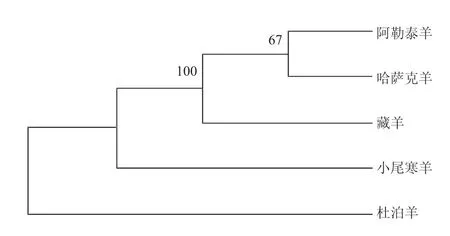
图3 基于Cytb基因序列构建的5个绵羊品种NJ树
3 讨论
基于GenBank已公布的绵羊Cytb基因的保守序列,成功扩增出杜泊羊、藏羊、小尾寒羊、哈萨克羊和阿勒泰羊Cytb基因序列全长为1 140 bp。A+T的含量为58.6%,显著高于G+C的含量41.4%,其中G的含量在第3位密码子上较低,阿勒泰羊为2.9%、藏羊为3.2%、杜泊羊为3.4%,表现出一定的碱基偏好,与以往研究的哺乳动物Cytb基因碱基偏好一致[15-16];测定的5个绵羊品种Cytb基因序列共发现15个变异位点,这些变异位点包含13个转换和2个颠换,其中T-C的转换比A-G转换发生的多,A-T颠换高于C-G颠换,未检测到A-C和T-G的颠换,核苷酸的替换主要以转换为主,转换多于颠换,表现较高的转换偏向。
细胞色素b基因已成为研究生物进化史和分类的重要工具[17-19]。近年来,细胞色素b基因在绵羊不同种内种间的系统发生和群体进化方面得到广泛应用[20]。本研究测定的5个绵羊品种遗传距离在0.000 76~0.012 43之间,其中哈萨克羊与阿勒泰羊间的遗传距离最小,为0.000 76,杜泊羊与哈萨克羊间的遗传距离最大,为0.012 43,结果提示与这些羊的起源、分化及地理分布一致。
本研究对杜泊羊、藏羊、小尾寒羊、哈萨克羊和阿勒泰羊Cytb基因进行克隆,并初步分析了5个绵羊品种Cytb基因序列变异特点和系统进化,为了解绵羊线粒体基因组的遗传特点和绵羊品种的起源、分化及亲缘关系提供一定的理论依据。
[1] 周材权,周开亚,胡锦矗.从线粒体细胞色素b基因探讨矮岩羊物种地位的有效性[J].动物学报,2003,49(5):578-584.
[2] Meyer A,Kocher TD,BasasibwakiP,etal,Monophyletic origin of Lake Victoria cichild fishes suggested bymitochondrialDNA sequences[J]. Nature,1990,347:550-553.
[3] 杨金权,刘焕章.两种鲿科鱼类在长江和珠江流域Cytb基因序列变异性分析[J].水生生物学报,2003,27(3):253-257.
[4] 陈永久,张亚平,邹希明,等.犬科的线粒体细胞色素b DNA序列及其分子系统学研究[J].遗传学报,2000,27(1):7-11.
[5] 刘向华,王义权,刘忠权,等.从Cytb基因序列探讨鹿亚科动物的系统发生关系[J].动物学研究,2003,24(1):27-33.
[6] 曹丽荣,王小明,方盛国,等.从细胞色素b基因全序列差异分析岩羊和矮岩羊的系统进化关系[J].动物学报,2003,49(2):198-204.
[7] Schoeman S J.A comparative assessment of Dorper sheep in different production environments and systems[J].Small Ruminant Research,2000,36(2):137-146.
[8] Scott Campbell.Transplanted South African Manages Family Dorper farm ranch and rural living[J].San Angelo,2005,87(1):26-27.
[9] 赵有璋.现代中国养羊[M].北京:金盾出版社,2005:138-721.
[10]巩元芳,李祥龙,刘铮铸,等.几个地方绵羊品种线粒体DNA(mtDNA)细胞色素b基因多态性研究[J].中国兽医学报,2006,26(2):213-215.
[11]管松,何晓红,浦亚斌.中国西南地区5个地方绵羊群体mtDNA遗传多样性及系统进化研究[J].畜牧兽医学报,2007,38(3):219-224.
[12]张传生,耿立英,万海伟,等.4个绵羊品种线粒体细胞色素b基因的序列差异和系统进化研究[J].畜牧兽医学报,2005,36(4):313-317.
[13]Thompson JD,HigginsDG,Gibson TJ.ClustalW:improving the sensitivity of progressive multiple sequence alignment through sequence weighting,position-specific gap penaltiesand weightmatrix choice[J]. Nucleic AcidsRes,1994,22:4673-4680.
[14]Kumar S,Tamura K,NeiM.MEGA3:Integrated software formolecular evolutionary geneticsanalysisand sequence alignment[J].Briefings in Bioinformatics,2004,5:150-163.
[15]曹祥荣,束峰珏,张锡然,等.毛冠鹿与3种麂属动物的线粒体细胞色素b系统进化分析[J].动物学报,2002,48(1):44-49.
[16]陈惟昌,陈志华,王自强,等.线粒体遗传密码及基因组遗传密码的对称分析[J].生物物理学报,2002,18:87-94.
[17]Smithm F,Patton JL.Variation inmitochondrialcytochromeb sequence in naturalpopulations of south American akodontine ro-dents[J].Mol BiolEvo,1991,8(1):85-103.
[18]Tanaka-ueno T,Matsuim,Sato T,etal.Phylogenetic relationshipsofbrown frogswith 24 chromosomes from Far EastRussiaand Hokkaidoassessedbymitochondrialcytochromebgenesequences[J].ZooSci,1998,15:289-294.
[19]Briolay J,Galtier N,BritoRM,etal.Molecular phylogeny ofcyprinidae inferred from cytochrome b DNA sequences[J].Mol Phylogenet Evo,1998,9:100-108.
[20]国家畜禽遗传资源委员会组.中国畜禽遗传资源志——羊志[M].北京:中国农业出版社,2011.
Study on Polym orphism of Cytb and Phylogeny Evolution of Five Sheep Breeds
Xu Shangrong
(QinghaiAcademy ofAnimaland Veterinary Science,Xining 810016,China)
The experiment cloned and sequenced the whole sequences of mitochondrial DNA cytochrome b gene from Dorper sheep,Tibetan Sheep,Small TailHan Sheep,Kazak sheep and Altay sheep.The genetic characteristicsand phylogenywere analyzed.The resultsshowed that the complete length ofmitochondrialDNA cytochromeb gene in the fivesheep breedswas1 140 bp. The nucleotide contentof A+T(58.6%)washigher than thatofG+C(41.4%),indicating basespreference.Transitionsweremore than transversions,indicating the high transitionspreference.The NJtree of five sheep breedswas constructed based onmitochondrial cytochrome b gene.In the tree,the genetic relationship between Altay sheep and Kazak sheep were the closest,while the relationship between Dorpersheep and Altay sheepwere the farthest.
sheep;cytochromeb gene;phylogeny
S826.2
A
2095-3887(2015)04-0009-04
10.3969/j.issn.2095-3887.2015.04.003
2015-06-23
国家星火计划项目(2013GA870006)、(2014GA870001);青海省科技促进新农村计划项目(2013-N-516)、(2013-N-517)
徐尚荣(1970-),男,副研究员。研究方向:动物繁殖。
——山上的村庄

