鸡睾丸间质细胞的分离及其鉴定的研究
杨淑华,于立辉,张 燚,龙 淼,李 林,高 锋,姜丽莹,韩 阳,王 雪,何剑斌
(沈阳农业大学畜牧兽医学院,辽宁 沈阳 110866)
鸡睾丸间质细胞的分离及其鉴定的研究
杨淑华,于立辉,张 燚,龙 淼,李 林,高 锋,姜丽莹,韩 阳,王 雪,何剑斌★
(沈阳农业大学畜牧兽医学院,辽宁 沈阳 110866)
为了寻找一种快速、高效的体外分离、纯化鸡睾丸间质细胞的方法,本试验采用Ⅱ型胶原酶消化以及PercoII分离液梯度离心,建立鸡睾丸间质细胞分离、纯化方法。结果表明,PercoII分离液梯度离心后,纯化的间质细胞3β-羟基类固醇脱氢酶(3β-HSD)染色阳性率可达92.5%±1.7%,且在37℃、5%CO2条件下培养的细胞生长良好。该提取方法效果良好,可作为研究禽类生殖调控的细胞模型。
鸡;睾丸间质细胞;3β-HSD染色;梯度离心法
睾丸间质细胞(interstitial cell)又称Leydig cell,1850年由Leydig首先发现并加以描述,20世纪60年代确定它是合成分泌雄激素的内分泌细胞,分布在睾丸生精小管间的疏松结缔组织内,其含量占睾丸细胞数量的2%~4%[1]。其主要功能是分泌睾酮,分泌活动受丘脑下部、垂体及自身的调节,动物体内约95%的睾酮由间质细胞分泌[2],睾酮被运输到身体各处的靶器官,通过与受体结合发挥重要的生理功能[3-4]。目前,国内外对大鼠、小鼠睾丸间质细胞分离培养的研究较多[5-8],其他哺乳动物间质细胞分离培养的研究也有报道[9-10],但禽类睾丸间质细胞的分离及鉴定培养尚无研究。本试验在参阅相关文献基础上,以Ⅱ型胶原酶消化睾丸组织,利用3β-HSD染色法对睾丸间质细胞进行鉴定,采用PercoII密度梯度离心法纯化分离的鸡睾丸间质细胞,获得高纯度的鸡睾丸间质细胞,为完善禽类睾丸间质细胞体外培养技术提供依据。
1 材料与方法
1.1 主要试剂去氢表雄酮(DHEA)、吖啶橙、0.25%Trypsin-EDTA、二甲基亚砜(DMS0)、MTT、DMEM/F-12细胞培养液、Percoll细胞分离液,胶原酶Ⅱ型系购于北京鼎国昌盛生物技术有限责任公司;无支原体胎牛血清购于浙江天杭生物科技有限公司;庆大霉素购于哈药集团制药总厂;异丙醇购于国药集团化学试剂有限公司;台盼兰购于Sigma公司。
1.2 试验动物2.5月龄的雄性海兰鸡,由沈阳农业大学实验场提供。
1.3主要试剂的配制 3β-HSD染液的配制:称取DHEA 0.0072 g,NAD0.159,NBT0.059,尼克酰胺0.08 g;DHEA溶于2.5 mL丙酮中,可加热助溶;然后将所有物质溶于40 mL的D-Hank’s液中,搅拌使其允分溶解,用0.22 μm的微孔过滤器过滤除菌,分装后4℃保存备用,长期保存在-20℃。
1.4 Leeyyddiigg细胞的分离与纯化①取2月龄左右雄性鸡,颈椎脱臼法处死,浸入75%乙醇中5 min,放入无菌的托盘,转移到超净台内,双侧腹股沟管内侧斜切U型切口,用眼科剪和镊子小心提起睾丸,去除其周围的脂肪组织,从附睾尾部剪断精索,获取完整的睾丸。②将睾丸浸入有少量冰冷的D-Hank’s缓冲液的培养皿中,冲洗3遍。置于另一无菌培养皿中,小心地剥去睾丸被膜,并尽量剔去睾丸组织内的细小血管,保持睾丸形态的完整和曲细精管的连续性,用D-Hank’s液冲洗睾丸实质1遍。③将分离干净的睾丸实质放入无菌的小青瓶内,按体积比1:5的比例加入胶原酶Ⅱ(1 mg/mL),密封瓶口。37℃,振荡消化约l0 min,至睾丸组织形状刚好消失,曲细精管间组织松散但连续而无明显断裂时,加入适量无血清的DMEM/F12培养液终止消化。④消化液经200目不锈钢筛过滤,滤液于4℃,1 000 r/min离心8 min,去上清。细胞沉淀用无血清DMEM/F12培养液稀释,将细胞悬液加于Percoll梯度液上(由下到上依次为70%、60%、30% Percoll各3 mL),低温离心30 mi(n4℃,3 000 r/min)。离心后,在管内可看到1条明显的目的细胞带,取出后,加入适量无血清DMEM/F12培养基充分混匀细胞,4℃,1 000 r/min离心8 min,去上清,反复操作一次以尽可能洗去残存的Percoll分离液。获得较纯化的间质细胞,加入适量含血清的DMEM/F12培养液制成细胞悬液。
1.5 Leeyyddiigg细胞的培养将细胞浓度调至5.0×105个/mL,接种后在37℃、5%C02、95%02和饱和湿度条件下培养。
1.6 Leeyyddiigg细胞活力的鉴定取上述分离纯化的睾丸间质细胞,调整细胞浓度为5.0×105个/mL,吸取10滴Leydig细胞悬液和l滴0.4%台盼蓝溶液混匀,静置3 min。健康细胞排斥台盼蓝而不被染色,丧失细胞膜完整性的死细胞可被台盼蓝染成蓝色,计算细胞活率。计算公式如下:

1.7 33β--HHSSDD染色鉴定Leeyyddiigg细胞由于睾丸组织内仅睾丸间质细胞内含有3β-羟基类固醇脱氢酶(3β-HSD),故睾丸间质细胞可被特异性的染成蓝色。取要鉴定的细胞悬液,调整细胞浓度为5.0× 105个/mL,按2:1比例加入已配制的3β-HSD染液,放入C02培养箱继续孵育5 h,在显微镜下选取多个视野观察计数所有细胞及染成蓝色的细胞,计算Leydig细胞百分率。
2 结果与分析
2.1 Leeyyddiigg细胞存活率的测定结果纯化、分离后的睾丸间质细胞悬液经0.4%台盼蓝溶液染色后在光镜下观察,共计数200个细胞,其中死细胞被染成淡蓝色,活细胞拒染,重复记录4次,计算结果显示,间质细胞存活率为95.0%±1.3%。
2.2 33β--HHSSDD染色结果采用Percoll分离液梯度离心法分离、纯化鸡睾丸间质细胞,经3β-HSD染色鉴定睾丸间质细胞呈蓝色,纯化前睾丸间质细胞纯度为46.6%±2.3%(n=5),纯化后睾丸间质细胞纯度为92.5%±1.7%(n=5)。睾丸细胞经Percoll分离液纯化前后3β-HSD染色结果见图1和图2。
3 讨论
3.1 鸡睾丸间质细胞的分离与纯化睾丸既是产生精子的器官,又是分泌雄性激素的内分泌器官。目前,对睾丸生殖细胞的分离培养以组织块培养法和胰蛋白酶消化法为主。织块培养法操作简便,但对杂细胞的污染不容易控制;胰蛋白酶消化法利用酶对组织间质的作用使细胞团分散成单个细胞,使用此法能获得大量的活细胞,较快地建立细胞系,但胰酶会作用于细胞膜,长时间的胰酶环境会使细胞受到损伤。Ⅱ型胶原酶能渗透到睾丸组织内部,使胶原酶充分消化间质,本试验采用Ⅱ型胶原酶消化效果较好。Percoll是一种经聚乙烯吡咯烷酮处理的硅胶颗粒,无毒、惰性,且与生物膜不发生黏附,利用它分离的细胞能保持完整的生物学活性。以往研究表明,利用Percoll梯度离心法分离大鼠、小鼠睾丸间质细胞可获得较高的纯度[1,12-13]。本试验采用30%、60%及70%的Percoll梯度分离液分离睾丸间质细胞,经离心后,纯化的睾丸间质细胞主要集中在30%与60%Percoll浓度之间,此浓度范围内获得的睾丸间质细胞的纯度较高,形态典型,且体外细胞的特征与前人报道的一致[5]。本试验分离纯化的睾丸间质细胞存活率为95.0%±1.3%,说明分离、纯化操作过程规范,对睾丸间质细胞的损伤较小。
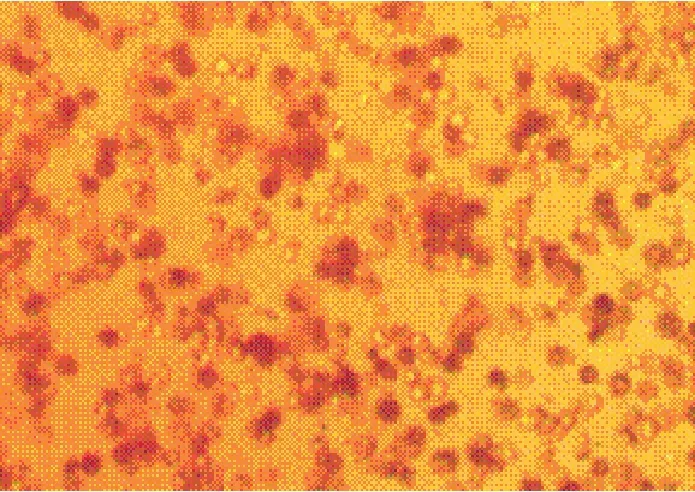
图1 纯化前间质细胞3β-HSD染色(200×)Fig.1 Before purification of interstitial cells stained with 3β-HSD(200 x)
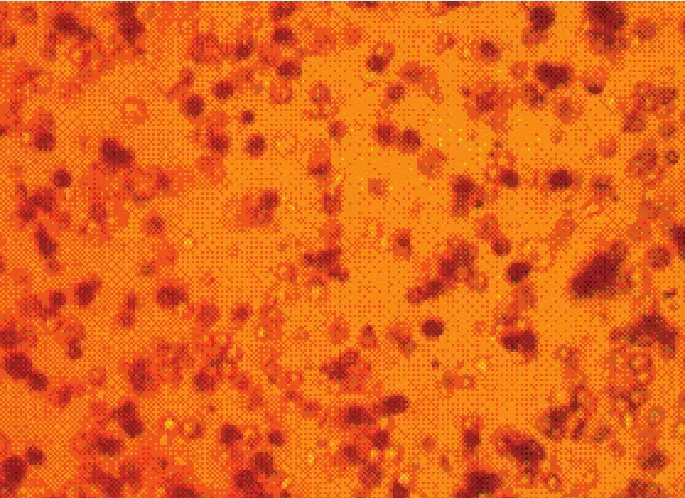
图2 纯化后间质细胞3β-HSD染色(200×)Fig.2 Purified Leydig cells stained with 3β-HSD(200 x)
3.2 鸡睾丸间质细胞的 33β--HHSSDD染色鉴定3β-HSD是甾体类激素合成的关键酶之一,在睾丸间质细胞中表达,仅见于睾丸间质细胞光面内质网内,是公认的睾丸间质细胞的鉴定指标,是睾丸间质细胞的重要标志酶[5-7]。在3β-HSD染色液的作用下,细胞质被染成蓝色的即为睾丸间质细胞。本试验基于这一特征对分离、纯化的鸡睾丸细胞进行染色鉴定,结果表明,所分离纯化的细胞92.5%±1.7%是睾丸间质细胞。本试验成功建立了鸡睾丸间质细胞分离、纯化方法,为研究禽类的生殖试验提供体外细胞模型。
[1]刘建中,郭海彬,邓春华.大鼠睾丸Leydig细胞的培养和鉴定[J].中华男科学杂志,2006,12(1):14-17.
[2]Chen H,Cangello D,Benson S,et al.Age-related increase in mitochondrial superoxide generation in the testosterone-producing cells of Brown Norway rat testes:relationship to reduced steroidogenic function[J]. Exp Gerontol,2001,36(8):1361-1373.
[3]刘玉志,李青旺,江中良,等.小鼠睾丸间质细胞的分离纯化与体外培养的研究[J].黑龙江畜牧兽医,2010(7):5-7.
[4]王晓云,张健,李健,等.睾丸间质细胞分泌功能调节因素的研究进展[J].解剖科学进展,2002,8(3):274-278.
[5]张柳平,邵根宝,潘耀谦.成年小鼠睾丸间质细胞的分离,鉴定及功能检测[J].动物医学进展,2013,34(9):40-43.
[6]赵为民,杨建英,代涛,等.鼠睾丸间质细胞体外原代培养方法的建立[J].中国组织工程研究与临床康复,2011,15(46):8665-8667.
[7]况海斌,王新长,方廉.大鼠睾丸间质细胞分离及其鉴定[J].江西医学院学报,2002,42(5):7-9.
[8]Chen H,HardyMP,Zirk in BR.Age-elated decreases in Leyd ig cell testos terone production are not restored by exposure to LH in vitro[J].Endocrinology,2002,143(5):1637-1642.
[9]黄雅琼,杨素芳,农微,等.猪睾丸间质细胞的分离及培养[J].畜牧与兽医,2008,40(7):21-25.
[10]卿利娟,魏泓,李婧,等.仔猪睾丸间质细培养方法的比较[J].中国兽医杂志,2013,49(11):29-35.
[11]杨建英,张勇法,乔晓岚.睾丸间质细胞的研究进展[J].医学综述,2009,15(14):2093-2094.
[12]冯颖,杨建成,石娇,等.牛磺酸对大鼠睾丸间质细胞分泌睾酮的影响及作用机理初探[J].畜牧兽医学报,2006,37(12):1293-1296.
[13]Sun J,Zhong L,Zhu Y,et al.Research on the isolation of mouse Leydig cells using differential digestion with a low concentration of collagenase[J].J Reprod Dev,2011, 57(3):433-436.
The Isolation and Examination of Rooster Testis Leydig Cell
Yang Shuhua,Yu Lihui,Zhang Yi,Long Miao,Li Lin,Gao Feng, Jiang Liying,Han Yang,Wang Xue,He Jianbin*
(Department of Animal Husbandry and Veterinary Medicine Shenyang Agricultural University,Liaoning Shenyang 110866)
To find a high-efficient way to digest and purify rooster leydig cells.Methods:A multistep procedure including vascuIar perfusion,dissociation of type II collagenase and PercoII gradient centrifugation was employed.ResuIts:The purfied Leydig cell fraction after PercoII density-gradient centrifugation contained 92.5%±1.7%well-preserved 3β-hydroxysteroid dehydrogenase(3β-HSD),The better cultural condition was 37℃,5%C02.ConcIusion:It suggests that the method is reIiabIe and has somewhat applicant prospect.
Cock;Leydig cell;3β-HSD;Gradient centrifugation
Q813
1672-9692(2015)11-0006-03
2015-09-29
杨淑华(1973-),女,讲师,博士,从事畜禽营养代谢病与中毒病研究。
何剑斌(1969-),男,教授,博士,从事动物产科疾病的诊断与治疗。
沈阳农业大学校青年基金(20121007)

