抗菌脂肽分离纯化的研究
冯大兴
(辽宁省畜产品安全监察所,辽宁 沈阳 110003)
抗菌脂肽分离纯化的研究
冯大兴
(辽宁省畜产品安全监察所,辽宁 沈阳 110003)
为分离、鉴定枯草芽孢杆菌S2株产生的抗菌脂肽类化合物主要成分种类和特性。本试验采用S2菌株的发酵液,经大孔吸附树脂XD吸附、洗脱,将产物与Surfactin(表面活性剂)标准品同时进行薄层色谱(TLC)分析,结果表明,S2菌株代谢产物主要为环状脂肽类化合物Surfactin。运用液质联用(LC-MS)分析技术对S2菌株产生的脂肽化合物Surfactin进行了分离,对其在代谢产物中的含量及结构进行了分析,并对其分子量进行了推测,结果显示,枯草芽孢杆菌S2菌株在发酵前期合成的抗菌脂肽类化合物Surfactin(表面活性剂)含量达77.39%,分子量主要分布在1 036.693 3~994.644 9之间,通过研究进一步确定了S2菌株产生的代谢产物是Surfactin A、Surfactin B和Surfactin C的同系混合物。
枯草芽孢杆菌;抗菌脂肽;分离;分子量
细菌所产生的脂肽种类繁多而且结构复杂,体现出各种生理特性[1],即使是同一基本结构的脂肽也同样存在多种结构类似物,因为这些脂肽的结构形态相似,性质非常相近,因此,从细菌发酵液中分离纯化取得单分子化合物是非常困难的。
本试验主要对提取所得抗菌脂肽进行分离提纯。利用大孔树脂的吸附性,对抗菌脂肽粗提取物开展吸附纯化研究,确定纯化流程,并为最终建立抗菌脂肽的规模生产工艺提供研究基础。
1 材料与方法
1.1 材料
1.1.1 菌株 试验菌株:枯草芽孢杆菌S2。
1.1.2 培养基 LB培养基(菌种培养用)、Landy培养基(发酵用)、营养琼脂培养基、营养肉汤培养基、LB固体培养基。
1.2 方法
1.2.1 种子菌液培养 将保存的枯草芽孢杆菌S2菌株转接至LB平板上,32℃培养20 h;用接种环取活化的单菌落,接种于装有50 mL LB培养液的250 mL三角瓶中,置32℃、180 r/min摇床培养20 h,4℃冰箱保存、备用。
1.2.2 发酵液的制备 将枯草芽孢杆菌S2菌株接种到装有50 mL Landy培养液的250 mL三角瓶中,接种量为5%,置32℃、180 r/min摇床培养。
1.2.3 抗菌脂肽粗提 取抑菌效果最佳菌株的最佳发酵阶段的发酵液200 mL,10 000 r/min离心,弃去菌体,加入3%的大孔吸附树脂XAD-16,室温置于摇床震荡,120 r/min,24 h。吸附后的树脂用蒸馏水清洗至树脂表面无抗菌脂肽发酵液残留,然后置于200 mL具塞三角瓶中,加入60 mL无水乙醇,室温下,置于摇床(120 r/min)振荡洗脱24 h,然后减压干燥,即为抗菌脂肽粗提物。
1.2.4 TLC(薄层色谱)抗菌脂肽[2]解析
1.2.4.1 解析TLC 层析支持物使用 Silica Gel GF254 20 cm×5 cm规格的硅胶板,用于层析的试剂配比为甲醇25(V)、三氯甲烷65(V)、水4(V)。第一步分别用少量的甲醇溶液溶解surfactin标准样品和脂肽粗提物,然后制作若干块硅胶板,在每块板上同时点上样品与标品,进行层析前要点样,保存在层析试剂中,持续4 h,待完全挥发,一部分用0.4%的茚三酮染色、观察,用密闭容器存放另一部分,这种容器应耐高温,容器内放置盛有浓盐酸的小杯,浓盐酸大约2 mL,然后水解和冷却原位酸,最后将盐酸去除干净,方法是将密闭容器放进烘箱中,温度控制在110℃,持续熏蒸,时间为3 h时,然后茚三酮染色,再一次放进110℃烘箱内熏蒸1 h后进行观察。
1.2.4.2 抗菌脂肽的收集 取同等条件下经薄层层析后的分析板,在与其相对应显色部位刮取硅胶并将硅胶粉末收集,用甲醇进行浸泡洗脱、浓缩后,即为抗菌脂肽纯品,供HPLC和LC-MS分析。
1.2.5 HPLC分离纯化抗菌脂肽
1.2.5.1 色谱条件 RP-C18色谱柱(4.6 mm×250 mm,5 μL,pH1-14)。
流动相:A:水(含0.1%三氟乙酸(Trifluoroacetic acid,TFA));B:乙腈(Acetonitrile,ACN);0~50 min,
A:40%~95%,B:60%~5%
流速:1 mL/min;柱温:30℃;进样体积:20 μL。
检测波长:210 nm。
1.2.5.2 样品处理 上述脂肽粗提物,用流动相溶解。
1.2.5.3 标准品 脂肽类物质surfactin,用流动相溶解。
首先把标品surfactin进行HPLC层析,待完成后,将色谱柱平衡结束,再加上样品进行等梯度洗脱,将脂肽化合物样品进行分离,重复3次收集洗脱液,根据标准品与样品的出峰时间,初步判断脂肽类型。
1.2.6 LC-MS(液质联用)分析脂肽
1.2.6.1 HPLC(高效液相色谱)分析抗菌脂肽 ①色谱条件: RP-C18柱(4.6 mm×250 mm,5μm,PH1-14)。②流动相:A:水(含0.1%三氟乙酸(Trifluoroacetic acid, TFA));B:乙腈(Acetonitrile,ACN)。③流速:1 mL/min,梯度洗脱条件如下图。④检测波长:210 nm。
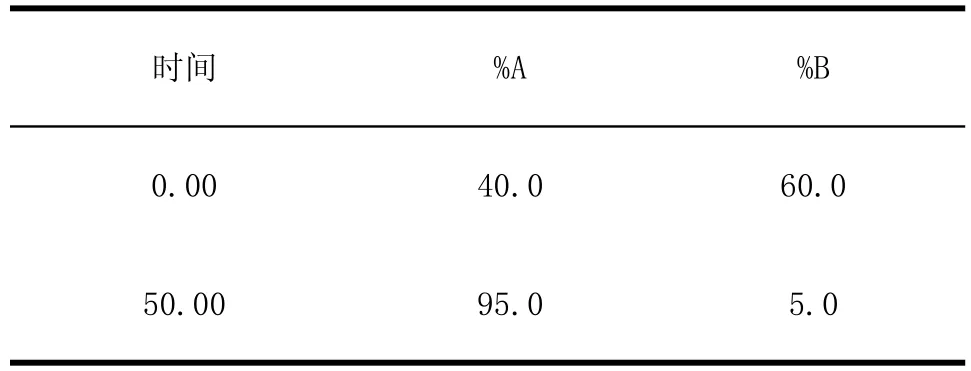
表1 梯度洗脱条件Table1 Gradient elution condition
将脂肽粗提物采用进行HPLC(DI0NEX U3000)分离纯化,surfactin标准样品也在相同条件下进行层析。
1.2.6.2 MS(质谱)分析脂肽 采用Agilent 6540 Q-T0F LC/MS液质联用分析。质谱条件见表2。
将HPLC收集的1~9个峰直接用200 μL的进样针进行自动进样。采用ESI-MS测定脂肽类化合物相对分子质量,然后对一级质谱的主要离子峰实施ESI-MS分析。
2 结果与分析

表2 质谱条件参数Table2 Mass spectrometry parameters
2.1 S2菌株抗菌物质TTLLCC层析结果通过对S2菌株产生的抗菌脂肽化合物与标品Surfactin进行TLC分析、观察(图1),结果显示,硅胶板经过层析后,直接喷洒茚三酮染色剂后加热,样品不显色,如图1(A板)所示,薄层硅胶板A中样品1、样品2以及标品surfactin在相应部位均没有显示,说明标品和样品中它们的分子结构均呈环状结构,没有游离氨基酸存在;采用浓HCl进行原位水解后,冷却、吹净盐酸后发现,在相应部位能见到标品及样品的痕迹,见图1(B-1板);再用茚三酮染色,再一次放进110℃烘箱内熏蒸1 h后,在对应位置处样品和标准品均能显色,说明标准品和样品中环状分子结构均已经打开,有游离氨基酸存在,如图1(B-2板)。根据图1显示,薄层板上样品与标品两个显色斑点所处的位置进行比较,表明它们迁移的速度一致,即两者所带的电荷相似。初步判断该样品与标品属于同一类脂肽化合物,即surfactin或surfactin同系物。

图1 GD菌株脂肽粗提物TLC层析结果Fig.1 The TLC chromatography results of GD strains lipopeptide crude extracts
2.2 S2菌株脂肽HHPPLLCC分离纯化结果通过对S2菌株脂肽化合物粗提物与标准品surfactin分别经HPLC分离及比较后观察,见图2,发现样品粗提物所形成的色谱峰都能与标品surfactin产生的7个色谱峰保留时间重叠合,表示它们的分子量大小基本一致,且下标红色圆圈处色谱峰得到较好的分离。说明菌株S2产生的脂肽属于surfactin类即是surfactin同系物。
2.3 菌株 S2脂肽粗提物几个主峰的含量比较根据从S2菌株粗提物样品在HPLC上的出峰保留时间来看(表1和图3),S2菌株粗提物主要几个色谱峰在柱上保留时间在12~19 min之间。由此可见,S2脂肽粗提物是由surfactin同系物中多个组分构成。
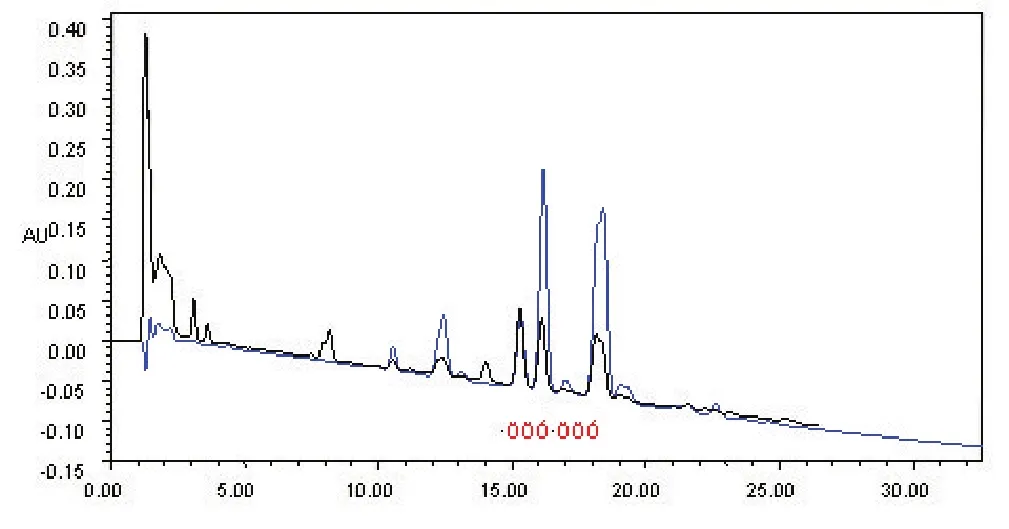
图2 菌株GD脂肽粗提物与标品HPLC保留时间对比Fig.2 The comparison of retention time between GD strains lipopeptide crude extracts and HPLC standard product
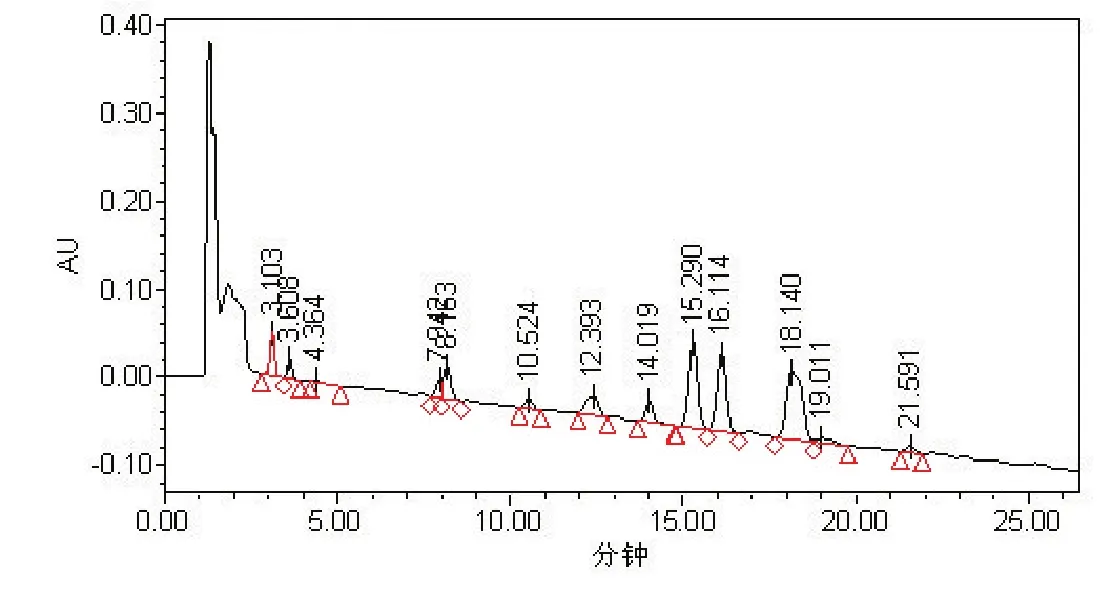
图3 GD粗提物样品HPLC出峰保留时间Fig.3 The HPLC peak retention time of GD strains lipopeptide crude extracts
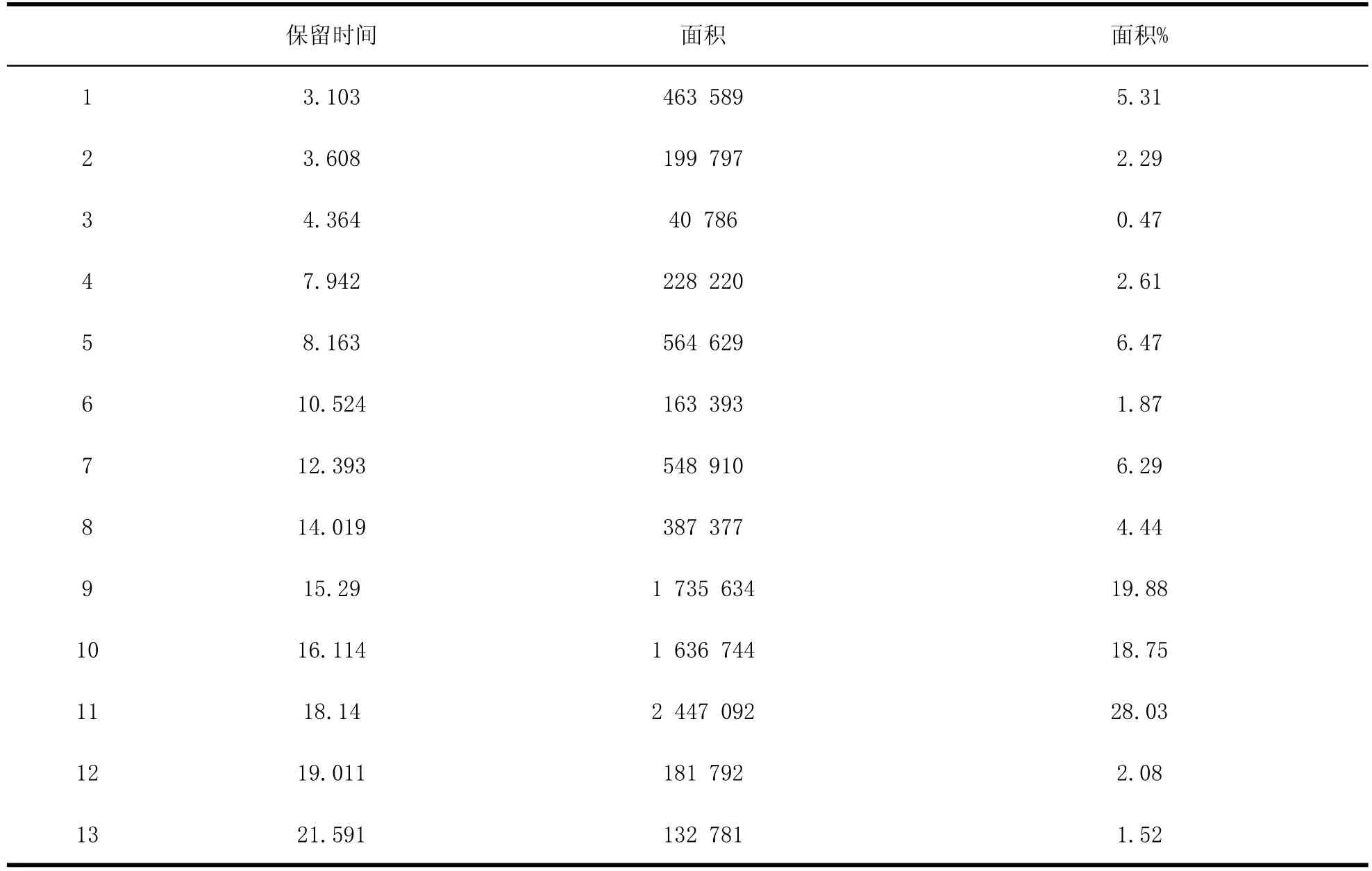
表3 S2粗提物样品HPLC出峰保留时间及面积Table3 The HPLC peak retention time and area of crude extracts
根据图3、表3中峰面积统计显示,S2脂肽粗提物在12.393~19.011 min保留时间内出峰面积占整个出峰面积的77.39%。
2.4 菌株 S2脂肽类化合物的相对分子质量分析通过采用Agilent 6540 Q-T0F LC-MS液质联用分析技术对菌株S2脂肽粗提物在HPLC柱上洗脱中出现的峰(图4-0),按照时间先后顺序将出现的9个洗脱峰分别做质谱分析(图4-1~4-9和表2),结果表明,菌株S2发酵30 h时产生的脂肽化合物主要是由surfactin同系物组成,其分子量(m/z)分布在994.644 9、1 008.660 5、1 022.677 3和1 036.693 3附近。说明S2菌株产生的抗菌脂肽化合物主要包括surfactinA、B和C,同时还含有少量其他类型的脂肽化合物。
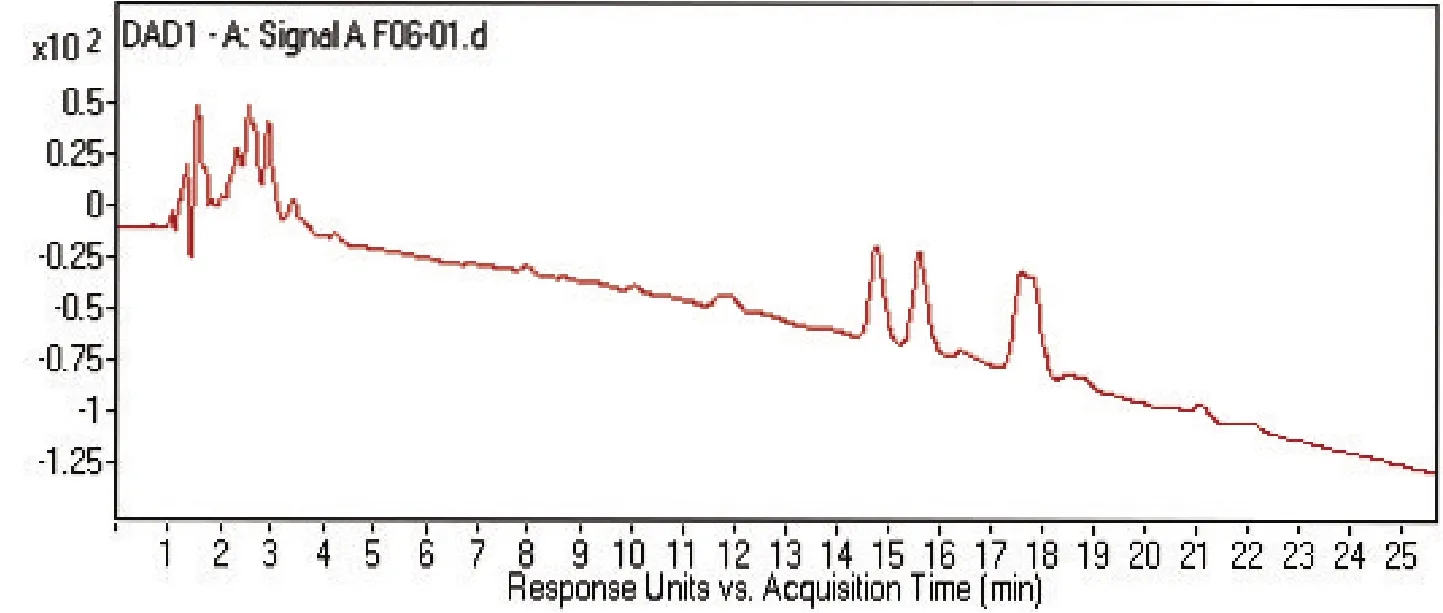
图4-0
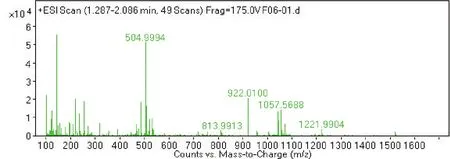
图4-1
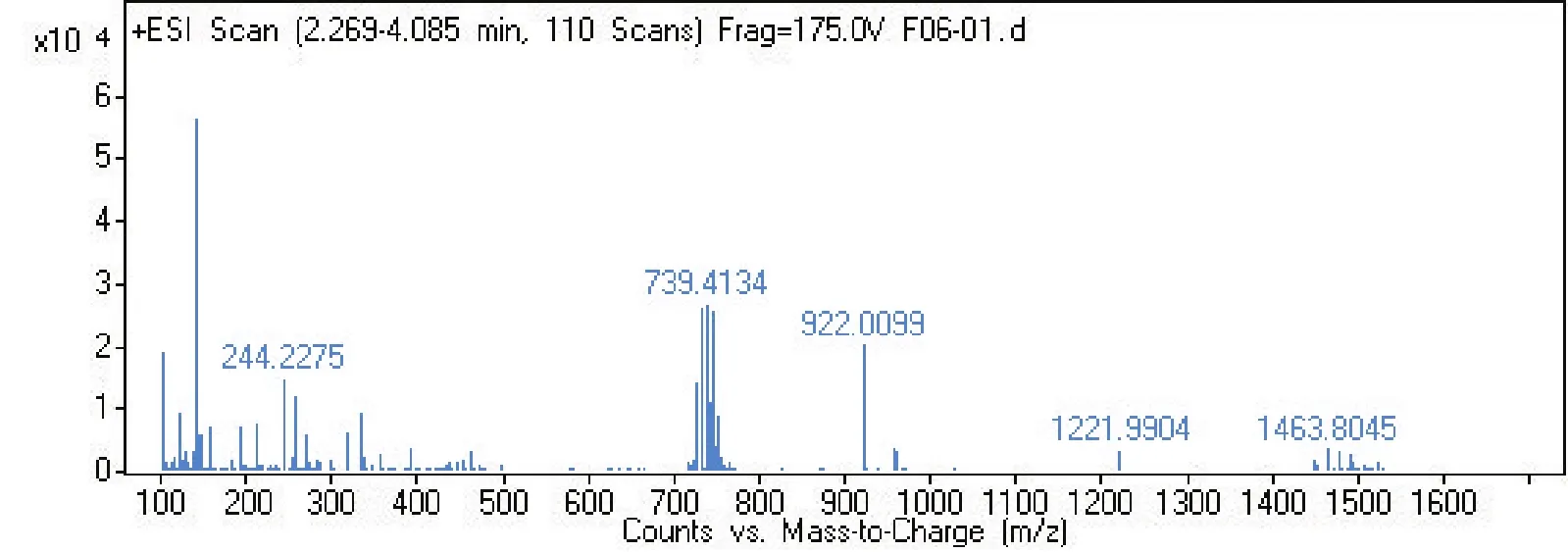
图4-2
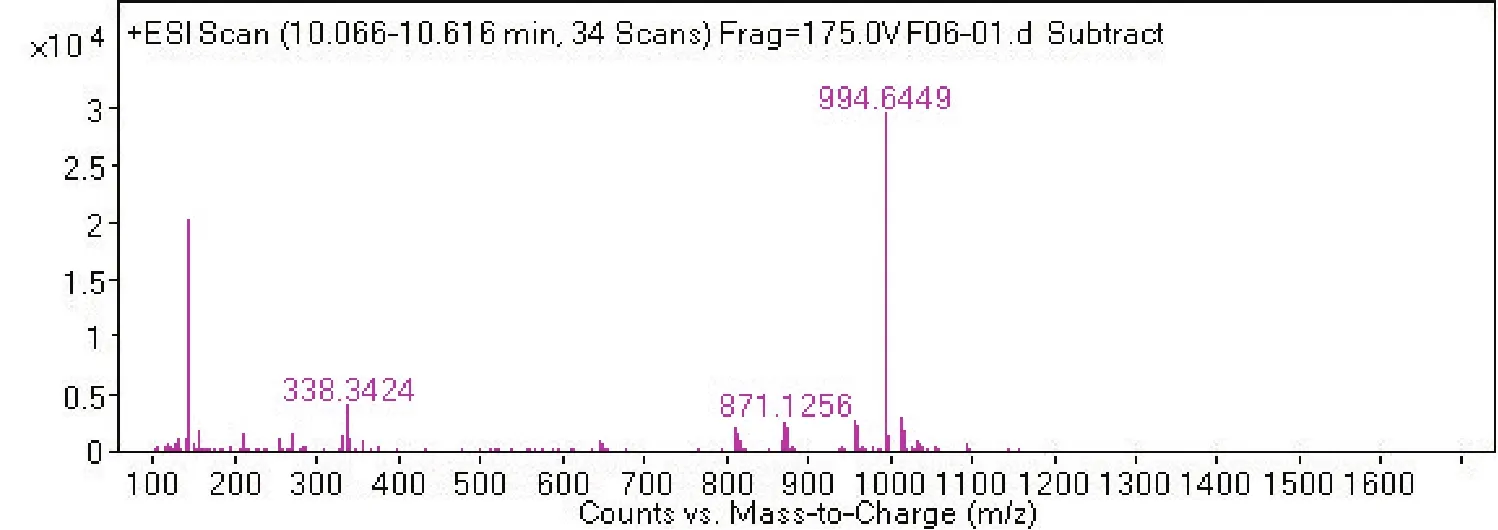
图4-3
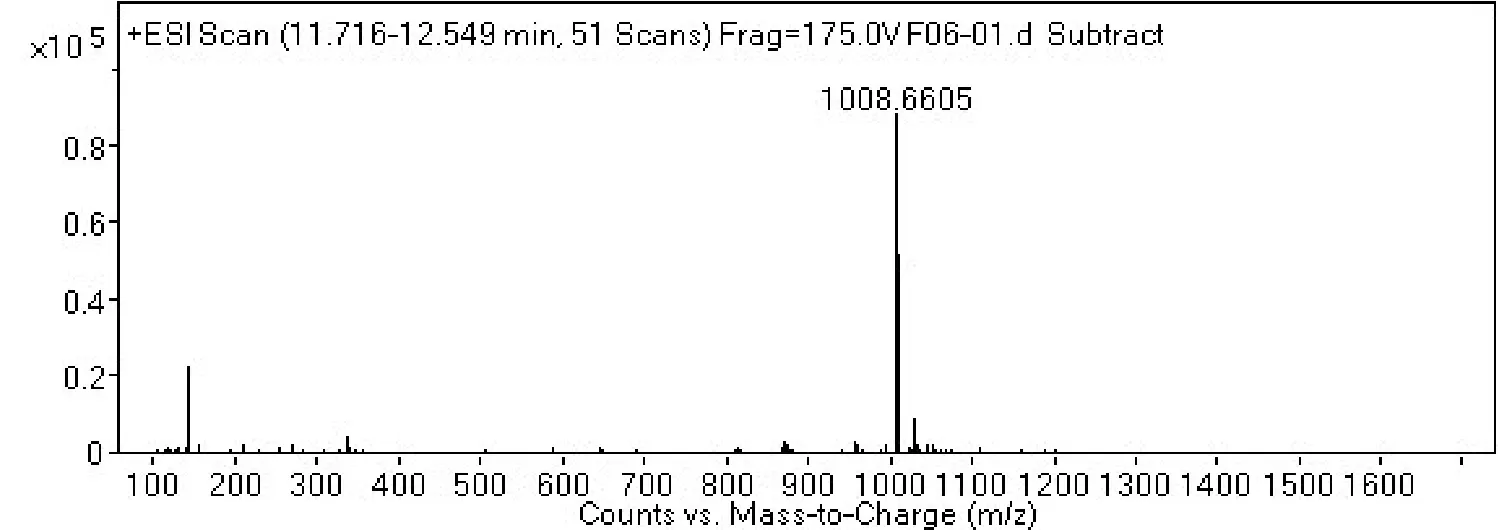
图4-4
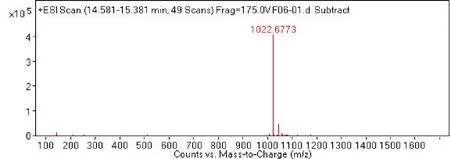
图4-5
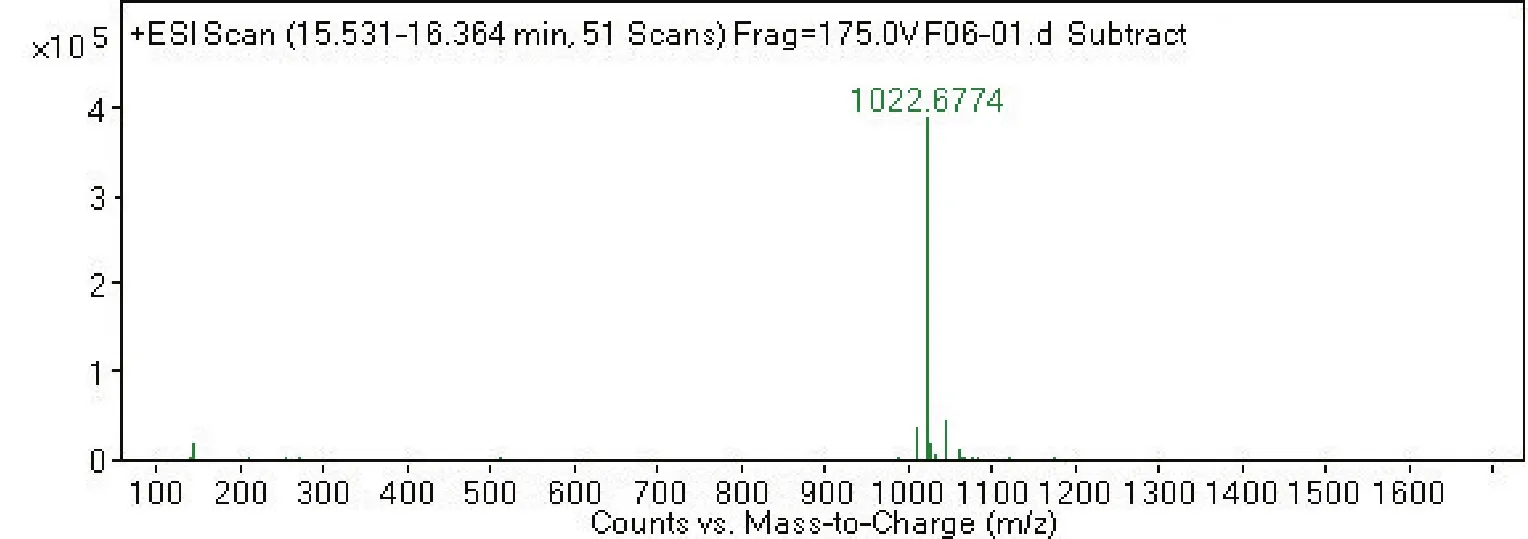
图4-6
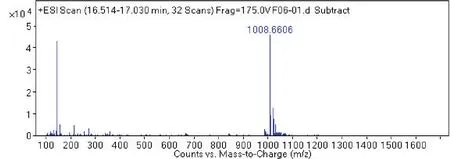
图4-7
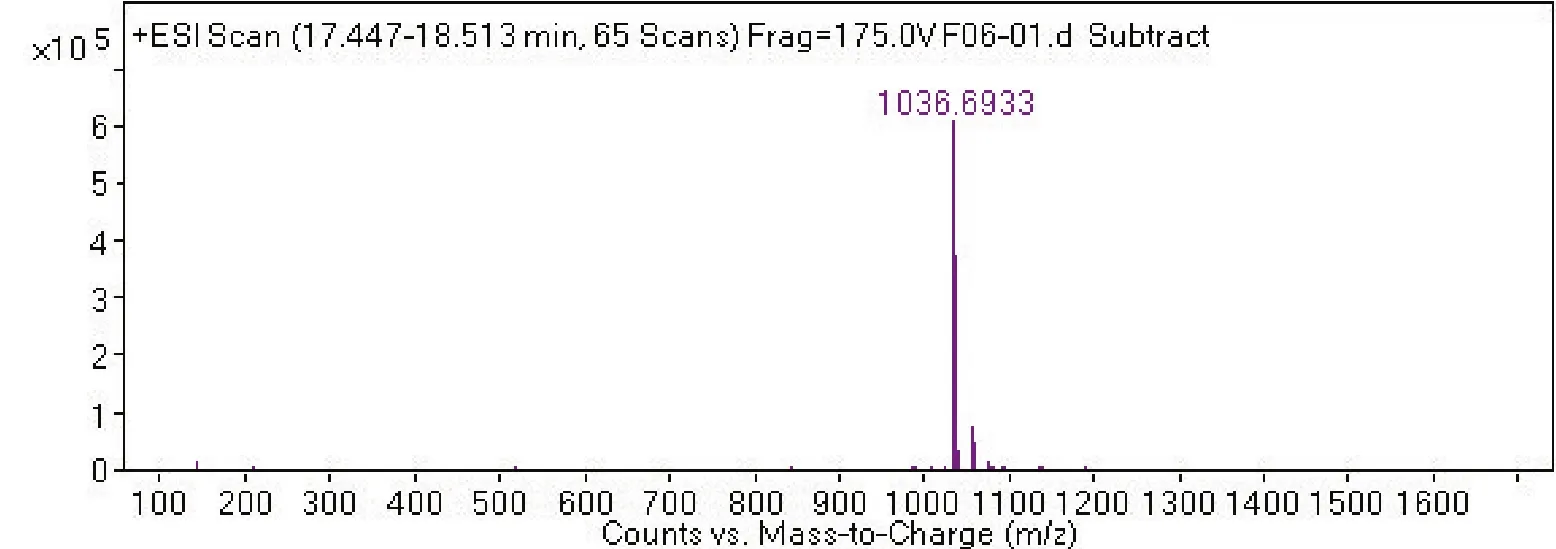
图4-8
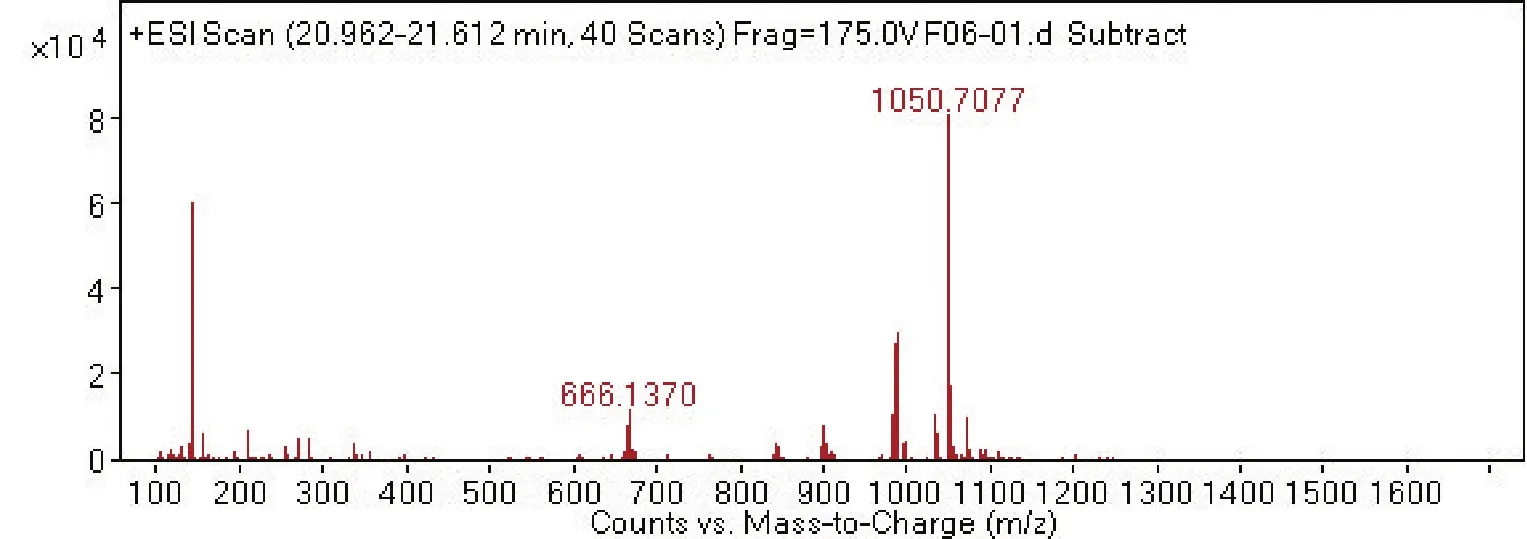
图4 菌株GD脂肽化合物的LC-MS质谱图Fig.4 The LC-MS mass spectrogram of GD strains lipopeptide
通过进一步比较、分析,4号、5号峰及7号、6号分子量分别是1 008.660 5、1 008.660 6与1 022.677 3、1 022.677 4,它们相差14.006 8,表明它们之间相差1个碳氢残基(-CH2-);4号和7号峰的分子量分别为1 008.660 5和1 008.660 6,5号峰与6号峰的分子量分别为1 022.677 3与1 022.677 4,虽然它们分子量一样,但它们的出峰时间有先后之分,不属于真正意义上的同一种化合物。说明4号、5号峰及7号、6号是同系物;4号和7号峰以及5号峰和6号峰它们分别属于各自的同分异构体或构象异构体。
3 讨论
抗菌脂肽分子是由亲水性肽链(7至10个氨基酸残基组成的肽链)和亲油性脂肪酸链(β-羟基脂肪酸链或则β-胺基脂肪酸链)两部分组成的,其中脂肪酸链上-0H或-NH2与肽链上氨基酸-C00H结合构成内酯键或酰胺键,导致肽链闭合形成而环状脂肽[3]。通过对S2菌株产生出的抗菌脂肽化合物和标品Surfactin进行TLC分析、观察,以及通过对S2菌株脂肽化合物粗提物和标准品surfactin分别经过HPLC分离及比较等试验,初步判断菌株S2产生的脂肽属于surfactin类,也就是surfactin同系物。由于不存在暴露或游离的氨基,属环状结构,与国内外诸多报道一致[4]。
S2脂肽粗提物是由surfactin同系物中的多个组分组成。运用液质联用(LC-MS)分析的技术对S2菌株产生出的脂肽化合物surfactin进行了分离,并对其在代谢产物中的含量和结构进行了分析,对其分子量进行推测,结果表明,枯草芽孢杆菌S2菌株在其发酵前期合成的抗菌脂肽类化合物surfactin(表面活性剂)的含量达77.39%,分子量主要分布于1 036.693 3~994.644 9之间。
微生物产生的抗菌脂肽种类较多,结构比较特殊、复杂,体现出各种生理特性[5]。通过菌株S2脂肽类化合物相对分子质量的分析,采用了Agilent 6540 Q-T0F LC-MS液质联用分析的技术,对菌株S2脂肽的粗提物在HPLC柱上洗脱中出现的峰值,按照时间的先后顺序将出现的9个洗脱峰值分别做质谱分析,进一步确定出S2菌株产生的代谢产物就是surfactin A和surfactin B、surfactin C的同系混合物。
[1]Peypoux F,Bonmatin J M,Wallach J.Recent trends int he bio-chemistry of surfactin [J].Appl Microbiol Biotech,1999,51(5): 553-563.
[2]PeypouxF.,BonmatinJ.,WallachJ.Recent trends in the biochemistry of surfactin[J]. Appl Microbiol Biotechnol, 1999, 51(5):553-563.
[3]吕应年,杨世忠,牟伯中.脂肽类生物表面活性剂的研究进展[J].生物技术通报,2004(6):11-16.
[4]杨世忠,牟伯中,吕应年.环脂肽氨基酸顺序的质谱测定[J].化学学报,2004(21):2200-2204.
[5]别小妹,吕凤霞,陆兆新.Bacillus subtilis fmbJ抗菌脂肽类抗菌物质的分离和纯化[J].生物工程学报,2006,22(4):328-333.
2015年《现代畜牧兽医》杂志征订启事
《现代畜牧兽医》杂志创刊于1972年,月刊,全年12期。邮发代号8-75,国内刊号CN21-1515/S,国际刊号ISSN1672-9692。杂志内容丰富、品质卓越、装帧精美、品位时尚,深受行业人喜爱。欢迎广大读者订阅,如错过邮局订阅时间,可直接与本刊联系。
电话:024-23448255
地址:沈阳市和平区太原北街二号(110001)
Research on isolation and purification of antimicrobial peptides
Feng Daxing
(Animal product safety monitoring Institute of Liaoning Province,Liaoning Shenyang 110003)
For isolation and identification of S2 strains of bacillus subtilis producing fat antibacterial peptide compound main component types and features.Test using S2 strains fermented liquid,by macroporous adsorption resin adsorption and elution,XD product with Surfactin(surfactant)standard and thin layer chromatography(TLC)analysis.The results show that the S2 main strainmetabolitesincircularSurfactinfatpeptidecompounds;Usingliquidmasscombination (LC-MS)analysis technology of S2 strains produce fat Surfactin peptide compounds of separation and its metabolites in the content and structure are analyzed,and its molecular weight is speculated that,according to the results of S2 strains of bacillus subtilis in the early stage of the fermentationSurfactinsyntheticfatantibacterialpeptidecompounds(surfactant)contentwas 77.39%,and the main distribution of molecular weight between 1 036.693 3 994.644 9,through further research to determine the metabolites produced by the strain S2 is Surfactin,Surfactin B and Surfactin C homologous mixture.
Bacillus subtilis;Antimicrobial peptides;Separation;Molecular weight
S859.79
1672-9692(2015)11-0009-08
2015-10-10
冯大兴(1985-),男,硕士,畜牧师,研究方向为兽药、饲料、畜产品质量安全。

