乳腺导管原位癌和早期微浸润癌灶中HER-2/neu癌基因扩增及其临床意义
吴晓翠,陈壬寅,张 岚,孟 辉
(1.河南省人民医院放疗科,河南 郑州 450003;2.郑州大学第一附属医院病理科,河南 郑州 450052)
乳腺导管原位癌和早期微浸润癌灶中HER-2/neu癌基因扩增及其临床意义
吴晓翠1,陈壬寅2,张岚2,孟辉2
(1.河南省人民医院放疗科,河南 郑州 450003;2.郑州大学第一附属医院病理科,河南 郑州 450052)
[摘要]目的探讨HER-2/neu癌基因在乳腺导管原位癌及早期微浸润灶中的扩增情况及临床意义。方法采用FISH法检测了存档的168例乳腺癌石蜡包埋组织标本HER-2/neu基因的扩增情况。结果单纯导管原位癌9例,导管原位癌伴早期微浸润癌83例,浸润性导管癌29例,小叶原位癌6例,浸润性小叶癌41例。单纯导管原位癌病例中HER-2/neu基因扩增率66.7%(6/9);导管原位癌伴早期微浸润病例中HER-2/neu基因扩增率61.4%(51/83);浸润性导管癌中HER-2/neu基因扩增率34.5%(10/29);小叶原位癌HER-2/neu基因扩增率0.0%(0/6);浸润性小叶癌中HER-2/neu基因扩增率12.2%(5/41)。结论HER-2/neu基因在导管原位癌和早期微浸润病灶中扩增状态无明显差异,导管旁微浸润病灶中HER-2/neu基因扩增情况基本与导管内一致;导管癌HER-2/neu基因扩增率高于小叶癌。
[关键词]乳腺癌;HER-2/neu;导管原位癌;微浸润
在美国,乳腺导管原位癌Ⅲ级占新诊断乳腺癌的12%~14%,50%未经治疗的原位癌在24 a内均发展成为同侧浸润性乳腺癌。但目前其浸润发生的生物机制人们还未完全理解。HER-2/neu基因通常在正常或良性乳腺病变中不呈过度表达,而在原位癌病变中呈过度表达。HER-2/neu基因的表达在侵袭性癌中比原位癌中大大降低[1-2]。但很少研究比较HER-2/neu基因在乳腺导管原位癌与乳腺导管原位癌合并浸润癌组织中的表达[1,3-5]。原位癌组织中过度表达的HER-2/neu基因是否参与或决定了肿瘤恶性侵袭性及原位癌向浸润癌的发展尚未得到证实。本研究中,我们对照研究了HER-2/neu基因在乳腺导管原位癌和早期导管微浸润灶癌中扩增的频率。其评价可能帮助识别存在进一步恶变潜能的原位癌,并为赫赛汀预防干预治疗提供潜在的分子靶标。
1材料与方法
1.1标本来源及入选标准选择2009年9月至2011年12月我院乳腺外科手术切除的乳腺癌组织标本168例,患者年龄(46.0±2.7)岁;导管原位癌9例,导管内癌伴早期微浸润83例,浸润性导管癌29例,小叶原位癌6例,浸润性小叶癌41例。然后对每个原位癌病灶进行分级。
1.2FISH法检测HER-2/neu基因扩增FISH法参照原位杂交试剂盒说明书进行,略加改进。HER-2/neu荧光原位杂交探针由北京金菩嘉医疗科技有限公司提供。使用前,DNA探头先于病例组与对照组的HE染色标本中找到有乳腺导管原位癌区域及浸润的癌灶部位。在找到的癌灶部位对标志基因进行检测。具体步骤:切片预处理4~5 μm石蜡切片65 ℃烤片3 min,常规脱蜡至水,滴加已复温的酶预处理液,室温孵育5~10 min,蒸馏水洗3次,每次2 min,中性甲醛室温固定10 min。梯度乙醇脱水(75%,85%,100%乙醇各2分钟脱水),自然干燥或电吹风吹30S。变性与杂交:每片滴加10 μL HER-2/neu探针混合物,立即用专用杂交盖片覆盖81 ℃ 变性6~10 min,42 ℃,杂交过夜(超过10 h);洗涤:浸入0.4×SSC/0.3% NP-40洗涤液1.5 min,后浸入2×SSC/0.1% NP-40洗涤液0.5 min。70%乙醇洗涤5 min,自然干燥。10~15 μL DAPI复染。
1.3荧光显微镜判读标准以莱卡DMBRX荧光显微镜,显微镜由DAPI,绿色光谱,橘色光谱3通道滤过光源观察3种不同荧光信号。以FISH3.0成像系统进行图像获取及处理。红色信号代表HER-2/neu基因,绿色信号代表17号染色体着丝粒探针。以红绿信号比值来判断HER-2/neu基因扩增状况。比值<2.0为无扩增,比值≥2.0为基因扩增,红信号显示密集以致无法辨认为簇状扩增[5]。首先在HE染色切片上确认浸润性癌区域,然后在10倍物镜下,于FISH切片上相同的组织细胞结构,要求至少找到2个浸润性癌区域。然后在40倍物镜下扫描整张切片,观察是否存在HER-2/neu表达的异质性以及切片的质量,再于100倍物镜下通过特异单通道滤光片观察癌细胞核的FISH结果。每个靶视野计数60个肿瘤细胞核信号。
1.4微浸润灶寻找方法乳腺浸润癌是WHO(2003)乳腺肿瘤组织中分类提出的新名称,是指在大量导管内癌背景下,乳腺(非特化的小叶)间质内出现一个或几个镜下明确分离的微小浸润灶。浸润癌多为浸润性导管癌。单个浸润性病灶最大直径不超过2 mm,或者有2~3个浸润灶,每个最大直径不超过1 mm。首先在HE染色切片上确认导管内癌及微浸润灶成份,结合HER-2/neu指标免疫组化结果,及结合SMA、CK5/6、Calponin、P63、S-100等免疫组化指标确认导管完整性及帮助辨认导管旁微浸润成分,并注意寻找脂肪等间叶成分中浸润的少量癌细胞。再于100倍物镜下通过特异单通道滤光片观察肿瘤细胞核的FISH结果。每个靶视野计数60个肿瘤细胞核信号。
1.5基因扩增率计算基因扩增率按照以下公式计算:HER-2/neu阳性病例数目/HER-2/neu阴性病例数目。
1.6统计学处理采用SPSS 17.0进行数据分析,全部分组标志定量数据以±s表示,比较采用单因素方差分析和t检验;定性数据以百分数表示,比较采用χ2检验,检验水准α=0.05。
2结果
2.1大体观察结果168例乳腺癌标本中,导管内癌9例,肿块直径为1.2~9.0 cm,均未见淋巴结转移;导管内癌伴微浸润83例,肿块直径0.6~16.0 cm,未见淋巴结转移。
2.2光学显微镜下观察情况导管原位癌表现为:乳头状、粉刺癌、实性、筛性、微乳头状等。导管显著扩大,细胞有明显多形性和异型性,排列紊乱极向消失。导管原位癌级别依据2012年版WHO乳腺肿瘤组织分类。低级别:核只有轻度多形性和异型性,无坏死。中级别:核有轻度多形性,和异型性伴或不伴坏死。高级别:核有明显细胞学异型性及高分裂活性及坏死。经典型小叶癌组织学特点为:膨大的腺管内充满均匀一致的瘤细胞;细胞通常较小,形态温和,圆或多边形,核深染,无明显核仁,可有核沟;细胞浆较少,细胞轮廓不清,核分裂象、坏死及钙化少见。微小浸润灶为浸润性导管癌,伴有导管周围炎细胞和硬化性间质。腺管基膜和肌上皮可不完整。浸润成分缺乏肌上皮。
2.3HER-2/neu基因扩增结果单纯导管原位癌病例中,3例为扩增,扩增病例均为高级别导管原位癌,6例为无扩增;无扩增病例中2例为低级别导管原位癌,1例为乳头状癌(表1)。83例导管内癌伴早期微浸润病例中,33例为簇状扩增(图1),其中14例为17号染色体多倍体,余为整倍体;18例为点状扩增(图2),其中1例为17号染色体单倍体,6例为17号染色体多倍体(图3),余为整倍体。32例未扩增病例中,2例为17号染色体多倍体,余为整倍体。所有扩增病例中,40例为高级别导管原位癌,且微浸润癌灶绝大多数(49/51,96.1%)与导管原位癌同时扩增,微浸润癌灶未扩增的2例(2/51,3.9%)表现为导管内癌成分小部分为HER-2/neu基因扩增,大部分为HER-2/neu基因未扩增。除这2例导管原位癌为部分扩增的病例表示导管原位癌扩增状态外,其余均表示导管原位及微浸润癌部分的共同的扩增状态。
在扩增病例中,导管原位癌的HER-2/neu基因的平均扩增率与导管内癌伴早期微浸润病例差异无统计学意义(P>0.05);导管原位癌HER-2/neu基因的平均扩增率高于小叶原位癌,浸润性导管癌HER-2/neu基因的平均扩增率高于浸润性小叶癌(P<0.05)。
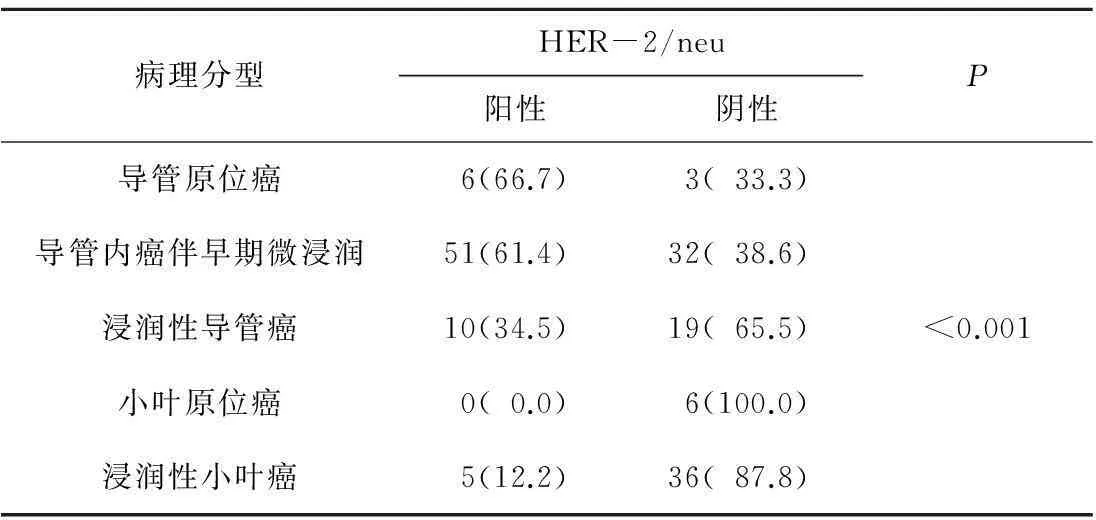
表1 乳腺导管内癌和早期浸润癌HER-2/neu基因扩增比较 n(%)
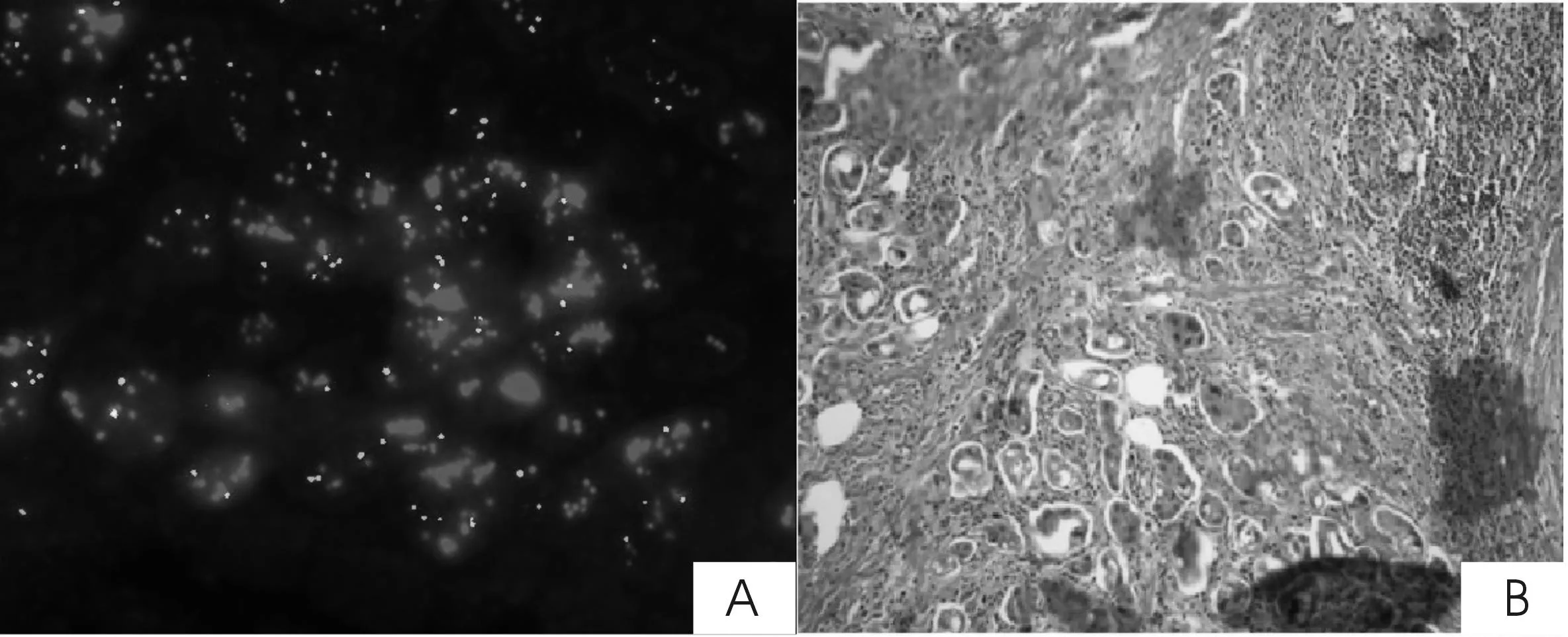
图1 乳腺导管内癌伴早期微浸润癌灶HER-2/neu基因扩增情况
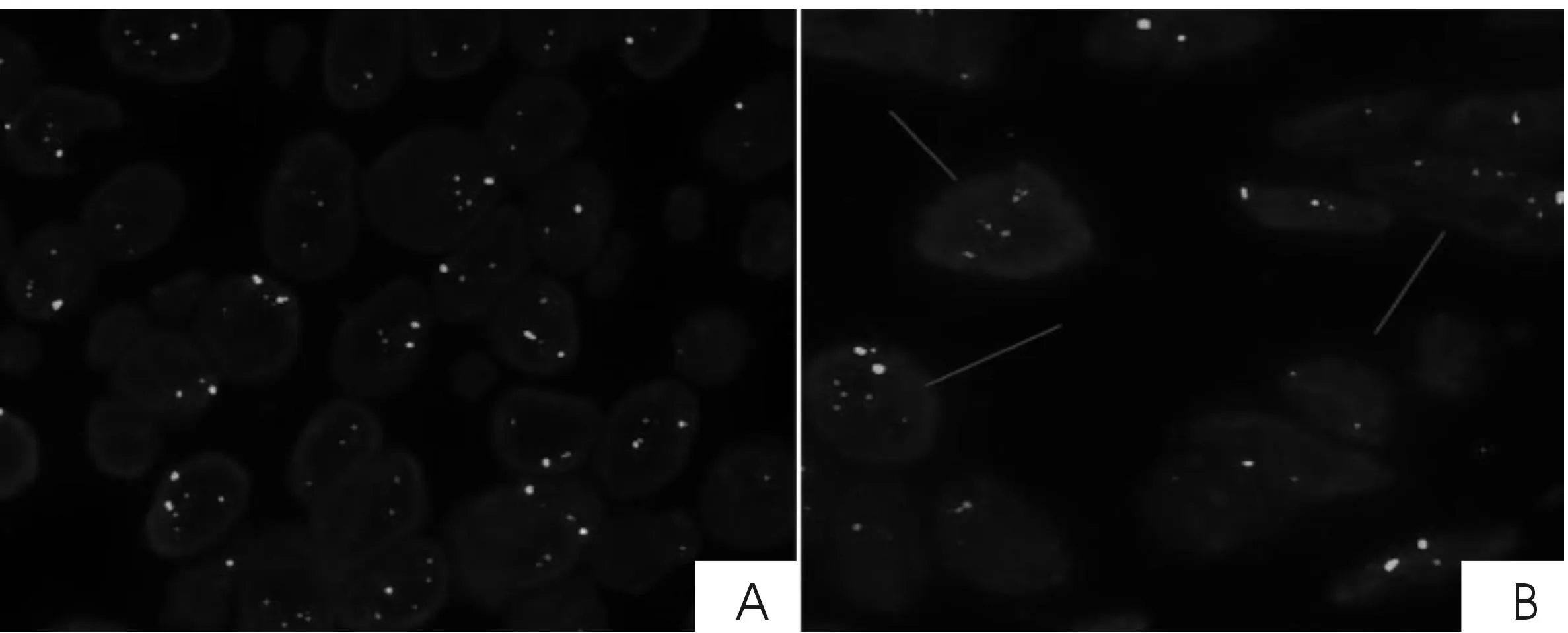
图2 乳腺导管内癌伴早期微浸润癌灶HER-2/neu基因点状扩增情况 (FISH,×1 000)

图3 导管内HER-2/neu基因表达情况(FISH,×1 000)
A:HER-2/neu基因显示簇状扩增(橘红色信号),17号染色体多倍体,簇状表达(绿色信号);B:导管内HER-2/neu基因显示簇状扩增,17号染色体二倍体
3讨论
约20%~25%的乳腺癌患者呈HER-2/neu过表达或基因扩增,其生物学行为恶性度高,预后不良。随着分子生物学的迅速发展,对原癌基因HER-2/neu的研究及其相关治疗已越来越受到重视[6]。本研究采用荧光原位免疫杂交的方法检测了存档案的92例乳腺癌石蜡包埋组织标本,其中单纯导管原位癌9例,导管内癌伴早期微浸润83例。
结果发现在导管内癌伴早期微浸润癌灶中,导管旁微浸润病灶中HER-2/neu的表达与同一病例中导管内成份较一致。所有导管内癌伴微浸润的扩增病例中,微浸润癌灶绝大多数(49/51,96.1%)与导管内癌同时扩增。微浸润癌灶未扩增的2例病例表现为导管内癌成分大部分未扩增,小部分扩增。未发现微浸润癌灶HER-2/neu基因单独扩增的情况,即导管内癌组织成份HER-2/neu基因扩增的生物学行为可能早于微浸润癌灶,且与Latta等[6]发现结果一致,HER-2/neu基因在导管原位癌中的表达高于导管旁微浸润癌灶中的表达(本实验未观察到显著统计学差异),理论上微浸润癌灶应具有恶性程度高及侵袭性高的特征,但微浸润癌灶的HER-2/neu基因较导管原位癌表达低的原因,HER-2/neu原癌基因在乳腺导管原位癌发展至浸润癌过程中的生物学行为尚需进一步临床及基础研究的证据。
导管原位癌,特别是高级别导管原位癌中HER-2/neu的过表达和扩增比率较高(50%~60%),本研究中导管原位癌中HER-2/neu扩增比率为33.3%,可能原因为本研究统计样本源为我院某时间段库存单纯导管原位癌,且只有9例,临床上这种病例并不常见,大多伴有微浸润成分。但研究发现单纯导管原位癌中扩增病例的HER-2/neu基因的平均扩增率较导管内癌伴早期微浸润病例的HER-2/neu基因扩增率高,由于样本量(单纯导管原位癌9例)原因,未作统计分析。
HER-2/neu 基因过度表达的乳腺癌恶性程度高,复发和转移发生早,预后差,对某些化疗药物有抵抗,且患者的无病生存和总生存期短。HER-2/neu基因作为独立预后指标,对于乳腺癌的预后评价及指导治疗有极其重要的价值。HER-2/neu过表达型乳腺癌有其特殊的生物学特性,在乳腺癌的4个分子亚型中 HER-2/neu 过表达型乳腺癌肿瘤细胞侵袭力强,容易发生转移,恶性程度高。
本研究中,除了观察导管原位癌伴或不伴早期微浸润的病例,研究者还同时观察了其余病理类型HER-2/neu基因的扩增情况,结果如下:浸润性导管癌伴导管内癌22例(浸润性导管癌占大多数,伴导管内癌成分,肿块直径0.6~9.0 cm),导管内癌伴浸润性导管癌7例(导管内癌占大多数,伴浸润癌成分,直径2~5 mm),均未见淋巴结转移;小叶原位癌6例(其中1例为导管原位癌与小叶原位癌并存,未见淋巴结转移),浸润性小叶癌41例(大多为浸润性小叶癌伴浸润性导管癌),肿块直径0.9~6.5 cm,可见前哨淋巴结转移,转移率为23.08%。22例浸润性导管癌为主伴导管内癌中7例HER-2/neu基因扩增,扩增率为31.81%。7例导管内癌为主伴浸润性导管癌中3例HER-2/neu基因扩增,扩增率为42.86%。研究发现小叶原位癌HER-2/neu表达普遍低于导管内癌的HER-2/neu表达,且多为阴性表达,故无足够FISH数据验证HER-2/neu基因扩增。浸润性小叶癌HER-2/
neu蛋白表达低于浸润性导管癌中的表达,且前者的HER-2/neu蛋白的表达多集中在0~+之间。小叶癌中HER-2/neu蛋白表达的低相关性是否与其高侵袭浸润的生物学行为表现(如小叶癌E钙黏素的低表达和高淋巴结转移率)不一致尚需进一步探讨。
本研究中关于HER-2/neu在导管内癌伴或不伴微浸润组织中的FISH研究将帮助确认临床难以诊断的疑似微浸润的部位,以指导临床治疗。HER-2/neu基因在乳腺导管原位癌中及其伴早期微浸润癌灶中的扩增的评价可能帮助识别存在进一步恶变潜能的原位癌,并为赫赛汀预防干预治疗提供潜在的分子靶标。
参考文献:
[1]Horimoto Y,Tokuda E,Arakawa A,et al.Significance of HER2 protein examination in ductal carcinoma in situ[J].J Surg Res,2011,167(2):e205-e210.
[2]Bouchalova K,Cizkova M,Cwiertka K,et al.Triple negative breast cancer-current status and prospective targeted treatment based on HER1 (EGFR),TOP2A and C-MYC gene assement[J].Biomed Pap Med Fac Univ Palacky Olomoul Czech Repub,2009,153(1):13-17.
[3]李海梅,李军扩,杜娴娟,等.免疫组化与荧光原位杂交检测乳腺癌组织中HER-2蛋白表达与基因扩增的比较分析[J].肿瘤基础与临床,2014,27(3):196-198.
[4]Liao N,Zhang GC,Liu YH,et al.HER2-positive status is an independent predictor for coexisting invasion of ductal carcinoma in situ of the breast presenting extensive DCIS component[J].Pathol Res Pract,2011,207(1):1-7.
[5]《乳腺癌HER2检测指南(2014版)》编写组.乳腺癌HER2检测指南(2014版)[J].中华病理学杂志,2014,43(4):262-266.
[6]Latta EK,Tjan S,Parkes RK,et al.The role of HER2/neu overexpression/amplification in the progression of ductal carcinoma in situ to invasive carcinoma of the breast[J].Mod Pathol,2002,15(12):1318-1325.
DOI:10.3969/j.issn.1673-5412.2015.05.002
[中图分类号]R737.9;R730.23
[文献标识码]A
[文章编号]1673-5412(2015)05-0372-05
(收稿日期:2015-06-13)
Role of HER2/neu Amplification in the Pure Ductal
Carcinoma in Situ and Micro Invasive Ductal Carcinoma of the Breast
Wu Xiaocui1,Chen Renyin2,Zhang Lan2,Meng Hui2
(1.DepartmentofRadiotherapy,HenanProvincialPeople’sHospital,Zhengzhou450003,China;
2.DepartmentofPathology,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China)
[Abstract]ObjectiveTo investigate the HER2/neu gene amplification in pure ductal carcinoma in situ and micro invasive ductal carcinoma of the breast and the clinical significance.MethodsThe HER2/neu gene amplification in the 168 cases of breast cancer were detected by using FISH technology.ResultsPure ductal carcinoma in situ,micro invasive of ductal carcinoma in situ,invasive ductal carcinoma,lobular carcinoma in situ,invasive lobular carcinoma were 9,83,29,6,41 cases,respectively.The HER-2/neu amplification ratios were 66.7% (6/9) in pure ductal carcinoma in situ,61.4% (51/83) in micro invasive of ductal carcinoma in situ,34.5% (10/29) in invasive ductal carcinoma,0.0% (0/6) in lobular carcinoma in situ,12.2% (5/41) in invasive lobular carcinoma.ConclusionHER-2/neu gene amplification has no significant differences between pure ductal carcinoma in situ and micro invasive lesions;HER-2/neu expressions in pure ductal carcinoma in situ and micro invasive lesions are consentaneous in most samples.HER-2/neu gene amplification ratio was higher in ductal carcinoma than lobular cases.
[Key words]breast cancer;HER-2/neu;ductal carcinoma in situ;micro invasive

