茅苍术愈伤组织诱导及其分化培养研究
茅苍术愈伤组织诱导及其分化培养研究
宋 刚,曹 正,宋金耀,戚海玲,谢正林
(江苏农林职业技术学院生物工程系,江苏句容 212400)
摘要[目的] 研究不同植物生长调节剂对茅苍术不同外植体愈伤组织诱导及分化的影响。 [方法]采用L9(34)正交试验设计,研究茅苍术愈伤组织诱导和分化的最优培养条件。[结果]最佳诱导培养方法:以叶片为外植体,反面朝下接种于培养基,培养基配方为MS+2.0 mg/L 2,4-D+1.0 mg/L NAA。愈伤组织分化不定芽的最优培养基配方为1/2MS +4.0 mg/L 6-BA+0.4 mg/L NAA。[结论]为茅苍术组培快繁技术与细胞培养技术奠定基础。
关键词茅苍术;正交试验;愈伤组织;不定芽
中图分类号S503.53
基金项目江苏农林职业技术学院院级科研项目。
作者简介宋刚(1978-),男,江苏盐城人,副教授,在读博士,从事植物生理、植物组织培养研究。
收稿日期2015-07-29
Study on Callus Induction and Differentiation Culture ofAtractylodeslancea
SONG Gang, CAO Zheng, SONG Jin-yao et al(Jiangsu Polytechnic College of Agriculture and Forestry,Jurong, Jiangsu 212400)
Abstract[Objective] The aim was to study the effect of different plant growth regulator on induction and differentiation of different explant callus.[Method] By L9 (34) orthogonal experiment design, the optimal culture conditions of callus induction and differentiation were studied. [Result] The best induction culture method was: with leaf as explant, the opposite face vaccination in culture medium, culture medium formula was MS + 2.0 mg/L 2, 4-D + 1.0 mg/L NAA. The optimal combination for callus differentiation adventitious bud was 1/2 MS + 4.0 mg/L 6-BA + 0.4 mg/L NAA. [Conclusion] The study laid a foundation for rapid propagation technology and cell culture technology of Atractylodes lancea.
Key wordsAtractylodeslancea; Orthogonal experiment; Callus; Adventitious bud

茅苍术(Atractylodeslancea)为菊科多年生草本植物,其根茎具有燥湿健脾、祛风散寒、明目等功效[1],为临床常用药之一。茅苍术主要产于江苏、湖北、浙江及安徽等地,传统上以江苏省茅山一带为中药材茅苍术的道地产区,包括现今江苏省南京、句容和金坛等地,历代本草专著均认为其质量好、疗效佳,曾作为贡品享誉全国[2-3]。近年来,国内外对茅苍术化学成分及其药理学研究表明,茅苍术根茎主要含有苍术素等活性成分;此外,还含有多糖、糖苷等一些水溶性活性成分以及铁、锌、镁、钙等多种人体必需的微量元素[4],具有保肝、抗心率失常、降血糖、抗菌、抗病毒、免疫调节及抗肿瘤等多种生物学活性。近年来因山地开垦和过度采挖,苍术野生资源日趋枯竭,通过组织培养不仅能够扩大繁殖,增加茅苍术产量,还可以在此基础上选育出高产优质的道地茅苍术新品种,增加种植茅苍术的比较效益,对缓解供需矛盾、保护野生茅苍术资源具有重要意义。通过组织培养获得无菌苗,为大规模商业化生产和繁殖种苗提供有效途径。有关茅苍术组织培养的研究较少。巢建国等[5]是最早涉及这方面研究的,他们用茅苍术胚根、胚轴、子叶、真叶为外植体诱导获得了完整的再生植株。
通常植物组织培养获得再生植株多采用间接器官发生途径,切取植株外植体在合适的条件下诱导愈伤组织,再筛选出生长情况较好的愈伤组织进行分化成苗。笔者通过研究不同植物生长调节剂对茅苍术不同外植体愈伤组织诱导及分化的影响,以期为茅苍术组培快繁技术与细胞培养技术奠定基础。
1材料与方法
1.1材料
1.1.1外植体。来自江苏农林职业技术学院组培中心以茅苍术种子无菌播种培养[6]得到的无菌苗。
1.1.2培养基。以MS为基本培养基,添加琼脂7.5 g/L,蔗糖30 g/L,pH调至5.8~6.2,高压蒸汽法灭菌,121 ℃,20 min。
1.1.3植物生长调节剂。2,4-D(2,4-二氯苯氧乙酸),NAA(萘乙酸),KT(激动素),6-BA(6-苄氨基嘌呤),配成相应浓度的母液。
1.2方法
1.2.1茅苍术愈伤组织诱导培养。 考察不同外植体和3种不同植物生长调节剂对愈伤组织诱导的影响,设计L9(34)正交试验(表1)。
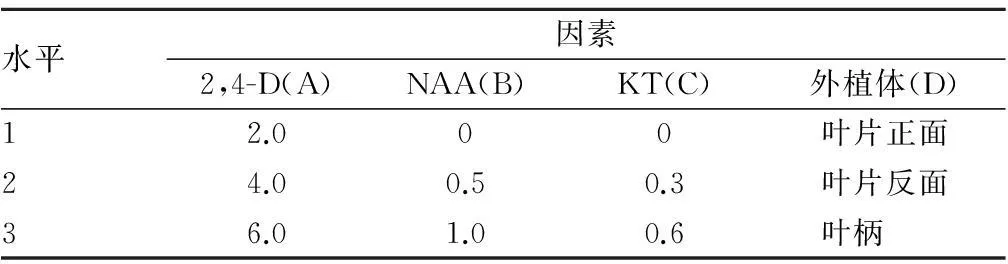
表1 茅苍术愈伤组织诱导正交试验因素水平 mg/L
将茅苍术无菌苗叶片切成0.3 cm×0.3 cm大小,叶柄切成0.3~0.5 cm小段,叶片外植体每个培养皿接种10个,叶柄外植体每个培养皿接种20个,每个试验重复2次。接种时叶片分为朝上和朝下2个方向,叶片和叶柄均平铺在培养基表面,略微用力使其与培养基充分接触。培养温度为(25±2) ℃,光照1 500~3 000 lx,光照时间为12 h/d。
每7 d统计一次愈伤组织诱导率,21 d后结束统计。
愈伤组织诱导率=形成愈伤组织的外植体数/接种的外植体数×100%
1.2.2茅苍术愈伤组织分化培养。选用常用的生长素NAA和细胞分裂素6-BA作为培养基中的植物生长调节剂。由于不能确定这两因素是否独立影响,所以需要考虑两因素间的交互作用。通过上述分析,设计了L9(34)正交试验考察NAA和6-BA 2种植物生长调节剂、基本培养基成分对愈伤组织分化出芽的影响。试验设计见表2。
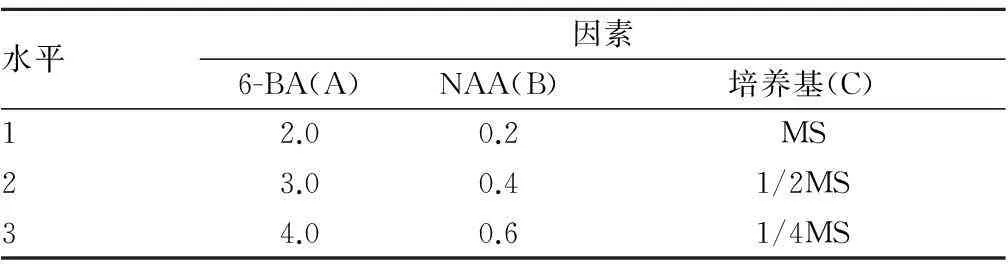
表2 茅苍术愈伤组织分化正交试验因素水平 mg/L
接种时选取生长旺盛、大小5 mm×5 mm的愈伤组织,均匀分布接种在分化培养基上,每瓶接种4块,每处理7瓶。培养基附加琼脂7 g/L,蔗糖30 g/L, pH 5.8。培养温度(25±2) ℃,光照时间12 h/d,光照强度1 500~3 000 lx。21 d后,统计愈伤组织的出芽率。
2结果与分析
2.1不同因素对茅苍术愈伤组织诱导的影响培养7 d左右,各外植体缺口处开始出现半透明的愈伤组织,随着培养时间的延长颜色逐渐变为黄绿色和黄白色,数量也越来越多。培养21 d后各处理的愈伤组织诱导率见表3。
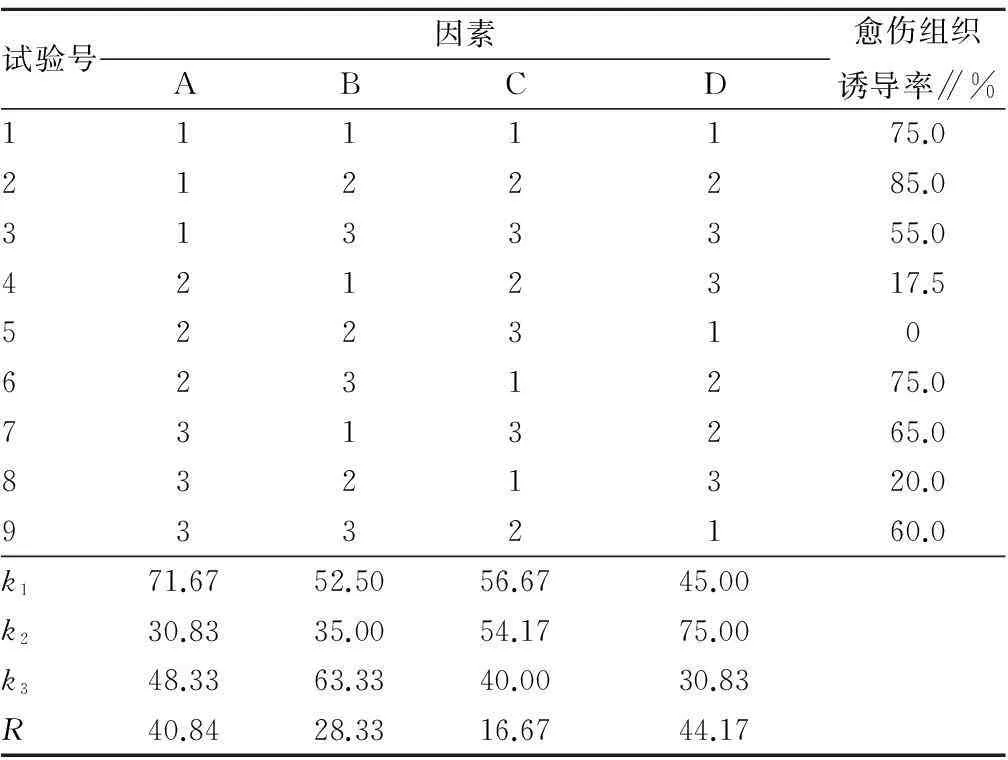
表3 不同植物生长调节剂对茅苍术叶柄愈伤组织诱导的正交试验结果
由表3可知,外植体的来源对愈伤组织诱导影响最大,极差值达到44.17。其次是2,4-D,在3种植物生长调节剂中其极差最大,达到40.84。说明除外植体因素重要外,2,4-D的浓度变化对诱导茅苍术愈伤组织也较重要,与陶金华等[7]研究结果一致。在3种植物生长调节剂中,KT的浓度变化对茅苍术愈伤组织的诱导影响最小。3种生长调节剂影响大小为2,4-D、NAA、KT,也进一步说明作为生长素的2,4-D和NAA在诱导愈伤组织产生过程中比作为细胞分裂素的KT作用大,这符合生长素作用主要是用于诱导愈伤组织形成、根的分化及细胞分裂和伸长的原理[8]。
茅苍术愈伤组织诱导的最佳条件为A1B3C1D2,即在MS培养基中加入2.0 mg/L的2,4-D和1.0 mg/L的NAA,采用叶片反面朝下接种的方式。
2.2不同因素对茅苍术愈伤组织诱导不定芽的影响培养7 d开始统计不定芽出芽率,21 d后各处理的出芽率见表4。
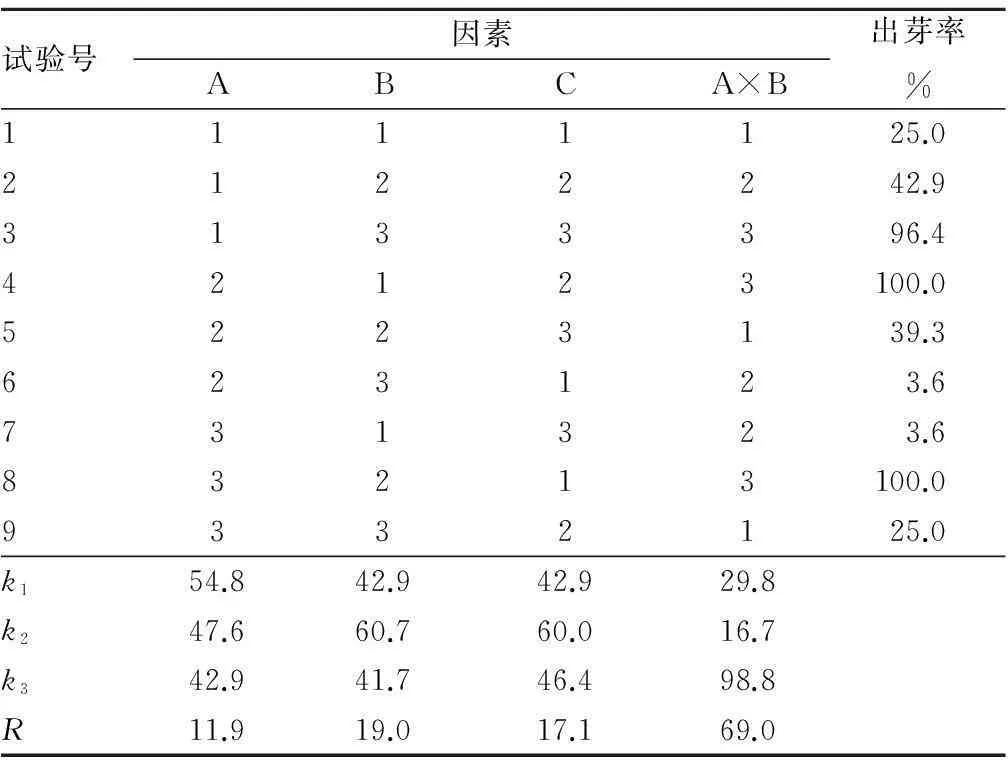
表4 茅苍术外植体愈伤组织诱导分化不定芽正交试验
由表4可知,各因素(及互作)对愈伤组织出芽率的影响的极差值以A×B最大,其后依次为B、C,最后是A,即各因素(及互作)影响的主次为A×B、B、C、A。对出芽率影响最大的是6-BA和NAA的互作。而且6-BA×NAA的R值超过了6-BA、NAA单独添加的影响,表明A与B的不同水平搭配对出芽率的影响最大。用A与B的双向搭配表进一步分析,结果见表5。从表5可以看出,A、B间最优的搭配是A2B1和A3B2组合,出芽率均为100.0%。虽然从单因素结果考察,A因素3个水平优劣为A1、A2、A3,但由于交互作用的影响,应选择A2和A3。B因素最优水平是B2,C因素最优水平是C2,因此,最优水平组合是A3B2C2。
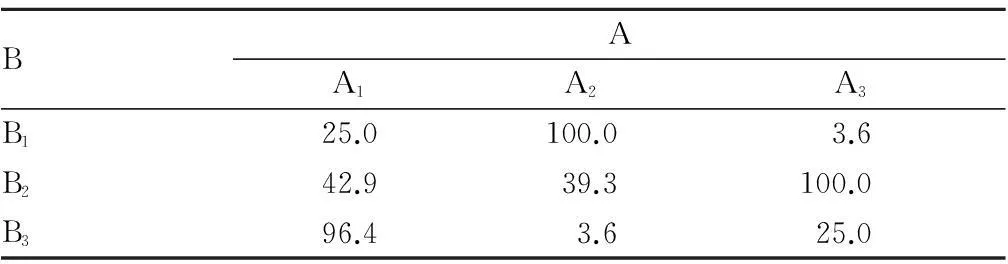
表5 A×B搭配
由此可知,茅苍术愈伤组织分化不定芽的最佳培养基配方组合为A3B2C2, 即1/2MS +4.0 mg/L 6-BA+0.4 mg/L NAA。
3 结论与讨论
3.1结论该研究中茅苍术愈伤组织诱导的最佳条件是MS培养基中加入2.0 mg/L的2,4-D和1.0 mg/L的NAA,采用叶片为外植体、反面朝下接种的方式。茅苍术愈伤组织分化不定芽的最佳培养基配方为1/2MS +4.0 mg/L 6-BA+0.4 mg/L NAA。
3.2讨论前人对苍术的组织培养研究表明,不同植物生长调节剂配比对苍术组织培养有重要影响。2,4-D是植物组织培养中常用的生长调节剂之一,一定浓度的2,4-D能促进植物愈伤组织的诱导,且诱导效果较好[9-11]。在诱导植物愈
伤组织时,2,4-D也通常与其他植物生长素类或细胞分裂素类物质一起使用,闻丽等[12]用2,4-D和NAA成功诱导了油茶的愈伤组织,在该试验中也证实了2,4-D和NAA对促进茅苍术愈伤组织的诱导有较好的效果。
适宜的外植体有助于愈伤组织的诱导[7]。该试验中,茅苍术不同外植体叶片正面、叶片反面和叶柄均可诱导出愈伤组织,但效果差异明显。平均诱导率以叶片反面最高,其次是叶片正面,最后是叶柄。笔者认为,叶片正反面都有切口与培养基接触,叶柄只有一端接触培养基,所以诱导率较低。另外,茅苍术叶为异面叶,正反面存在极性差异,这可能是两面诱导率不同的原因之一,在其他植物组培研究中也观察到此种现象[13-14]。
6-BA是植物愈伤组织分化中的重要植物生长调节剂。单独使用6-BA可使植物愈伤组织得以分化,与其他植物生长调节剂配合使用效果更好[15-16],该试验中6-BA和NAA互作影响确实高于6-BA和NAA单独使用结果。
以上讨论表明,植物生长调节剂是植物愈伤组织诱导和分化的重要因素。尽管其作用特点已知,但由于外植体所取部位的差异,植物生长调节剂剂量的选择以及不同植物生长调节剂使用时配比是探讨高效率进行植物愈伤组织诱导和分化的关键所在。其次,外植体的选择在植物愈伤组织诱导和分化过程中也具有重要作用。
参考文献
[1]国家药典委员会.中华人民共和国药典[S].北京:中国医药科技出版社,2010:150.
[2]黄璐琦,肖培根,王永炎.中国珍稀濒危药用植物资源调查[M].上海:上海科学技术出版社,2012:398.
[3]胡世林.苍术的本草考证[J].中国医药学报, 2001,16(1):11-13.
[4]郭兰萍, 刘俊英.茅苍术道地药材的挥发油组成特征分析[J].中国中药杂志, 2002, 27(11):814-819.
[5]巢建国, 谈献和, 张瑜, 等.茅苍术快速繁殖[J].中药材, 2001(7):473-474.
[6]宋刚, 沈菲, 王庆涛, 等.茅苍术无菌培养体系的构建[J].江苏农业科学, 2013, 41(11):46-47.
[7]陶金华, 濮雪莲, 江曙.茅苍术愈伤组织诱导及其细胞悬浮培养研究[J].广西植物, 2012, 32(1):118-123.
[8]陈世昌.植物组织培养[M].北京:高等教育出版社,2011.
[9]谷佳南, 司龙亭, 高兴, 等.黄瓜花药培养愈伤组织诱导及再生的研究[J].江苏农业科学, 2009(3):37-39.
[10]邱璐, 子桂才, 范树国, 等.正交试验法优选贯叶连翘组织培养条件[J].江苏农业科学, 2009(3):40-42.
[11]李志辉, 黄振, 杨模华, 等.马尾松幼苗茎段愈伤组织诱导的研究[J].中南林业科技大学学报(自然科学版), 2009, 29(2):30-33.
[12]闻丽, 张日清, 李典军.不同激素配比对油茶花药愈伤组织形成的影响[J].经济林研究, 2005, 23(4):21-23.
[13]马刘峰, 辛建华.甜瓜花药愈伤组织分化与激素处理间的关系[J].中国瓜菜, 2006(2):4-6.
[14]刘秀莲, 吴月燕.金边瑞香花瓣的愈伤组织诱导和植株再生研究[J].浙江万里学院学报, 2006, 19(2):87-90.
[15]陶建敏, 耿其芳, 庄智敏, 等.蓝浆果叶片高效再生体系的建立[J].西北植物学报, 2006, 26(3):610-614.
[16]宋刚, 徐银, 宋金耀, 等.不同因素对高丛越橘叶片初代培养的影响[J].江苏农业科学, 2010(4):44-45.

