碳源对烟曲霉WHSW-01产壳聚糖酶的诱导条件优化
阎贺静,刘畅,时月,李润丰
(河北科技师范学院食品科技学院,河北昌黎,066600)
壳聚糖降解后理化性质和生理活性都发生了变化,所得壳寡糖不仅易于被人体吸收利用,还具有许多独特的生理活性和功能,例如:能提高机体免疫力、抑制肿瘤细胞生长、活化增殖人体肠道内双歧杆菌等[1-2]。同时还具有抗菌防腐、保水保湿等功能,在医药、食品、化妆品、保健品等方面的应用前景令人瞩目[3-4]。由壳聚糖制备壳寡糖可通过化学降解、物理降解和酶降解进行[5-6]。与目前常用的化学降解法相比,酶法生产壳寡糖的反应条件温和易控,寡糖得率高、功能性更强,不易造成环境污染,是壳寡糖最理想的制备方法。
壳聚糖酶(chitosanase)又称壳聚糖-N-乙酰-氨基葡糖苷水解酶,对壳聚糖降解具有专一性是壳聚糖制备壳寡糖最理想的酶制剂[7-8],在工业上已有用于制备壳寡聚糖(Chitooligosaccharides,简称 COSs)的实例。虽然目前壳聚糖酶已经商品化,但由于原始菌株产壳聚糖酶能力仍然普遍偏低,使得壳聚糖酶的来源有限,生产成本高,导致商品壳聚糖酶价格居高不下[9-10]。同时目前的商品壳聚糖酶在热稳定性等方面还不足以适应大规模工业化降解壳聚糖的生产。目前的研究重点是采用不同的生物技术来提高壳聚糖酶生产菌的产酶能力。
本实验首先确定了烟曲霉WHSW-01产壳聚糖酶受碳源的诱导,通过不同碳源对烟曲霉WHSW-01细胞生长和产酶的影响,确定对烟曲霉WHSW-01产壳聚糖酶起最佳诱导作用的碳源,并进一步确定该最佳诱导碳源的添加量和添加时间来提高烟曲霉WHSW-01产壳聚糖酶的能量,在节约成本的前提下提高壳聚糖酶的产量。
1 材料与方法
1.1 实验材料与试剂
菌种:烟曲霉WHSW-01(由武汉生物工程学院酶工程教研室提供)[11];
试剂:琼脂粉,NaCl、MgSO4·7H2O 等其他试剂均为国产分析纯。
1.2 培养基
斜面(平板)培养基:胶体壳聚糖 1%,(NH4)2SO40.5%,K2HPO40.2%,NaCl 0.5%,Mg-SO4·7H2O 0.1%,琼脂2.0%,pH6.5。1%胶体壳聚糖的配制:每100 mL pH5.0的醋酸缓冲液中溶解1 g粉末壳聚糖。
摇瓶发酵基本培养基:NH4NO31.0%,K2HPO40.07%,KH2PO40.03%,MgSO4·7H2O 0.05%,NaCl 0.5%,酵母提取物0.5%,碳源(根据实验需求而变)。
1.3 研究方法
1.3.1 壳聚糖酶的摇瓶发酵
培养基为自然pH,摇瓶装液量70 mL/250 mL,接种量2%,培养温度30℃,转速180 r/min,振荡培养。
1.3.2 还原糖的测定
采用 3,5-二硝基水杨酸(DNS)法[12]。
1.3.3 DNS法测壳聚糖酶活力
先将加有1 mL的pH 5.6醋酸缓冲液和0.9 mL的1%标准胶体壳聚糖溶液的试管在50℃保温5 min,再加入0.1 mL的4 000 r/min离心15 min后的初酶液,于50℃下水浴保温15 min,加入1.5 mL的DNS终止酶促反应,显色沸水浴5 min,自然冷却,然后加入21.5 mL的蒸馏水,平衡后于4 000 r/min离心15 min,取上清液在可见光520 nm处测吸光度,根据氨基葡萄糖盐酸盐标准曲线求出反应液中的还原糖含量。酶活定义:1 mL酶液1 min催化产生1 μmol还原糖所需的酶量为1个单位(U/mL)。
1.3.4 壳聚糖水解液的制备
用1%胶体壳聚糖作摇瓶发酵基本培养基的碳源,取发酵到第3天的粗酶液10 mL,于50℃下水解450 mL的1%标准壳聚糖溶液50 min。
1.3.5 壳聚糖酶生物合成调节模式的考察
分别以1%壳聚糖胶体、0.5%胶体壳聚糖和0.5%葡萄糖、1%葡萄糖作为发酵培养基中的基本碳源进行壳聚糖酶的摇瓶发酵,每隔24 h测发酵液中壳聚糖酶的酶活。
1.3.6 不同碳源对WHSW-01产壳聚糖酶的影响
在基本发酵培养基中,分别以1%葡萄糖和1%氨基葡萄糖盐酸盐、2%氨基葡萄糖盐酸盐、1%葡萄糖和1%壳聚糖胶体、1%葡萄糖和1%粉末壳聚糖、2%葡萄糖、1%葡萄糖和1%壳聚糖水解液为碳源进行发酵培养,每隔24 h测发酵液中壳聚糖酶酶活,考察不同碳源对WHSW-01产壳聚糖酶的影响。
1.3.7 最佳诱导剂添加量对WHSW-01产壳聚糖酶的影响
将最佳诱导剂按照发酵液总体积的10%、20%、40%、60%的量在发酵初始添加,每隔24 h测壳聚糖酶的酶活和细胞生物量,考察最佳诱导剂的不同添加量对烟曲霉WHSW-01产壳聚糖酶的影响。
1.3.8 最佳诱导剂添加时间对WHSW-01产壳聚糖酶的影响
将最佳剂量的诱导剂分别在发酵进行的0、12、24、48、72、96 h 添加到发酵液中,每隔 24 h 测发酵液中壳聚糖酶的酶活和细胞的生物量,考察最佳诱导剂添加时间对烟曲霉WHSW-01产壳聚糖酶的影响。
1.3.9 生物量的测定方法
采用细胞干重测量法[13]。
2 结果和分析
2.1 烟曲霉WHSW-01中壳聚糖酶生物合成的调节模式
酶生物合成的调节模式主要有分解代谢物阻遏作用、诱导作用、反馈阻遏作用[14]。根据文献报道,大多数真菌中壳聚糖酶的合成模式以诱导型为主[15]。按照1.3.5方法确定烟曲霉WHSW-01合成壳聚糖酶是否受壳聚糖诱导,结果如图1所示。

图1 不同碳源对壳聚糖酶生物合成的影响Fig.1 Effects of different carbon on chitosanase biosynthesis
由图1可见,不同碳源对烟曲霉WHSW-01产壳聚糖酶的影响不同。当以葡萄糖为唯一碳源时,壳聚糖酶的合成量较低,最高酶活为0.89 U/mL。当培养基中存在胶体壳聚糖时,烟曲霉WHSW-01产壳聚糖酶的量较高。例如,以胶体壳聚糖为唯一碳源以及以葡萄糖和壳聚糖为碳源时,壳聚糖酶酶活最高分别为2.3 U/mL和2.89 U/mL。由此可见,烟曲霉WHSW-01产壳聚糖酶是受壳聚糖的诱导的。仅以葡萄糖作为碳源,不利于壳聚糖酶的合成,以葡萄糖为基础碳源,添加壳聚糖有利于该烟曲霉的产生。
2.2 不同诱导剂对烟曲霉WHSW-01产壳聚糖酶的诱导作用
以不同物质及不同形式的壳聚糖作为碳源,对微生物的生长和产酶有不同的影响。按1.3.6所示的方法分别添加不同碳源进行发酵。每隔24 h测发酵液中壳聚糖酶的酶活,考察不同碳源对烟曲霉WHSW-01产壳聚糖酶的诱导作用,结果如图2所示。
由图2可见,不同碳源对壳聚糖酶的合成有不同的影响。分别以葡萄糖、氨基葡萄糖盐酸盐以及葡萄糖和氨基葡萄糖盐酸盐为碳源时,最高酶活分别为0.95、3.4和1.6 U/mL;分别以葡萄糖和壳聚糖水解液、葡萄糖和壳聚糖粉末以及葡萄糖和胶体壳聚糖为碳源时,最高酶活分别为4.75、1.59和2.81 U/mL。并且碳源不同,该曲霉发酵产酶周期不同,以氨基葡萄糖盐酸盐及葡萄糖和壳聚糖粉末为碳源时,产酶高峰期出现在发酵的96 h,其他碳源发酵至120 h达产酶高峰期。由此可见,碳源不仅影响产酶酶量的高低,同时影响产酶周期,其中以壳聚糖水解液为碳源时壳聚糖酶产量最高。推测可能是由于壳聚糖水解液中含有某低聚壳寡糖对该曲霉的生长和产酶都有促进作用。但由于壳聚糖水解液由壳聚糖水解获得,水解液组成成份十分复杂,对壳聚糖酶产生诱导作用的具体原因需要进行进一步的研究。
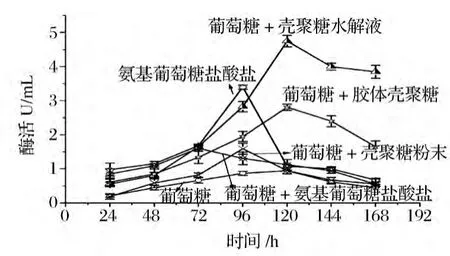
图2 不同碳源对壳聚糖酶的诱导作用Fig.2 Induction of different carbon resources on chitosnase production

图3 壳聚糖水解液添加量对烟曲霉生长和产酶的影响Fig.3 Effects of different chitosan hydrozate amount on A.fumigates WHSW-01growth and chitosanase production
2.3 壳聚糖水解液对烟曲霉WHSW-01产壳聚糖酶的诱导作用
为进一步提高该烟曲霉产壳聚糖酶的量,需要进一步确定壳聚糖水解液添加量,按照1.3.7的方法进行发酵,每隔24 h测发酵液中细胞干重和壳聚糖的酶活力,结果如图3a和图3b所示。
由图3b可知,壳聚糖水解液添加量不同,对壳聚糖酶的合成影响也不同。其中添加占发酵液总体积40%的壳聚糖水解液进行发酵,其壳聚糖酶酶活产量最高,发酵至120 h达最高酶活4.88 U/mL。当继续增加壳聚糖水解液添加量至60%壳聚糖酶产量降低(图3b所示)。分析原因可能是由于壳聚糖水解液添加量较高时,某种壳聚糖水解产物含量较高,对壳聚糖酶的合成产生了抑制作用。此外,根据图3a和3b所示,发现烟曲霉WHSW-01发酵产壳聚糖酶的开始时间与细胞的生长同步,但当发酵至72 h后细胞生物量开始减少,而壳聚糖的酶活却继续增加,直至发酵至120 h酶活达到最大值。由此可以说明,以壳聚糖水解液为诱导碳源时,烟曲霉WHSW-01产壳聚糖酶的合成模式为延续合成型。此类型的合成模式特点是细胞停止生长而酶仍在继续合成,因此会积累大量的目的酶,这是酶生物合成的最佳合成模式[14]。
2.4 壳聚糖水解液添加时间对烟曲霉WHSW-01产壳聚糖酶的诱导作用
为进一步提高壳聚糖酶的产量,按照1.3.8所示的方法考察了壳聚糖水解液的添加时间,每隔24 h测壳聚糖酶的活力,结果如图4所示。
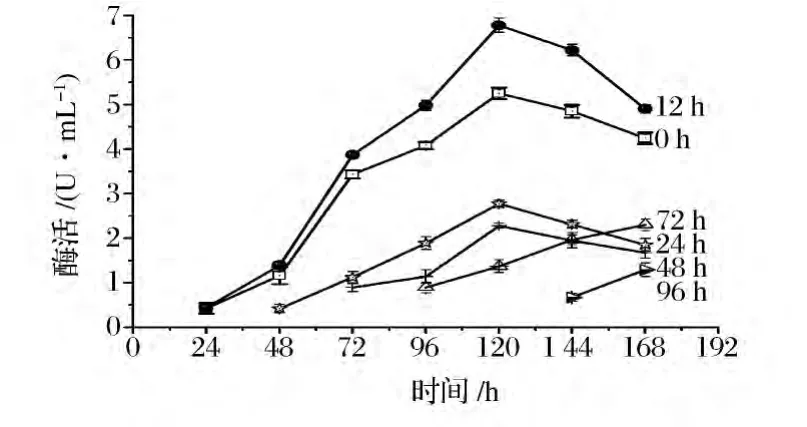
图4 壳聚糖水解液加时间对烟曲霉产壳聚糖酶的影响Fig.4 Effects of chitosan hydrozate addition time on chitosanase production
由图4可见,在不同时间添加壳聚糖水解液,对WHSW-01产壳聚糖酶的影响不同。其中发酵0 h和12 h时添加壳聚糖水解液产酶效果最佳。两者在发酵至120 h均达到产酶高峰,最高酶活分别为5.25 U/mL和6.78 U/mL。随着壳聚糖水解液添加时间的滞后,该菌株的产酶量逐渐降低,由此可见壳聚糖水解液的添加最好在发酵初期进行。
图5为发酵12 h时添加壳聚糖水解液时细胞生长和产酶情况。在发酵至48 h时细胞生物量达到最大,即细胞生长进入稳定期,发酵至72 h以后细胞生长进入了衰亡期。然而发酵产酶高峰期却出现在发酵进行至120 h时,最高酶活达到6.78 U/mL。分析酶产量增加的原因可能如下,(1)发酵进行至12 h添加壳聚糖水解液,有利于发酵初期烟曲霉利用速效碳源迅速繁殖,使细胞大量积累,而后诱导剂的添加使细胞大量产酶;(2)由图5可以判断,此条件下烟曲霉WHSW-01壳聚糖酶的合成模式为延续合成型,即细胞停止生长后酶继续合成,酶的合成时间较其他类型的合成模式长,因此壳聚糖酶的产量增加;(3)由于烟曲霉为丝状真菌,摇瓶振荡发酵时,菌丝相互缠绕而形成菌丝球,发酵期间菌丝球内会包裹大量的酶液,当发酵后期菌丝球出现自溶,包裹在菌丝球中的壳聚糖酶被释放到发酵也中,这在表观上体现在发酵液酶活的提高[15]。综上所述,烟曲霉 WHSW-01在基础培养基(基础碳源为1%的葡萄糖)发酵至12 h时间添加壳聚糖水解液最佳,有利于微生物细胞的繁殖和积累,壳聚糖酶的合成模式为延续合成型,合成时间比较长,产酶量较高。
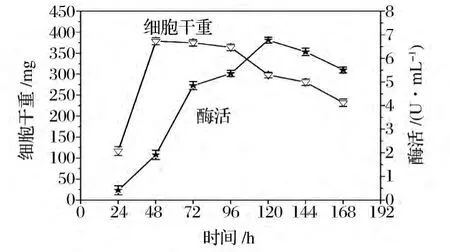
图5 发酵12 h添加壳聚糖水解液条件下细胞生长及产酶Fig.5 Curves of A.fumigates WHSW-01growth and chitosanase production in condition of chitosan hydrozate additon after fermentation continued 12 h
3 讨论与结论
壳聚糖酶是高效、特异降解壳聚糖的酶。关于壳聚糖酶的研究,国内外学者做了大量的工作。一方面利用现代分子生物学技术挖掘新型壳聚糖酶基因并进行高效表达[16-19];另一方面通过传统方法进行高产菌株的筛选及发酵条件的优化[20-25],在一定程度上提高了壳聚糖酶的产量。本研究发现烟曲霉WHSW-01在只含有葡萄糖的培养基中细胞生长较好,但产酶量极低;而在含有葡萄糖和壳聚糖的培养基中产酶量大大增加,说明该菌种产壳聚糖酶受壳聚糖的诱导作用。进一步的研究发现,壳聚糖水解液对壳聚糖酶的产生具有更大的诱导作用,比使用胶体壳聚糖做诱导剂时最高酶活提高1.35倍。本文研究确定,WHSW-01在基础培养基发酵至12 h时添加占发酵液总体积40%的壳聚糖水解液产酶量最高为6.78 U/mL,与前期烟曲霉WHSW-01基础培养条件下最高酶活3.7 U/mL相比提高了83.24%[26]。其实,对于酶的发酵生产,在确定基本培养条件基础上,还可通过多种手段提高细胞产酶能力。曾有学者在培养过程中采用热激作用提高了壳聚糖酶的产量[27-28]。Sinha等利用虾蟹壳来源的几丁质水解物作培养基进行壳聚糖酶发酵生产,也达到了提高壳聚糖酶产量的目的[29]。也有人在发酵过程中通过分阶段控制营养物质、pH等策略提高发酵产物的产量,确实得到了不错的效果[30-31]。有研究表明,微生物产壳聚糖酶受不同碳源的诱导作用[15,32]。对于既定的壳聚糖酶生产菌,考察诱导物及其诱导条件,在一定程度上可以提高酶的产量。本文的研究正是基于此目的进行的,结果表明使用壳聚糖水解液可以进一步提高酶的产量。虽然本研究并未使酶产量提高很大,与基因工程菌壳聚糖酶的产量无法相比[18],但与菌种诱变及发酵基本条件优化等对壳聚糖酶产量的提高相比[21-24],本研究中壳聚糖酶产量的提高还是比较明显的;此外,碳源的诱导策略应用于基因工程菌,也很有可能使产酶有较大的提高;同时本研究也为下一步的研究提供了方向,例如:可以进一步考察壳聚糖水解成分如低聚合度壳聚糖对壳聚糖酶的诱导作用,由此进一步提高产酶;此外还可以展开低聚壳聚糖对烟曲霉诱导作用机理的研究,为烟曲霉产壳聚糖酶发酵过程的进一步优化提供参考。
[1] 高维,丁文平.低分子量壳聚糖的制备及其应用研究[J].武汉工业学院学报,2007,26(3):28-31.
[2] Yeon Jin Choi,Eun Jung Kim,Zhe Piao,et al.Purification and characterization of chitosanase from Bacillus sp.strain KCTC 0377BP and its application for the production of chitosan oligosaccharides[J].Applied and Environmental Microbiology,2004,7(8):4 522-4 531.
[3] 张长梅,于抒含,张良栓,等.不同分子量壳寡糖的制备及其生物活性研究[J].哈尔滨医科大学学报,2013,47(6):486-489.
[4] 朱玉霞.壳寡糖的制备、分离分析及抑菌活性研究[D].无锡:江南大学硕士论文,2013:1-3.
[5] Monaghan R L,Eveleigh D E,Tewari R P,et al.Chitosanase,a novel enzyme[J].Nature New Boil,1973,245(142):78-80.
[6] Takashi Kuroiwa,Yohei Noguchi,Mitsutoshi Nakajima,et al.Production of chitosan oligosaccharides using chitosanase immobilized on amylose-coated magnetic nanoparticles[J].Process Biochemistry,2008,43(1):62-69.
[7] 阳丽,杨萍,王曼莹.壳聚糖酶的研究进展[J].化学工程与设备,2010(5):118-119.
[8] Yu-Mi Park,Sa-Youl Ghim.Enhancement of the activity and pH-performance of chitosanase from Bacillus cereus strains by DNA shuffling[J].Biotechnol Letters,2009,31(9):1 463-1 467.
[9] YANG Li,YANG Ping,WANG Man-ying.Expression of chitosanase gene from Aspergillus fumigatus JXSD-97 in Pichia pastoris[J].African Journal of Biochemistry Research,2010,4(8):204-209.
[10] Ho-Geun Yoon,Kyung-Han Lee,Hee-Yun,et al.Gene cloning and biochemical analysis of thermostable chitosanase(tch-2)from Bacillus coagulans CK108[J].Biosci Biotechnol Biochem,2002,66(5):986-995.
[11] 阎贺静,周念波,涂绍勇,等.壳聚糖酶生产菌筛选、鉴定及其酶学性质[J].广东农业科学,2012(24):161-164.
[12] 赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[13] 诸葛健,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994:219.
[14] 郭勇.酶工程[M].北京:科学出版社,2009:31-40.
[15] SUN Yu-ying,HAN Bao-qin,LIU Wan-shun,et al.Substrate induction and statistical optimization for the production of chitosanase from Microbacterium sp.OU01[J].Bioresource Technology,2007,98(8):1 548-1 553.
[16] 费忠,李恒,龚劲松,等.基于宏基因组学壳聚糖酶挖掘研究[J].应用环境生物学报,2014,20(4):597-601.
[17] 卢华定,连礼熠,陈明伟,等.曲霉菌内切型壳聚糖酶基因克隆及在大肠杆菌中的表达[J].中国组织工程研究,2014,18(34):5 490-5 496.
[18] 裘梁,杨萍,董德刚,等.重组烟曲霉壳聚糖酶在毕赤酵母中高密度发酵表达及性质研究[J].江西师范大学学报(自然科学版),2013,37(6):607-610.
[19] Dong-Jun Seo,Ji-Hae Lee,Yong-Su Song,et al.Expression patterns of chitinase and chitosanase produced from Bacillus cereus in suppression of phytopathogen[J].Microbial Pathogenesis,2014(73):31-36.
[20] 赵有玺,龚平,王科力,等.产壳聚糖酶菌株选育及产酶条件研究[J].食品科技,2014,39(5):2-5.
[21] 石会会,高艳艳,王秀英,等.产壳聚糖酶菌株的筛选、鉴定及发酵条件优化[J].食品工业,2014,35(2):54-57.
[22] 马靖峰,郭晓凤,刘欢,等.海洋细菌 Renibacterium sp.QD1产壳聚糖酶发酵培养基的统计优化[J].食品工业科技,2014,35(21):146-149.
[23] 刘杰,王延鹏,许晶,等.响应面法优化壳聚糖酶产生菌Mitsuaria sp.K1的产酶发酵条件[J].化工进展,2013,32(12):2 946-2 951.
[24] 谭海刚,李静,付均鹏.响应面法优化放线菌L012产壳聚糖酶培养基[J].中国食品学报,2013,13(10):73-79.
[25] WANG Chuan-lu,SU Jien-wei,LIANG Tzu-wen,et al.Production,purification and characterisation of a chitosanase from Bacillus cereus[J].Research on Chemical Intermediates,2014,40(6):2 237-2 248.
[26] 韩晓红,阎贺静.烟曲霉WHSW-01产壳聚糖酶基本培养条件及发酵过程分析[J].贵州农业科学,2013,41(3):80-83.
[27] Kien Xuan Ngo,Hiroshi Umakoshi,Toshinori Shimanouchi,et al.Heat-Enhanced production of chitosanase from Streptomyces griseus in the presence of liposome[J].Journal of Bioscience and Bioengineering,2005,100(5):495-501.
[28] Kien Xuan Ngo,Hiroshi Umakoshi,Haruyuki Ishii,et al.Oxidative/heat stress enhanced production of chitosanase from Streptomyces griseus cells through its interaction with liposome [J].Journal of Bioscience and Bioengineering,2009,108(6):471-476.
[29] Sinha S,Chand S,Tripathi P.Microbial degradation of chitin waste for production of chitosanase and food related bioactive compounds[J].Applied Biochemistry and Microbiology,2014,50(2):125-133.
[30] LIU Long,DU Guo-cheng,CHEN Jian,et al.Influence of hyaluronidase addition on the production of hyaluronic acid by batch culture of Streptococcus zooepidemicus[J].Food Chemistry,2008,110(4):923-926.
[31] LIU L,WANG M,DU G,et al.Enhanced hyaluronic acid production of Streptococcus zooepidemicus by an intermittent alkaline-stress strategy[J].Letters in Applied Microbiology,2008,46(3):383-388.
[32] Kwang Kim,Hong-Seok Ji.Effect of chitin sources on production of chitinase and chitosanase by Streptomyces griseus HUT 6037[J].Biotechnology and Bioprocess Engineering,2001,6(1):18-24.

