壳聚糖微球固定化β-半乳糖苷酶*
汤卫华,王立晖,殷海松,孙勇民
(天津现代职业技术学院生物工程学院,天津,300350)
低聚半乳糖(galactooligosaccharides,GOS)是以高浓度乳糖做底物,在具有半乳精基转移活性的β-半乳糖苷酶(EC3.1.3)的作用下,将半乳糖转移到乳糖的半乳糖基上,低聚半乳糖是在乳糖中的半乳糖基一侧结合1~4个分子的半乳糖的混合物。它是功能性低聚糖的一种,在母乳中的含量非常丰富,因此低聚半乳糖作为双歧杆菌的增殖因子引起人们的关注[1-2]。
目前低聚半乳糖的制备方法主要有天然原料提取、天然多糖酸解、化学合成法、酶法和微生物发酵法,其中酶法具有催化效率高、能耗低、污染低等优点,是低聚半乳糖生产的主要方法[3]。酶法生产包括直接酶法和固定化酶法两种,尽管直接酶法水解乳糖的工艺技术比较简单且成熟,但商品化β-半乳糖苷酶存在价格昂贵,添加量偏大且不利于产品的分离纯化等缺点,因此很多研究者进行固定化β-半乳糖苷酶生产低聚半乳糖的探索和研究。
壳聚糖是从虾、蟹等甲壳类动物的外壳中提取的一种氨基多糖,来源丰富,具有生物相容、生物降解、无毒、抗菌、螯合重金属离子、对蛋白质有高度亲和等特点,是一种非常好的固定化载体[4]。很多研究人员[5-7]都进行了壳聚糖固定化β-半乳糖苷酶的研究,取得了较好的固定化效果。壳聚糖因其来源不同,制备工艺不同,分子质量变化较大,从几十万到几百万不等,因此对固定化载体成球性影响较大。本文从壳聚糖载体和固定化条件两个方面综合研究固定化β-半乳糖苷酶的条件。
1 材料与方法
1.1 材料与仪器
β-半乳糖苷酶(米曲霉来源,13.4 U/mg,Sigma公司),分子质量分别为5 ×104、10 ×104、20 ×104、30×104、50×104的壳聚糖(脱乙酰度≥90%,深圳市中发源生物科技有限公司),乳糖(化学纯,天津市光复精细化工研究所),戊二醛(分析纯,天津市科密欧化学试剂有限公司),邻硝基苯酚 β-D-半乳糖苷(oNPG,Sigma公司),其他试剂均为分析纯。
紫外可见分光光度计UV-5500(PC),上海元析仪器有限公司;恒温摇床培养箱HNY2012C,上海百典仪器有限公司;数显恒温水浴锅(HH-1),嘉兴市中新医疗仪器有限公司。
1.2 实验方法
1.2.1 壳聚糖微球制备条件的确定
1.2.1.1 壳聚糖分子质量的确定[8]
分别称取1.0 g不同分子质量(5×104、10×104、20×104、30 ×104、50 ×104)的壳聚糖,用质量分数为2%的醋酸溶液溶解为4%的壳聚糖溶液,真空脱泡后加入注射器中,均匀滴入4 mol/L NaOH溶液中,反应一段时间后,取出用蒸馏水充分洗涤浸泡至中性,肉眼观察壳聚糖的成球效果。
1.2.1.2 壳聚糖浓度的确定
称取一定质量的壳聚糖(分子质量为30×104),溶解于质量分数为2%的醋酸溶液中,形成浓度为1%、2%、4%、6%的壳聚糖,真空脱泡后加入注射器中,均匀滴入4 mol/L NaOH溶液中,反应一段时间后,取出用蒸馏水充分洗涤浸泡至中性,肉眼观察壳聚糖的成球效果。
1.2.2 固定化条件的确定
1.2.2.1 戊二醛浓度的选择
分别取1.0 g壳聚糖微球5份,分别加入质量浓度为1、5、10、15、20 g/L 的戊二醛5 mL,在30 ℃下120 r/min振荡反应2h后,磷酸盐缓冲液(pH 6.0)清洗多余的戊二醛。然后加入1 mg/mL的 β-半乳糖苷酶液2 mL,4℃冰箱过夜,再用磷酸盐缓冲液(pH 6.0)清洗未交联的酶,即制备得到固定化酶,并测定固定化酶的活力和计算活力回收率。
1.2.2.2 戊二醛交联时间的选择
分别取1.0 g壳聚糖微球5份,加入质量浓度为10 g/L的戊二醛5 mL,30℃,120 r/min下分别振荡反应 0.5、1、2、4 和 6 h,磷酸缓冲液(pH6.0)清洗多余的戊二醛。然后加入1 mg/mL的β-半乳糖苷酶液2 mL,即制备得到固定化酶,并测定固定化酶的活力和计算活力回收率。
1.2.2.3 酶浓度的选择
分别称取1.0 g壳聚糖微球5份,加入相同浓度和体积的戊二醛,在30℃,120 r/min下分别振荡反应相同的时间后,磷酸盐缓冲液(pH6.0)清洗多余的戊二醛。再分别加入0.25、0.5、1.0、1.5和2.0 mg/mL酶液2 mL,4℃冰箱过夜,用缓冲液清洗未交联的酶,测定固定化酶的活力和计算活力回收率。
1.2.2.4 酶固定化时间的确定
分别称取1.0 g壳聚糖微球7份,加入相同体积和浓度的戊二醛,在30℃,120 r/min下振荡反应一段时间后,磷酸盐缓冲液(pH 6.0)清洗多余的戊二醛。加入相同浓度和体积的酶液,4℃冰箱固定化时间分别为 2、4、6、8、10、12、14 h,再用缓冲液清洗未交联的酶,测定固定化酶的活力和计算活力回收率。
1.2.3 β-半乳糖苷酶活力测定[9]
游离酶液1 mL或固定化酶1 g加入9 mL 2 mmol/L oNPG(pH 5.5,0.1 mol/L醋酸缓冲液配制),40℃反应10 min,取混合液1 ml,再加入1 mL 0.5 mol/L Na2CO3溶液终止反应,离心,上清液测OD420。活力单位规定:以1 min催化oNPG生成1 μmol邻硝基苯酚的酶量为1个酶活力单位。
2 结果与讨论
2.1 固定化载体的确定
2.1.1 壳聚糖分子质量的确定
分别考察不同分子质量的壳聚糖(5×104、10×104、20 ×104、30 ×104、50 ×104)对成球效果的影响,结果如表1所示。

表1 固定化载体壳聚糖分子质量的确定Table 1 Determinationof the molecular weight of chitosan
由表1可知,不同分子质量的壳聚糖成球效果存在差异,壳聚糖分子质量为3×105时,壳聚糖微球成球效果最好,同时具有较好的机械强度。当壳聚糖分子质量大于3×105时,制成溶液黏度大,不易成球且机械强度差,使用效果不好。当壳聚糖分子质量小于3×105时,由于壳聚糖分子质量过小,制成溶液黏度过低,壳聚糖液滴在NaOH溶液中不能形成固定化膜或形成的固定化膜强度不够,不易形成球形载体,这与李鸿玉的结论是相似的[10]。因此选取分子质量为3×105的壳聚糖作为酶固定化载体。
2.1.2 壳聚糖浓度的确定
壳聚糖浓度大小会影响溶液的密度和黏度,因此称取一定质量的壳聚糖(分子质量为3×105),溶解于醋酸溶液中,形成浓度为1%、2%、4%和6%的壳聚糖,探讨不同浓度的壳聚糖溶液对壳聚糖成球性的影响,结果见表2。

表2 固定化载体壳聚糖浓度的确定Table 2 Determination of the concentration of chitosan
结果表明,当壳聚糖浓度为1%时,因其浓度太低,制得的壳聚糖溶液黏度太低,不易成球。当壳聚糖浓度继续增加,成球效果和机械强度进一步提高,酶活力和酶活力回收率均达到较好的效果。壳聚糖的浓度增至6%时,壳聚糖浓度过高,黏度过大,大部分形成块状,不易成球。因此选择壳聚糖的体积分数为4%。
2.3 固定化条件的确定
2.3.1 戊二醛浓度的确定
考察不同的戊二醛浓度对固定化酶活力和活力回收率的影响,结果如图1所示。
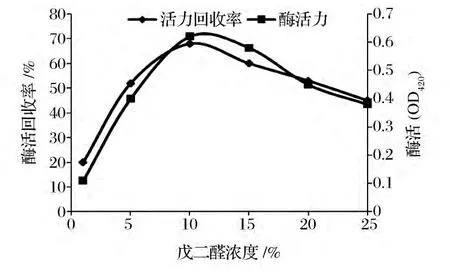
图1 戊二醛浓度对固定化酶活力及回收率的影响Fig.1 Effect of glutaraldehydeconcentration on activity and recovery of immobilized enzyme
由图1可知,随着戊二醛浓度的提高,酶活力回收率和酶活力都随之增加。但当戊二醛浓度达到10 g/L后,再增加戊二醛浓度,酶活力回收率和酶活力开始下降。这是因为戊二醛是一种双功能试剂,双醛基可以与壳聚糖和酶分子上的氨基结合,将酶固定在壳聚糖微球上。但是当戊二醛浓度过量,可能由于空间位阻和酶的多点连接,导致酶分子构象改变而失活,从而降低酶的活力回收率和酶活力[10]。因此选择戊二醛浓度为10 g/L。
2.3.2 戊二醛交联时间的确定
分别取1.0 g壳聚糖微球5份,加入浓度为10 g/L的戊二醛5 mL,在30℃下120 r/min分别振荡反应0.5、1、2、4 和6 h。与酶固定化后,测定固定化酶的活力和计算活力回收率,结果如图2所示。
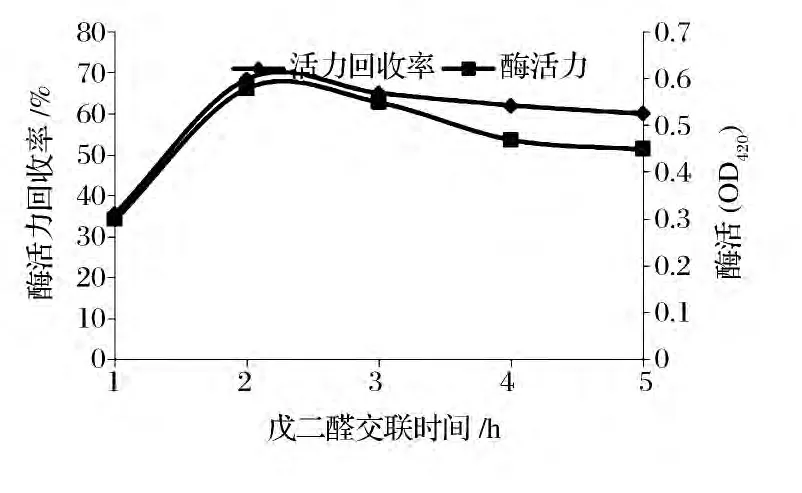
图2 戊二醛交联时间对固定化酶活力及回收率的影响Fig.2 Effect of glutaraldehyde timeon activity and recovery of immobilized enzyme
由图2可知,在初始阶段,戊二醛交联时间延长,酶的活力回收率和酶活力也随之提高。这说明交联剂戊二醛除了扩散到壳聚糖微球内部形成交联反应外,还有一部分戊二醛与壳聚糖的自由氨基反应形成悬挂醛基[11]。当跟游离酶固定化时,更多的酶分子跟悬挂醛基交联,将酶固定在壳聚糖载体上。当交联时间为1 h时,酶活力和酶活力回收率两个参数均达到最高值;但当交联时间继续增加,两个参数都有所下降,这是由于过多的醛基会导致酶变性失活。因此选择最适的交联时间是1 h。
2.3.3 酶浓度的选择
在相同的固定化条件下,考察不同的酶浓度对酶活力和酶活力回收率的影响,结果如图3所示。

图3 酶浓度对固定化酶活力及回收率的影响Fig.3 Effect of enzyme concentration on activity and recovery of immobilized enzyme
由图3可知,随着酶浓度的提高,酶活力回收率下降,而固定化酶活力却持续上升。综合考虑酶制剂的成本、酶活力和酶活力回收率,选择酶浓度为1.0 mg/mL。
2.3.4 固定化时间的确定
在相同的条件下,考察酶固定化时间(2、4、6、8、10、12、14 h)对酶活力及活力回收率的影响,结果如图4所示。
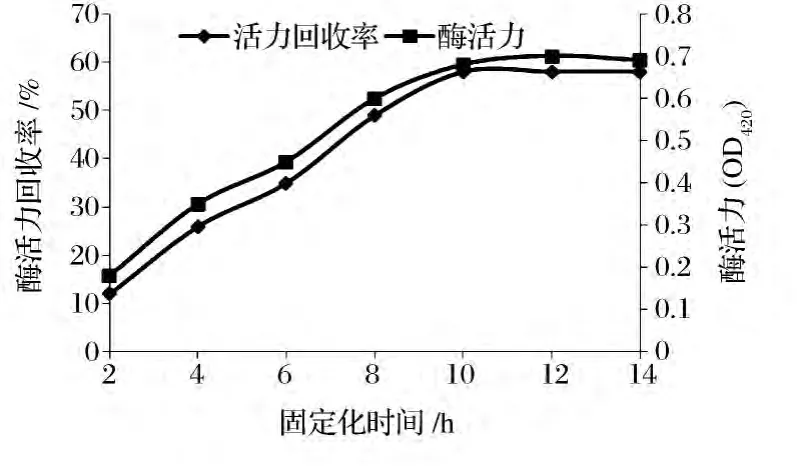
图4 固定化时间对固定化酶活力及回收率的影响Fig.4 Effect of immobilization time on activity and recovery of immobilized enzyme
由图4可知,随着固定化时间的延长,活化的壳聚糖载体与酶的交联吸附作用增加,固定化酶的活力和活力回收率不断增加,当固定化时间达到10 h后,载体与酶的作用达到饱和,反应达到平衡,再继续增加固定化时间,固定化酶活力和回收率都趋于稳定,因此选择的固定化时间是10 h。
2.3.5 酶固定化条件的优化
在单因素实验的基础上进行正交试验,以酶活力回收率为考察指标,进一步优化酶固定化条件,正交试验因素水平设计如表3所示,正交结果分析见表4。
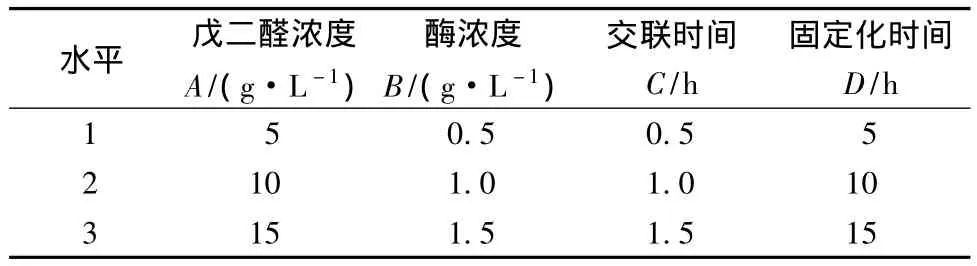
表3 正交实验因素水平Table 3 Factors and levels in orthogonal experiment
由表4可以看出戊二醛浓度(A)、酶浓度(B)、交联时间(C)和固定化时间(D)组合A2B3C2D3最好,即戊二醛浓度为10 g/L,酶浓度为1.5 mg/L,戊二醛交联时间为1.0 h,固定化时间为12 h。
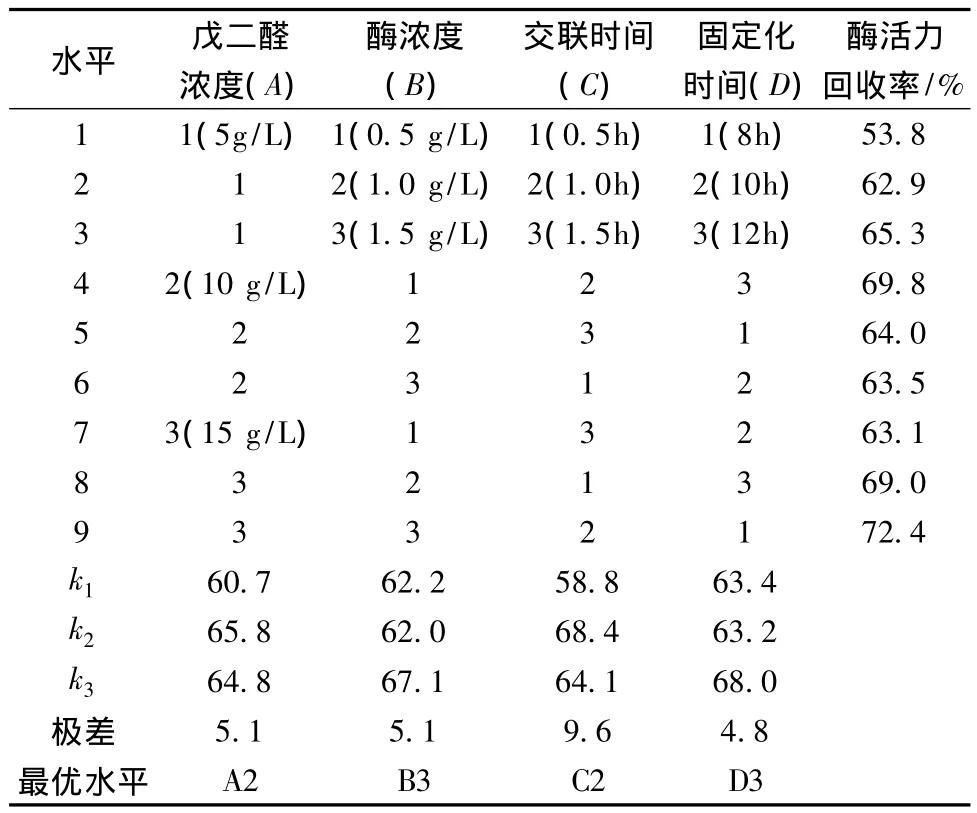
表4 正交结果分析Table 4 Orthogonal Results
采用以下条件制备固定化酶:壳聚糖的分子质量为3×105,壳聚糖浓度(体积分数)为4%、二醛浓度为10 g/L,酶浓度为1.5 mg/L,戊二醛交联时间为1.0 h,固定化时间为12 h,测定固定化酶的活力回收率达70.5%。国内现有的采用壳聚糖固定化β-半乳糖苷酶的研究中,范家佑[6]采用壳聚糖固定半乳糖苷酶后,其酶活力回收率可以达到67%;而敖海英[5]以壳聚糖戊二醛交联吸附法固定化半乳糖苷酶后,其酶活力回收率仅达到26.43%。因此综合考虑固定化载体和固定化条件能够实现酶活力回收率的最优化,使固定化酶更具有应用价值。
2.4 固定化酶的应用
2.4.1 固定化酶的储存稳定性
在无底物存在下,将固定化酶和游离酶在4℃下分别保存1、2、3、4和5周后,每周测定酶的活力,结果见图5所示。

图5 固定化酶的储存稳定性Fig.5 Storage stability of immobilized enzyme
由图5可知,游离酶在1周内,酶活力下降了40%,而固定化酶的活力保持在96.2%。4周后,固定化酶的活力能够保持原有活力的88.5%,而游离酶几乎完全失活。这说明β-半乳糖苷酶经过固定化后,具有更好的储存稳定性。
2.4.2 固定化酶的操作稳定性
将固定化酶在相同的条件下,使用5次,分别测定酶活力,结果见图6所示。
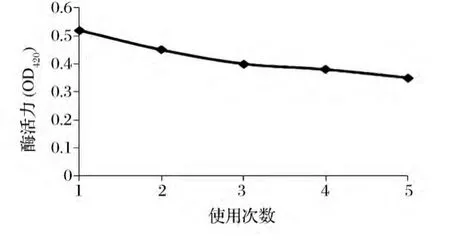
图6 固定化酶的操作稳定性Fig.6 Operational stability of immobilized enzyme
由图6可知,固定化酶的活力基本保持稳定,操作5次后,酶活力保持原有活力的67.3%,酶活力损失达到32.7%,具有较好的操作稳定性。
Urrutia等[12]采用壳聚糖固定化 β-半乳糖苷酶后,重复使用10个周期,仍能保持超过70%的初始酶活性,当在4℃和pH 7.0条件下保存93d后,β-半乳糖苷酶失去其初始酶活性的9.4%。Emese等[13]采用壳聚糖微球固定化β-半乳糖苷酶后,在4℃和pH 7.0下储存3周,固定化酶的活力损失不超过5%。本实验固定化酶储存4周后,仍能保持88.5%的活力,反复使用5次后,酶活力保持67.3%,其储存和操作稳定性都达到应用的水平。
3 结论
采用壳聚糖为载体,戊二醛为交联剂固定化β-半乳糖苷酶。确定了固定化载体和固定化条件:壳聚糖的分子质量为3×105,壳聚糖浓度(体积分数)为4%,交联剂戊二醛浓度为10 g/L,交联时间是1 h,酶浓度为1.5 mg/mL,固定化时间是12 h,最后测定固定化酶的活力回收率达70.5%。同时固定化酶具有良好的储存和操作稳定性:储存时间4周后,保持88.5%的酶活力;重复操作5次后,保持67.3%的酶活力,具有良好的应用前景。
[1] 张志国.功能性低聚半乳糖的研究进展及应用[J].中国食品添加剂,2012(6):207-213.
[2] Georgiou G,Lin S C,Sharma M M.Surface-active compounds from micro-organisms[J].Bio Technology,1992,10(1):60-65.
[3] 徐晨,陈历俊,石维忱,等.低聚半乳糖的研究进展及应用[J].中国食品添加剂,2011(1):205-209.
[4] 董炎炎,刘长虹,马霞.酶固定化载体材料的研究进展[J].上海应用技术学院学报(自然科学版),2013,13(4):295-298.
[5] 刘思聪,蒋爱民,阳晖,等.壳聚糖膜固定化 β-D-半乳糖苷酶的研究[J].食品研究与开发,2006,27(2):12-17.
[6] 敖海英,张洋,李红,等.壳聚糖固定化β-半乳糖苷酶的研究[J].中国乳品工业,2002,30(5):27-33.
[7] 岳振峰,彭志英,徐建祥,等.壳聚糖固定化&-葡萄糖苷酶的研究[J].食品与发酵工业,2001,27(4):20-24.
[8] 孙素芳,张燕,吕树芳,等.壳聚糖固定化酶载体小球的研究及制备方法的改进[J].河北大学学报(自然科学版),2009,29(2):68-172.
[9] 袁绍鹏,肖敏,孙正,等.一株曲霉(Aspergillus sp.AF)β-半乳糖苷酶转糖基活性研究[J].食品与发酵工业,2003,29(11):31-34.
[10] 李鸿玉,厉重先,李祖明.磁性壳聚糖微球固定化果胶酶的研究[J].食品科学,2008,29(9):399-403.
[11] 胡文静,谭天伟,王芳,等.改性壳聚糖固定化脂肪酶的研究[J].生物工程学报,2007,23(4):667-671.
[12] GamzeD A,Senay A C.Immobilization of pepsin on chitosan beads[J].Food Chemistry,2007,100(3):964-971.
[13] Urrutia P,Bernal C,Wilson L,et al.Improvement of chitosan derivatization for the immobilization of Bacillus circulans β-galactosidase and its further application in galacto-oligosaccharide synthesis[J].Journal Agricultural and Food Chemistry,2014,62(41):10 126-10 235.
[14] Emese Biró,Ágnes Sz,Németh,et al.Preparation of chitosan particles suitable for enzyme immobilization[J].Journal of Biochemical and Biophysical Methods,2008,70(6):1 240-1 246.

