乳酸菌及葡萄糖对鱼片中细菌群落及TVBN值的影响*
周幸芝,段杉,孟晓华,3,梁少雅,4,吕建秋,蒋艳萍
1(华南农业大学食品学院,广东 广州,510642)
2(江门市地尔汉宇电器股份有限公司,广东江门,529040)3(鹤壁职业技术学院,河南鹤壁,458030)
4(平安数据科技(深圳)有限公司,广东深圳,518031)5(广东省科技管理与规划研究院同,广东 广州,510642)
在高于冰点的冷藏温度下,鱼片的保质期仍较短,为延长鱼片的保质期,通常是添加防腐剂,但合成防腐剂一般不易被消费者接受,而天然防腐剂往往抑菌谱窄、保鲜效果较差、价格高,而且国家《食品添加剂使用卫生标准》中批准使用的天然防腐剂种类十分有限,难以满足实际生产需要。
近年兴起的生物保鲜技术则提供了一种保藏鱼片的新方法,该方法利用微生物之间的拮抗或竞争作用,在接近新鲜状态下保藏食品[1-4]。
Nychas等[5]和 Stanbridge 等[6]均认为,在有氧冷藏条件下,肉类食品的主要腐败微生物假单胞菌首先利用葡萄糖,当环境中的葡萄糖消耗完毕后,假单胞菌才开始分解氨基酸,并产生胺、氨、吲哚、硫化氢等各种腐败产物。鱼片与哺乳动物肉类类似,蛋白质含量高,碳水化合物含量很低,如果在基本不改变鱼片风味等感官质量的前提下,适当添加葡萄糖等碳水化合物,则微生物对蛋白质的分解可能减少,有望在一定程度上减少腐败产物的产生。
乳酸菌的生长和代谢一般需要葡萄糖等碳源,在用乳酸菌保鲜鱼片的过程中,适当添加葡萄糖是否可以增强乳酸菌的保鲜作用,迄今未见报道。本文针对乳酸菌及葡萄糖对鱼片中细菌群落和TVBN生成量的影响进行了研究。
1 材料与方法
1.1 原料
罗非鱼片:由茂名市海名威水产科技有限公司提供。
乳酸菌:Lactobacillus acidophilus CICC6074,Lactobacillus plantarum CICC6009,Lactobacillus plantarum CICC6234,购自中国工业微生物菌种保藏管理中心;Lactobacillus acidophilus GIM1.208,Lactobacillus bulgavicus GIM1.189,Lactobacillus helveticus GIM1.157,Lactobacillus delbrueckii subsp.bulgaricus GIM1.204,购自广东省微生物研究所微生物菌种保藏中心;Lactobacillus acidophilus SW01,Lactobacillus sp.SW02,Lactobacillus sp.SW03,为本课题组从虾头虾壳中筛选得到。
细菌基因组DNA快速提取试剂盒,广州东盛生物科技公司;DNA Marker DL2000,NEW GENE BIOTECHNOLOGY;Goldview染料(含量≥95%),CAT;溴化乙锭(EB)应用液、6×上样缓冲液,WOSLEN;2×GoTaq Green Master Mix,Promega;引物,上海捷瑞生物工程有限公司合成。
1.2 方法
1.2.1 罗非鱼片的处理
分别配制1.5%葡萄糖溶液、3×108CFU/mL的嗜酸乳杆菌CICC6074悬液2种(即以无菌蒸馏水配制的悬液以及以1.5%葡萄糖溶液配制的悬液),将罗非鱼片分别浸泡在上述各溶液中30 min,以浸泡蒸馏水的罗非鱼片为对照,沥干3 min,然后以塑料膜覆盖,放于4℃冰箱中,每隔3 d取样分析。
CICC6074悬液的制备方法:将活化后的嗜酸乳杆菌CICC6074接种于100 mL MRS液体培养基中,36℃培养24 h,无菌条件下取1 mL菌悬液测定乳酸菌数;同时将剩余菌悬液离心,弃清液,得菌体沉淀,再用无菌水洗沉淀2次,离心收集菌体,将菌体加无菌水稀释至浓度为3×108CFU/mL悬液。
1.2.2 挥发性盐基氮(TVBN)的测定
按照GB/T 5009.44-2003微量扩散法测定[7],以每100 g样品中所含氮质量(mg)表示。
1.2.3 细菌总数的测定
按GB 4789.2-2010方法测定。
1.2.4 pH值的测定
使用pH计测定。
1.2.5 葡萄糖的测定
采用DNS-二硝基水杨酸法测定。
1.2.6 细菌DNA的提取
取10 g鱼肉于盛有玻璃珠及90 mL生理盐水无菌锥形瓶中,于摇床上振荡后静置5 min,取20 mL上清液,然后离心保留沉淀的菌体,按试剂盒说明提取细菌DNA。将所提DNA溶于60 μL TE洗脱液中,取4 μL用1%琼脂糖凝胶电泳检测,其余置于-20℃冰箱保存备用。
1.2.7 细菌DNA的16S rDNA的V3可变区的PCR扩增
采用巢氏PCR,第1轮采用引物8f/798r扩增约800 bp的细菌16S rDNA片段[8]。PCR反应体系(25 μL):GoTaq Green Master Mix(2 × )12.5 μL,引物各1 μL(10 μmol/L),细菌 DNA 模板 2 μL,ddH2O 8.5 μL。PCR扩增程序:94℃预变性2 min;94℃变性1 min,58 ℃ 退火1 min,72 ℃延伸2 min,25 个循环;最后72℃再延伸2 min。取4 μL PCR产物利用含Goldview染料的1%琼脂糖电泳检测产量及特异性,其余用于第2轮PCR反应。
第2轮PCR以第1轮PCR产物为模板,采用引物GC338f/518r,对细菌16SrDNA的V3区片段进行touch down PCR扩增。反应体系(50 μL):GoTaq Green Master Mix(2 × )25 μL,引物各1 μL(10 μmol/L),DNA 模板 1 μL,ddH2O 22 μL。PCR 扩增程序:94℃ 预变性5 min,然后采用touch down PCR程序,20个循环(94℃变性1 min;退火温度从65~55℃,退火30 s;72℃延伸3 min),再于恒定的退火温度下进行10个循环(94℃变性1 min,55℃退火30 s,72℃延伸3 min),最后72℃再延伸10 min[9-10]。PCR产物经1.2% 琼脂糖凝胶电泳检测后,-20℃冻存。
扩增所用引物序列见表1。
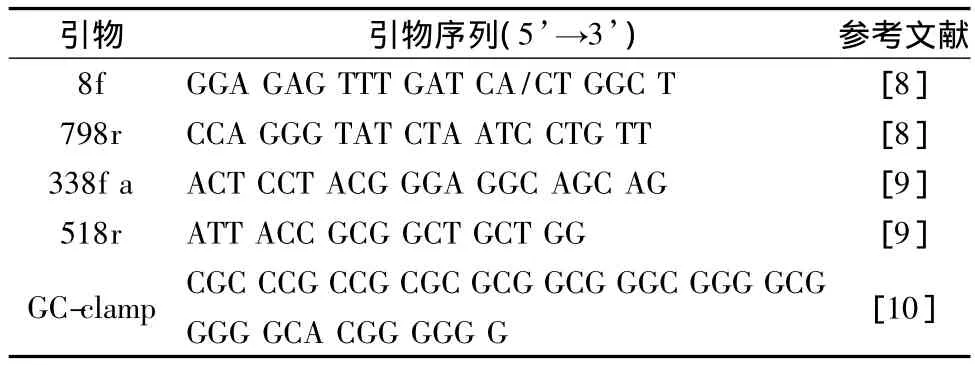
表1 扩增所用引物Table 1 The primers used in this research
1.2.8 PCR产物的DGGE分析
参照Muyzer等[10]方法,聚丙烯酰胺凝胶质量浓度为80 g/L(丙烯酰胺与甲基双丙烯酰胺的质量比为37.5∶1),变性剂梯度为40% ~60%(100%变性剂含有7 mol/L尿素和40%甲酰胺),在1×TAE缓冲液中,60℃恒温条件下,150 V电压电泳5 h。电泳结束后,将DGGE胶片用1×TAE(含0.5 mg/L EB)染色30 min。弃去染色液,再用 ddH2O漂洗10 min。染色后用凝胶成像系统照相。
1.2.9 DGGE条带的切割、重扩增及PCR产物纯化
参照Toffin等[11]方法,切下 DGGE电泳胶片中的主要条带,压碎并以30 μL ddH2O浸泡,4℃放置过夜。取上述浸泡液10 μL作DNA模板,以338f(无GC夹)/518r为引物,采用前述PCR条件扩增。取4 μL PCR产物,琼脂糖电泳检查产量及特异性。PCR产物的纯化采用割胶纯化法。
1.2.10 DGGE条带的克隆、测序
DNA测序由上海生物工程技术服务公司完成。将割胶纯化后的PCR产物连接到pMD18-T载体上,转化DH5α细胞,对阳性克隆株进行测序。测序获得细菌16S rDNA V3区片段序列后,用BLAST命令与GenBank数据库进行比对,找出相似度最高的序列。
2 结果与讨论
2.1 用于鱼片保鲜的乳酸菌菌种的筛选
由表2可以看出,经以不同乳酸菌处理的罗非鱼片在冷藏过程中其TVBN值均明显比对照鱼片低,说明上述乳酸菌对鱼片均有一定的保鲜效果。其中CICC 6074和GIM1.208的效果接近,且优于其他乳酸菌,但冷藏9 d后的感官评定结果表明,经CICC 6074处理的鱼片的感官质量略优于经GIM1.208处理的鱼片,因此,选择CICC 6074处理鱼片进行以下研究。
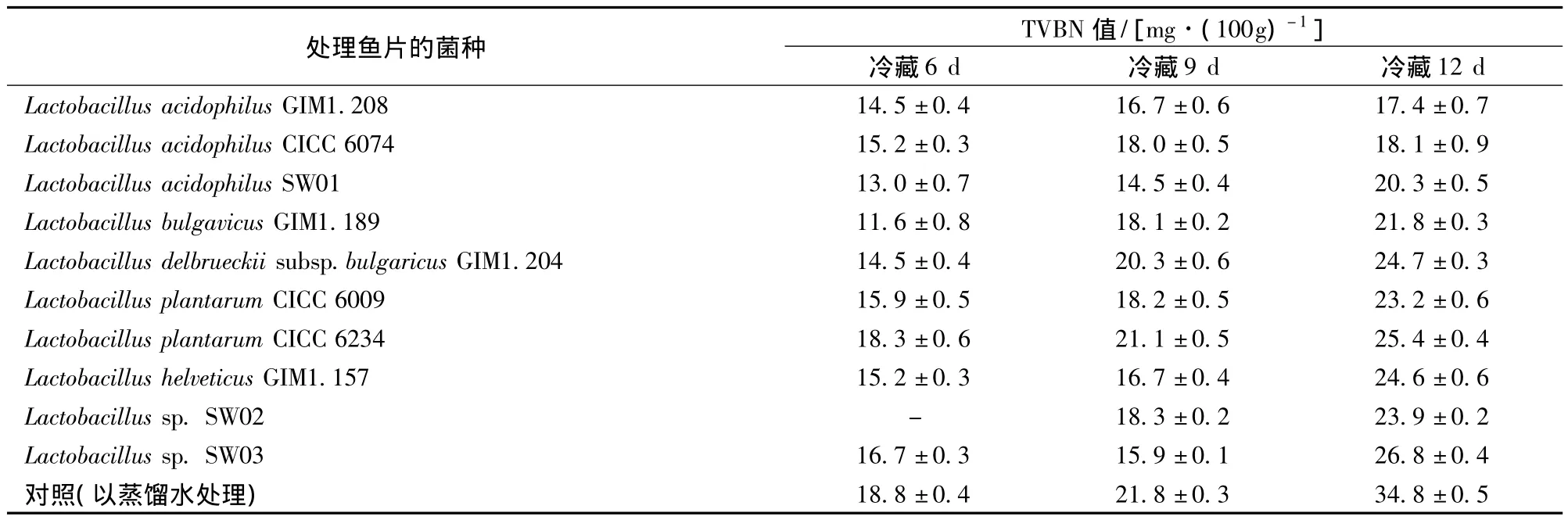
表2 用不同乳酸菌处理的罗非鱼片在4℃冷藏过程中的TVBN值变化Table 2 Changes of TVBN values of tilapia fillets treated with various lactic acid bacteria during 4℃cold storage
2.2 添加葡萄糖对冷藏罗非鱼片的TVBN值和菌落数的影响
感官评定结果表明,经葡萄糖处理过的鱼片在外观、风味、口感方面基本未变。添加葡萄糖的鱼片以及未添加葡萄糖的对照鱼片在4℃冷藏条件下其各种指标变化如图1和图2所示。图1显示,冷藏6 d时对照鱼片的TVBN值已达到22 mg/kg,超过国家限量标准200 mg/kg[12];而添加葡萄糖的罗非鱼片其TVBN值仅为91 mg/kg,大大低于对照鱼片;冷藏至9 d时,上述二种鱼片的TVBN值较接近且均已很高。但观察图2中葡萄糖含量的变化,就可以发现冷藏6 d以内,添加葡萄糖的鱼片中葡萄糖的含量一直显著高于对照鱼片,但至第6天时其含量已由最初的0.75%下降至0.09%,已基本被消耗完毕,所以在6~9 d的冷藏过程中已无葡萄糖的影响。总结上述现象,可以发现鱼片中葡萄糖含量与TVBN值之间有一定的规律可循,即葡萄糖含量较高时TVBN值较低,反之则明显增高。Koutsoumanis等[13]也发现当肉类中葡萄糖浓度下降到很低时腐败现象才变得明显。
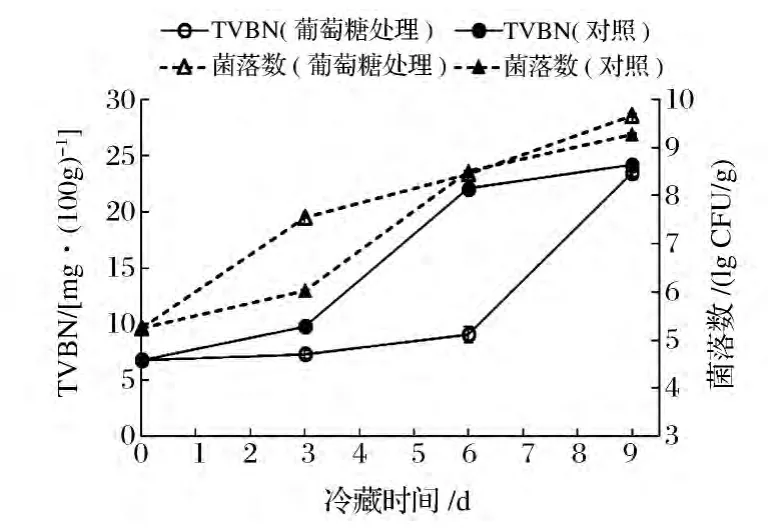
图1 添加葡萄糖的罗非鱼片在冷藏过程中的TVBN和菌落数的变化Fig.1 Changes of TVBN and bacterial population of the fillets added with glucose during cold storage
从图1还可以看到,冷藏至第3天时,添加葡萄糖的鱼片的菌落数显著高于对照鱼片的菌落数(P<0.05),冷藏6 d以后,二者菌落数接近,这说明添加葡萄糖后鱼片上的细菌更快进入对数期,导致冷藏初期添加葡萄糖的鱼片上细菌数较多,但添加葡萄糖基本不影响鱼片上最终的细菌数量。Lambropoulou等[14]也发现在碎牛肉中添加葡萄糖基本不改变菌相和细菌数量。值得注意是,尽管冷藏至3天时,添加葡萄糖的鱼片的菌落数高于对照鱼片的菌落数,但TVBN值则相反,仍然是添加葡萄糖的鱼片TVBN值较低,这是因为添加的葡萄糖满足了鱼片中的细菌对碳源和能源的基本需求,鱼片中的蛋白质不再作为碳源和能源,而只是作为氮源被细菌分解利用,由于被细菌分解的蛋白质大大减少,所以TVBN等蛋白质分解产生的腐败产物也大大减少。
虽然图2显示冷藏中添加葡萄糖的鱼片与对照鱼片的pH值存在一定差别,但二种鱼片的pH值始终维持在6.08~7.09之间,二者之间最大的差距出现在冷藏6 d时,分别为6.08和6.79,由常识可知,在此pH范围内,普通细菌的生长和代谢不可能受到比较明显的影响,也不可能造成冷藏6 d以内TVBN值的巨大差别。
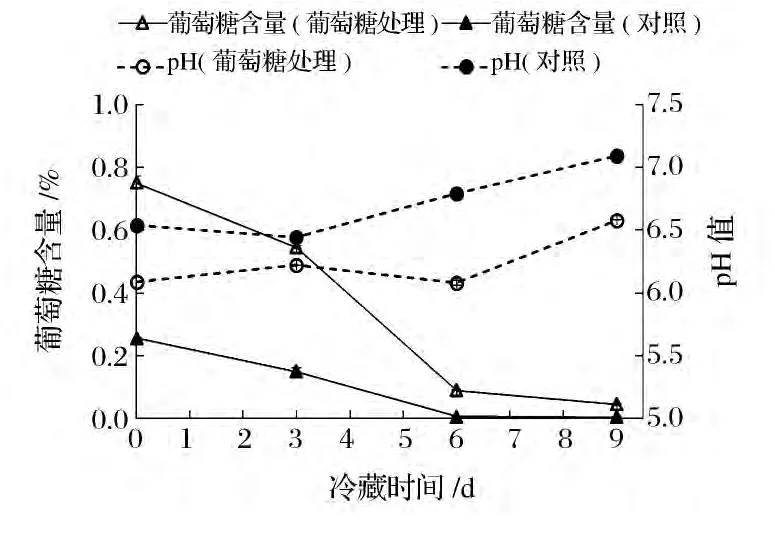
图2 添加葡萄糖的罗非鱼片在冷藏过程中的葡萄糖和pH含量的变化Fig.2 Changes of glucose content and pH of the fillets added with glucose during cold storage
2.3 嗜酸乳杆菌CICC 6074对冷藏罗非鱼片的TVBN值的影响
从图3可以看到,无论是否添加葡萄糖,嗜酸乳杆菌CICC 6074悬液浸泡过的鱼片其TVBN值均显著低于对照鱼片,对照鱼片冷藏6 d时TVBN值已达到 221 mg/kg,超过国家限量标准200 mg/kg[12];而经CICC 6074悬液浸泡的添加及不添加葡萄糖的二种鱼片的TVBN值分别仅为44、65 mg/kg,与对照鱼片的差异极显著(P<0.01),直至冷藏12 d时,此二种鱼片的TVBN值才超过国家限量标准。Ndaw等[15]以乳酸菌和葡萄糖处理沙丁鱼片,也发现TVBN显著降低。从图3还可以看到经CICC 6074悬液浸泡并且添加葡萄糖的鱼片的TVBN值始终略低于仅经CICC 6074悬液浸泡的鱼片,但方差分析显示在冷藏的前9 d二者不存在显著性差异(P>0.05),9 d后差异显著(P<0.05),因此,以CICC 6074和葡萄糖共同处理鱼片究竟是否会进一步降低TVBN值需进一步研究确定。图4显示CICC 6074悬液浸泡过的添加及不添加葡萄糖的二种鱼片冷藏过程中的pH值变化不存在显著性差异(P>0.05),但与对照鱼片的pH值变化存在显著性差异(P<0.05)。罗非鱼片中添加了乳酸菌,利用菌落计数的方法无法得知腐败菌的数量,因此本文没有进一步研究嗜酸乳杆菌CICC 6074对罗非鱼片上细菌菌落数的影响。
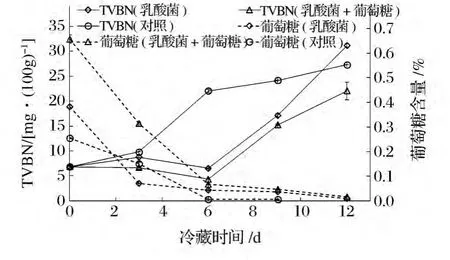
图3 嗜酸乳杆菌CICC 6074处理的罗非鱼片在冷藏过程中TVBN和葡萄糖含量的变化Fig.3 Changes of TVBN and glucose content of the fillets treated with L.acidophilus CICC6074 during cold storage
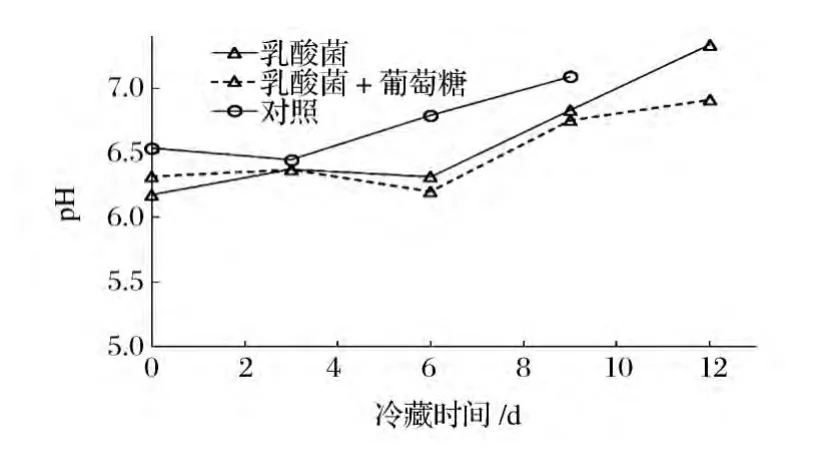
图4 嗜酸乳杆菌CICC 6074处理的罗非鱼片在冷藏过程中pH的变化Fig.4 Changes of pH of the fillets treated with L.acidophilus CICC6074 during cold storage
2.4 嗜酸乳杆菌CICC6074对冷藏罗非鱼片上细菌生长的影响
本文进一步采用PCR-DGGE的方法分析了嗜酸乳杆菌CICC6074对冷藏罗非鱼片上细菌生长的影响。经PCR扩增的细菌16S rDNA经DGGE电泳,电泳图谱如图5所示。
切割图5中各电泳条带并经测序后与GeneBank中序列比对,鉴定结果如表3所示。在冷藏初期对照组鱼片上主要有少量希瓦氏菌和假单胞菌,而经过CICC6074处理的鱼片上嗜酸乳杆菌占绝对优势。在冷藏过程中,假单胞菌数量逐渐增多,对照组鱼片在冷藏3 d后其假单胞菌的数量已明显增加,6 d后则基本达到最高峰,直至结束其数量基本保持恒定;而经过CICC6074处理的鱼片冷藏3 d后假单胞菌数量基本未增加,冷藏6 d后才明显增加。此外,随着冷藏时间延长,检测到的细菌种类也有所增加,至冷藏6 d后逐渐出现嗜冷杆菌、黄杆菌以及几种未鉴定的细菌。嗜酸乳杆菌CICC6074的数量在冷藏3 d时略有增加,冷藏6 d后有所下降,9 d后消失,此现象表明在冷藏初期鱼片吸附的大量嗜酸乳杆菌CICC6074暂时占据了优势地位,并凭借此数量优势抑制了假单胞菌等腐败细菌的生长和代谢,但CICC6074在冷藏罗非鱼片上生长较慢,最终无法同假单胞菌等腐败菌竞争,导致鱼片腐败。
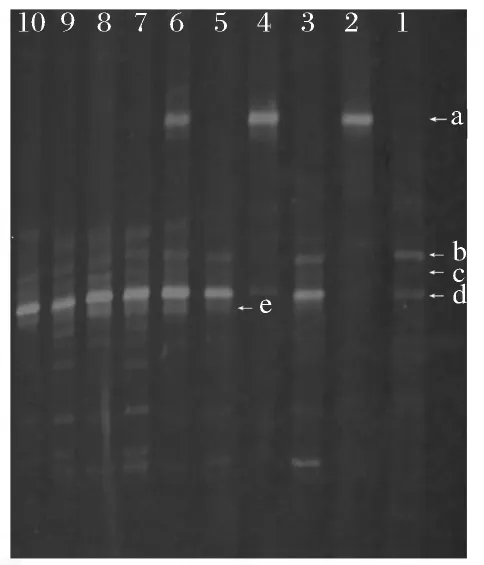
图5 罗非鱼片上细菌16SrDNA的DGGE电泳图Fig.5 DGGE pattern of 16SrDNA of bacteria in tilapia fillets(the lanes were the same as those in Fig 5)

表3 冷藏罗非鱼片中细菌16S rDNA序列DGGE电泳条带的分离鉴定Table 3 Blast results of the 16S rDNA sequences from the DGGE bands of the bacteria in cold stored tilapia fillets
现已确认,假单胞菌为冷藏鱼类的特定腐败菌[16-17],抑制假单胞菌的生长将有效延缓鱼类的腐败速度。本文以嗜酸乳杆菌处理罗非鱼片后显著延缓了假单胞菌等腐败菌的生长,其原因可能包括嗜酸乳杆菌占据了大量生态位,或者产生的某些代谢产物对假单胞菌产生拮抗作用。CICC6074不会大量增殖,从而对鱼片原有感官性状的影响较小,这与感官评定的结果一致;此外,嗜酸乳杆菌为益生菌,对人体无任何毒副作用,不会造成新的食品安全问题。这些说明将嗜酸乳杆菌CICC6074用于罗非鱼片保鲜是可行的。
3 结论
本研究结果显示,以1.5%葡萄糖溶液和嗜酸乳杆菌CICC6074处理罗非鱼片,鱼片的感官性状的基本不变。葡萄糖可以有效降低鱼片 TVBN值;CICC6074可有效抑制假单胞菌等腐败菌的生长,使冷藏罗非鱼片的保质期延长至接近12 d。
[1] Cosansu S,Mol S,Ucok Alakavuk D,et al.Effects of Pediococcus spp.on the quality of vacuum-packed horse mackerel during cold storage[J].Journal of Agricultural Sciences,2011,17:59-66.
[2] Sudalayandi K,Manja.Efficacy of lactic acid bacteria in the reduction of trimethylamine-nitrogen and related spoilage derivatives of fresh Indian mackerel fish chunks[J].African Journal of Biotechnology,2011,10(1):42-47.
[3] Katikou P,Ambrosiadis I G,Koidis P,et al.Effect of Lactobacillus cultures on microbiological,chemical and odour changes during storage of rainbow trout fillets[J].Journal of the Science of Food and Agriculture,2007,87(3):477-484.
[4] Altieri C,Speranza B,Del Nobile M,et al.Suitability of bifidobacteria and thymol as biopreservatives in extending the shelf life of fresh packed plaice fillets[J].Journal of Applied Microbiology,2005,99(6):1 294-1 302.
[5] Nychas G J,Dillon V M,Board R G.Glucose,the key substrate in the microbiological changes occurring in meat and certain meat products[J].Biotechnol Appl Biochem,1988,10(3):203-31.
[6] Stanbridge L H,Davies A R.The microbiology of chillstored meat.In A.Davies and R.Board(ed.).Microbiology of meat and poultry[M].United Kingdom:Blackie Academic & Professional,1998:175-177.
[7] GB/T 5009.44-2003,中华人民共和国国家标准《肉与肉制品卫生标准的分析方法》[S].
[8] LI Z Y,HE L M,WU J,et al.Bacterial community diversity associated with four marine sponges from the South China Sea based on 16S rDNA DGGE fingerprinting[J].Journal Experimental Marine Biological Ecology,2006,329(1):75-85.
[9] Ampe F,Omar N B,Moizan C,et al.Polyphasic study of the spatial distribution of microorganisms in Mexican pozol,a fermented maize dough,demonstrates the need for cultivation-independent methods to investigate traditional fermentations[J].Applied and Environmental Microbiology,1999,65(12):5 464-5 473.
[10] Muyzer G,De Waal E C,Uitterlinden A G.Profiling of complex microbial populations by denaturing gradient gel electrophoreses analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Applied and Environmental Microbiology,1993,59(3):695-700.
[11] Toffin L,Webster G,Weightman A J,et al.Molecular monitoring of culturable bacteria from deep-sea sediment of the Nankai trough,Leg 190 Ocean Drilling Program[J].FEMS Microbiology Ecology,2004,48(3):357-367.
[12] GB 2733-2005,中华人民共和国国家标准《鲜、冻动物性水产品卫生标准》[S].
[13] Koutsoumanis K,Stamatiou A.Development of a microbial model for the combined effect of temperature and pH on spoilage of ground meat,and validation of the model under dynamic temperature conditions[J].Applied and Environmental Microbiology,2006,72(1):124-134.
[14] Lambropoulou K A,Drosinos E H,Nychas G J E.The effect of glucose supplementation on the spoilage microflora and chemical composition of minced beef stored aerobically or under a modified atmosphere at 4℃[J].Int J Food Microbiol,1996,30(3):281-291.
[15] Ndawa D,Faid M,Bouseta A,et al.Effect of controlled lactic acid bacteria fermentation on the microbiological and chemical quality of Moroccan Sardines(Sardina pilchardus)[J].International Journal of Agriculture and Biology,2008,10(1):21-27.
[16] Gram L,Huss H H.Microbiological spoilage of fish and fish products[J].International Journal of Food Microbiology,1996,33:121-137.
[17] Gram L,Dalgaard P.Fish spoilage bacteria-problems and solutions[J].Current Opinion in Biotechnology,2002,13(3):262-266.

