腐胺促进棉花胚性愈伤组织分化的初步研究
戴亚楠,陈晓宇,杨梅,程文翰,王凡龙,朱华国
(石河子大学农学院/新疆生产建设兵团绿洲生态农业重点实验室,石河子 832003)
体细胞胚胎发生是植物研究合子胚生长发育的理想模型,同时也是农杆菌介导的遗传转化技术需要借助的重要过程,一般情况下包括愈伤组织诱导、胚性愈伤组织分化、胚状体分化及植株再生四个过程[1]。棉花是通过体细胞胚胎发生方式获得再生植株困难的物种[2]。目前仅有为数不多的棉花品种(基因型)通过体细胞胚胎发生过程获得了再生植株,限制了棉花的转基因研究和应用[3]。大量研究表明,影响体细胞胚胎发生的因素很多,其中基因型和植物激素是最重要的两个原因[4]。
近年来,多胺作为一种重要的生长调节物质在诸多方面开展了研究。现有研究表明,多胺含量的升高是体细胞胚发生前提[5],且认为植物激素通过多胺介导对体细胞胚胎发生产生影响,其中多胺起到“第二信使”作用[6]。Kumar等[7]研究表明在胚性愈伤组织中Spm、Spd的含量均明显高于非胚性愈伤组织,程文翰等[5]发现在棉花胚状体形成期亚精胺和精胺含量显著上升,保持高比例的 Put/(Spd+Spm)有利于胚性细胞的产生[7-13]。此外,外源添加多胺能够促进云杉的体细胞胚胎发生[14],而多胺在棉花组织培养上的应用尚未见报道。
胚性愈伤组织的分化是棉花体细胞胚胎发生的关键环节之一,本研究通过对不同体细胞胚胎发生能力的棉花品种进行多胺和多胺抑制剂处理,观察多胺对棉花组织培养过程中胚性愈伤组织分化的影响,以期为改良棉花转基因技术提供一定参考。
1 材料与方法
1.1 植物材料
不同体细胞胚胎发生能力的4个陆地棉品种豫早1号(Y1)、新彩棉 7号(C7)、新陆早 33号(L33)和新陆早36号(L36)为本实验供试品种,其体细胞胚胎发生能力由强至弱,由石河子大学棉花研究所提供。
1.2 方法
1.2.1 棉花组织培养
种子去壳后,用0.1%的升汞消毒10 min,无菌水清洗3-5次;接种于无菌苗培养基 (1/2 MS大量元素+15 g/L葡萄糖+6.5 g/L琼脂粉),28℃暗培养5-6 d备用。将无菌苗下胚轴切为0.5-0.7 cm的小段,接种于愈伤组织诱导培养基(MSB附加0.1 mg/L 2,4-D+0.1 mg/L KT)。4周后,继代于生长素减半的胚性愈伤组织诱导培养基上。
1.2.2 多胺和多胺抑制剂处理
胚性愈伤组织诱导培养基(MSB附加0.05 mg/L 2,4-D+0.1 mg/L KT),设为 3 种处理,分别为CK、附加1 mmol/L的腐胺Put和1 mmol/L的多胺抑制剂D-Arg,6周后继代至胚性愈伤诱导培养基(MSB 附加 0.05 mg/L 2,4-D+0.1 mg/L KT),并统计3种处理条件下愈伤组织的日增重量;继代培养4周后,统计胚性愈伤组织分化率。
胚性愈伤组织分化率(%)=每个品种每个处理中分化胚性愈伤组织的下胚轴数目/每个品种每个处理中接种的下胚轴数目,每个品种每个处理接种28个下胚轴,3次重复。
1.2.3 多胺含量测定
准确称取棉花愈伤组织0.4-1.0 g(定量);将称取好的材料放入预冷的研钵,加入5 mL预冷的5%高氯酸冰浴研磨(分 3次加入:2、2、1 m L),将研磨液转移至离心管,涡旋2 min;冰浴浸提1-1.5 h;浸提液4 ℃、12000 r/min离心20 min;取500μL上清液,加入7μL苯甲酰氯、1 mL的2 mol/L NaOH,涡旋30 s,37℃水浴反应25 min;在反应液中加入2 mL饱和NaCl、2 mL乙醚,涡旋1 min后5000 r/min离心5 min;收集1 mL离心后的乙醚相于1.5 mL离心管中,真空抽滤40 min;加入100μL甲醇震荡5 min,静置溶解1 h;8000 r/min离心1.5 min,收集至安培瓶,加甲醇定容至500μL,待HPLC检测。
色谱柱选择Waters C18反相柱,流动相为甲醇:水(60∶40 v/v),流速 1 mL/min,进样量 10 μL,检测温度30℃,检测波长为254 nm,保留时间为20 min。外标法计算,峰面积使用Empower 2数据处理软件处理。
2 结果与分析
2.1 多胺对愈伤组织增殖的影响
结果见图1和2。
(1)不同体细胞胚胎发生能力品种的愈伤组织状态不同,其中发生能力最强的Y1表现为棕色稀泥状的愈伤状态,且其愈伤组织增殖缓慢,然而随着体细胞胚胎发生能力的下降,愈伤组织增殖加快(图1)。
(2)多胺抑制剂和腐胺处理后,愈伤组织形态发生明显变化。多胺抑制剂D-Arg可以显著抑制愈伤组织增殖,4个品种都表现出严重的褐化(图1),愈伤组织的日增重均少于对照(图2),仅为对照的16.78%-50.97%。除了 Y1外,附加腐胺(Put)可以不同程度地促进愈伤组织的增殖,最多可以增加10.57%。
(3)附加腐胺对愈伤组织的形态影响较大,愈伤组织多表现有利于胚性愈伤组织分化的稀泥状(图 1)。

图1 不处理条件下的愈伤组织状态Fig.1 Calli states in different treatments
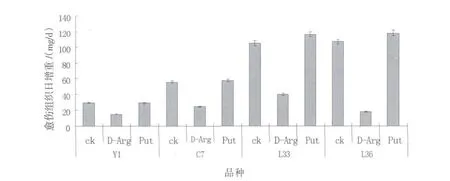
图2 不同处理条件下愈伤组织日增重Fig.2 Growth speed of calli in different treatments
2.2 多胺对胚性愈伤组织分化的影响
经多胺抑制剂D-Arg和Put处理6周后继代于胚性愈伤诱导培养基上,培养4周后统计胚性愈伤组织分化率。对照处理条件下,C7的胚性愈伤组织分化率最高,其次是Y1和L36,L33的胚性愈伤组织分化率最低。多胺抑制剂D-Arg处理后,L33和L36均未见胚性愈伤组织分化(图3),C7的胚性愈伤组织分化率仅为对照的49.38%,Y1的胚性愈伤组织分化率则为对照的324%,但胚性愈伤组织分化量少,推测Y1在D-Arg处理前胚性细胞团已经存在。Put处理后,所有品种的胚性愈伤组织分化率均表现为提高,其中Y1和L33两个品种表现最为突出,Put处理后胚性愈伤组织分化率提高了3倍多。
上述结果表明,对于Y1、C7和 L33而言,腐胺可以显著促进棉花胚性愈伤组织的分化,可以考虑在愈伤组织形成后通过添加腐胺促进棉花胚性愈伤组织分化。
[2] 武秀明,刘传亮,张朝军,等.棉花体细胞胚胎发生的研究进展[J].植物学通报,2008,25(4):469-475.Xiuming Wu,Chuanliang Liu,Chaojun Zhang,et al.Progress of somatic embryogenesis incotton[J].Chinese Bulletin of Botany,2008,25(4):469-475.
[3] Jin S X,Zhang X L,Nie Y C,et al.Identification of a novel elite genotype for in vitro culture and genetic transformation of cotton[J].Biologia Plantarum,2006,50(4):519-524.
[4] 王清连,王敏,师海荣.植物激素对棉花体细胞胚胎发生的诱导及调节作用[J].生物技术通讯,2004,15(6):577-579.WANG Qinglian,WANG Min,SHI Hairong,Hormones regulation on cotton somatic embryogenesis[J].Letters Inbiotechnology,2004,15(6):577-579.
[5] 程文翰,朱华国,李鹏飞,等.棉花多胺 HPLC的测定方法优化及其在体细胞胚胎发生过程中的变化规律[J].棉花学报,2014,26(2):138-144.Cheng Wenhan,Zhu Huaguo,Li Pengfei,et al.Method optimization of polyamine content by high-performance liquid chromatography and its changes in the process of somatic embryogenesis in cotton[J].Cotton Science,2014,26(2):138-144.
[6] 刘春艳,吴强盛.多胺在植物生长发育中的作用[J].生物学教学,2010(10):4-6.Liu Chunyan,Wu Qiangsheng.Role of polyamines in plant growth and development[J].Biology Teaching,2010(10):4-6.
[7] Kumar V,Giridhar P,Chandrashekar A,et al.Polyamines influence morphogenesis and caffeine biosynthesis in vitro cultures of Coffea canephora P.ex Fr[J].Acta Physiol Plant,2008,30(2):217-223.
[8] Nabha S,Lamblin F,Gillet F,et al.Polyamine content and somatic embryogenesis in Papaver somniferum cells transformed with sam-1 gene[J].Journal of Plant Physiol,1999,154(S 5/6):729-734.
[9] Niemi K,Sarjala T,Chen X,et al.Spermidine and methylglyoxalbis(guanylhydrazone)affectmaturation and endogenous polyamine content of Scots pine embryogenic cultures[J].Journal of Plant Physiol,2002,159(10):1155-1158.
[10] Yadav J S,Rajam M V.Temporal regulation of somatic embryogenesis by adjusting cellular polyamine content in eggplant[J].Plant Physiol,1998,11(6):617-625.
[11]Shoeb F,Yadav J S,Bajaj S,et al.Polyamines as biomarkers for plant regeneration capacity:improvement of regeneration by modulation of polyamine metabolism in different genotypes of indica rice[J].Plant Sci,2001,160(6):1229-1235.
[12]黄学林,李筱菊.乙烯与多胺的生物合成与植物体细胞胚胎发生[J].植物生理学通讯,1995,31(2):81-85.Huang Xuelin,Li Xiaoju.The relations of biosynthesis of ethylene and polyamines to somatic embryogenesis of plants[J].Plant Physiology Communications,1995,31(2):81-85.
[13] 张建伟,王军辉,马建伟.粗枝云杉胚性愈伤组织增殖后期的体细胞胚发生方式转变[J].植物生理学报,2014,50(2):197-202.ZHANG Jianwei,WANG Junhui,MA Jianwei.The way chanange of somatic embryogenesis at the late stage of embryogenic callus proliferation of picea asperata mast[J].Plant Physiology Journal,2014,50(2):197-202
[14] 李官德,肖娟丽,罗晓丽,等.不同棉花愈伤组织状态与胚胎发生及其植株再生的关系[J].山西农业科学,2006,34(1):29-31.LI Guan-de,XIAO Juan-li,LUO Xiao-li,et al.Somatic embryogenesis and plant regeneration of calli derived from cotton(Gossypium hirsutum L.)depending on their quality[J].Jouranl of Shanxi Agricultural Sciences,2006,34(1):29-31.

