超声法提取新疆废弃番茄茎叶中鞣质的工艺
刘飞 ,陈晴晴 ,李炳奇 ,杨金凤 ,刘红
(1石河子大学化学化工学院,石河子 832003;2石河子大学理学院,石河子 832003)
新疆具有种植番茄得天独厚的气候条件,新疆番茄酱由于质地优良,已被国内外公认为优良的原料产品。新疆番茄年加工量约占全国总产量的90%,成为亚洲地区最大的番茄生产加工和出口基地[1]。而番茄加工过程中,产生的大量番茄茎、叶,目前尚未被种植户或番茄加工生产企业利用,一般均作为农业废弃物处理,这不仅污染环境,而且造成这一资源的极大浪费。
废弃番茄茎叶具有重要的开发利用价值[2],其提取物中主要含有番茄碱和鞣质等活性成分[3-4],其中鞣质在茎叶中的含量为5%左右[5]。鞣质又称鞣酸,是一类复杂的高分子多酚类化合物[6-8],具有抗感染止血及收敛作用、抗菌、抗病毒和抗龋作用[9],能清除生物体内过剩的自由基,维护细胞膜的流动和蛋白质的构象,防止辐射诱发的DNA断裂,从而在抑制脂质过氧化、心血管病、抗癌、抗突变、抗衰老、抗白内障等方面有独到功效[10-11]。
鞣质类化合物的研究与分离提取技术进展迅速[12],已引起了越来越多科研领域的关注,以药理作用为先导的成分分离逐步展开,新发现的化合物数目不断增多,且有很多已被证明其药理作用,随着分离手段的不断提高及药理研究的不断深入[13-18],鞣质及多酚类成分将会有更加广阔的发展前景。
国内外对于废弃番茄茎叶中相关化合物的研究却很少,本试验以废弃的番茄茎叶为研究对象,对其提取方法进行优化,得到最优的提取条件,为进一步研究废弃番茄茎叶中鞣质类物质提供了理论依据。
1 材料与方法
1.1 试验材料、试剂与仪器
材料:废弃番茄茎叶,采自新疆石河子市143团场番茄种植园。
试剂:没食子酸 (中国药品生物制品检定所)、95%乙醇(A.R)、福林酚(北京奥博星生物科技有限公司)、碳酸钠(分析纯)。
仪器:LD隆达HF-2.5B超声提循环取机;722G可见分光光度计,上海仪电分析仪器有限公司生产;飞鸽牌台式离心机,上海安亭科学仪器厂生产;BüchiRotavapor旋转蒸发器,瑞士BüchiLabotechnikAG生产;HJ-4型多头磁力搅拌器,金坛市恒丰仪器厂生产;BS210电子分析天平,德国Sartorius公司生产。
1.2 试验方法
1.2.1 供试样品的制备
采集新疆废弃番茄茎叶,用清水洗净,在通风处自然晾干,用粉碎机打碎,过30目筛,混匀,备用。
1.2.2 番茄茎叶鞣质的含量测定
番茄茎叶鞣质含量采用可见分光光度法[5]:以没食子酸作为对照品,在波长760 nm处测定其吸光度,经计算得回归方程A=0.0831c+0.0805,R2=0.9997。
通过测定样品溶液的吸光度计算溶液中鞣质的含量。
1.2.3 番茄茎叶中鞣质类化合物超声提取的单因素实验
1.2.3.1 乙醇浓度对提取效果的影响
精密称取干燥恒重的粉碎的番茄茎叶(30目)5份,质量均为 200.00 g,分别用 10%、30%、50%、70%、90%的乙醇提取,在室温下固液比为1∶20,超声提取2次,每次20 min,合并提取液,然后抽滤,定容,测定鞣质的吸光度值,并计算其含量。
1.2.3.2 固液比对提取效果的影响
称取粉碎的番茄茎叶(30目)5份,质量均为200.00 g,固液比分别为 1∶15、1∶20、1∶25、1∶30、1∶35,在室温下用50%的乙醇超声提取2次,每次20 min,合并提取液,然后抽滤,定容,测定鞣质的吸光度值,并计算其含量。
1.2.3.3 超声时间对提取效果的影响
称取粉碎的番茄茎叶(30目)5份,质量均为200.00 g,在室温下用50%的乙醇超声提取,超声时间为:20、30、40、50、60 min,提取液抽滤,定容,测定鞣质的吸光度值,并计算其含量。
1.2.3.4 超声次数对提取效果的影响
称取粉碎的番茄茎叶(30目)5份,质量均为200.00 g,分别提取 1、2、3、4、5 次,固液比为 1∶20,每次 20 min,在室温下,用 50%的乙醇超声提取,提取液抽滤,定容,测定鞣质的吸光度值,并计算其含量。
1.2.4 番茄茎叶中鞣质类化合物超声提取的正交设计实验
根据单因素实验所优化的条件设计正交实验,进一步优化对提取效果影响较大的乙醇浓度(A)、超声时间(B)、固液比(C)、超声次数(D)4个因素,每个因素取3个水平,用L9(34)进行正交实验设计,优选出最佳提取工艺条件。
2 结果与讨论
2.1 番茄茎叶中鞣质的提取单因素试验
2.1.1 乙醇浓度对鞣质提取率的影响
结果如图1所示。由图1可知:番茄茎叶中鞣质的提取率随着乙醇浓度的增大而增加,而当浓度大于50%时鞣质提取率开始下降。因此乙醇浓度在50%左右时鞣质提取率最高,故选取乙醇浓度为30%、50%、70%进行正交试验。

图1 乙醇浓度对鞣质提取效果的影响Fig.1 The effect of ethanol concentration on the extraction of tannin
2.1.2 固液比对鞣质提取率的影响
结果如图2所示。由图2可知:在一定范围内,随着固液比的增加,鞣质提取率增大,而当固液比大于1∶30时,鞣质提取率几乎不再提高。故选取1∶25、1∶30、1∶35 进行正交实验。
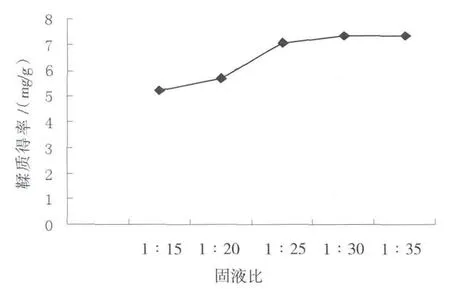
图2 固液比对鞣质提取效果的影响Fig.2 The effect of solid-liquid ratios on the extraction of tannin
2.1.3 超声时间的对鞣质提取率的影响
结果如图3所示。由图3可知:随着提取时间的加长,提取率的增幅不断增加,但是当超声时间超过50 min后,鞣质提取率有所下降。因此选择40、50、60 min进行正交试验。
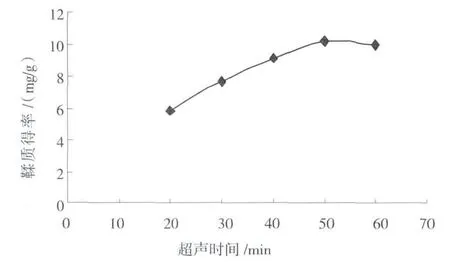
图3 超声时间对鞣质提取效果的影响Fig.3 The effect of extraction time on extraction of tannin
2.1.4 超声次数对鞣质提取率的影响
结果如图4所示。由图4可知,随着超声次数的增加,鞣质含量逐渐趋于平缓。考虑鞣质的提取时间过长易于分解,影响鞣质的提取率,故选择提取2、3、4次进行正交试验。
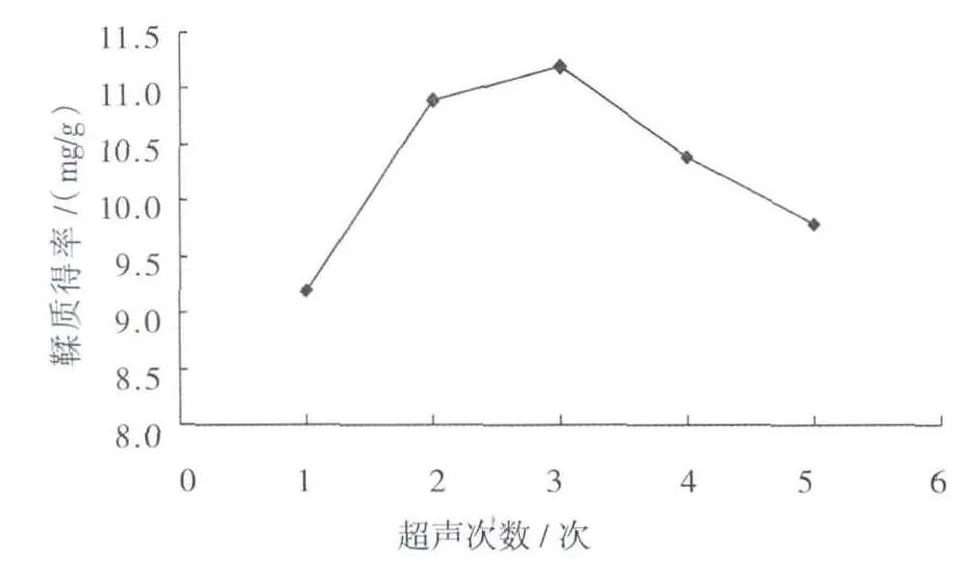
图4 超声次数对鞣质提取效果的影响Fig.4 The effect of extraction times on extraction of tannin
2.2 正交试验
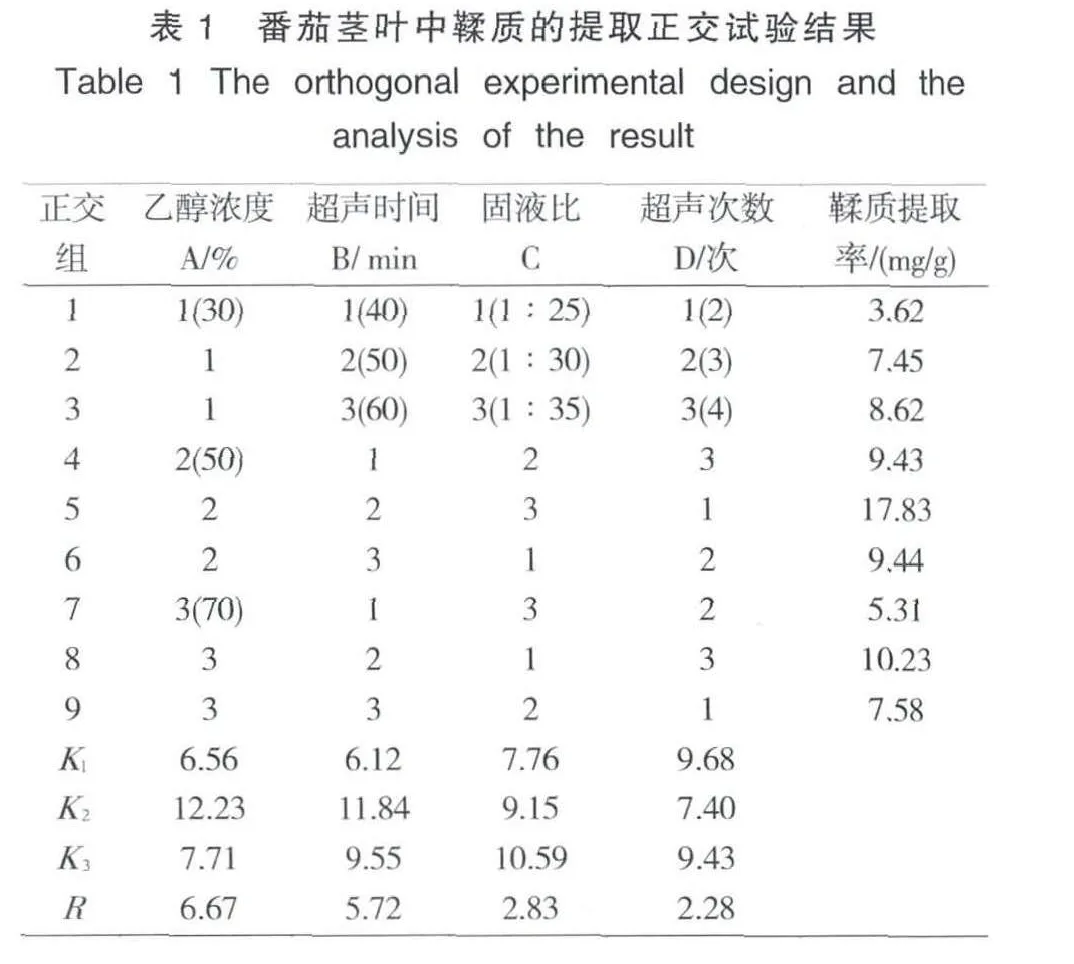
在单因素试验结果的基础上,以鞣质的提取率为考察指标,设计L9(34)正交试验,试验结果见表1。
从表1可知,超声法提取新疆番茄废弃茎叶中鞣质的最佳工艺条件为A2B2C3D1,即乙醇浓度50%,每次超声50 min,料液比1∶35,超声提取2次。
极差分析结果表明,番茄茎叶中鞣质的提取提取率的影响程度大小依次为:A(乙醇浓度)>B(超声时间)>C(固液比)> D(超声次数)。
3 结论
(1)乙醇浓度及超声时间是影响废弃番茄茎叶鞣质的提取率的主要因素,确定了其番茄茎叶鞣质最佳的提取工艺为35倍50%乙醇超声提取2次,每次 50 min。
(2)该工艺简单可行,且省时、高效、节能,可用于番茄废弃茎叶中鞣质成分的提取,为进一步研究番茄废弃茎叶中鞣质类物质提供了理论依据,并增加了新疆番茄资源利用率。
[1] 陈兵.中国新疆番茄产业发展现状分析[J].新疆财经大学学报,2011(3):16-20.CHEN Bing.An Analysis on Current Statuts of Tomato Industry in Xinjiang[J].Journal of Xinjiang Finance and Economics University,2011(3):16-20.
[2] Pinggulkar K,Kamat A,Bongirwar D,Microbiologcal quality of fresh leafy vegetables,salad components and readytoeat salads:an evidence of inhibition of Listeria monocytogenes in tomatoes[J].Food Sci Nutr,2001,52:15-23.
[3] 李建光,张露.番茄碱的分离纯化和抑菌活性的研究[J].新疆医科大学学报,2014,37(9):1151-1154.LI Jianguang,ZHANG Lu.Study on separation purification and antibacterial activity of of tomatine[J].Journal of Xinjiang Medical University,2014,37(9):1151-1154.
[4] 王瑞斌,薛成虎.国内鞣质生理活性研究进展[J].榆林学院学报,2010,20(2):47.WANG Ruibin,XUE Chenghu.Progress in Studies on Physiological Activities of Tannins in China[J].Journal of YuLin University,2010,20(2):47.
[5] 王添敏,孙晓丽,彭雪,等.胡桃楸的根、茎枝、叶和果皮中总鞣质的含量测定[J].中国中药杂志,2011,36(1):32.WANG Tianmin,SUN Xiaoli,PENG Xue,et al.Determination of Total Tannins in the Roots,Branches,Leaves and Pericarps of Juglansm and Shuric[J].China Journal of Chinese Materia Medica,2011,36(1):32.
[6] Vallverdu-queralt,A Arranz,S Medina-remon,A.Changes in phenolic content of tomato products during storage[J].Journal of Agriculture.2011,59(17):9358-9365.
[7] Cama M,Hisil Y.Pressurised water extraction of polyphenols from pomegranate peels[J].Food Chem,2010,123(3):878-885.
[8] 杨从军,孟昭礼,郭景,等.番茄茎叶提取物对8种植物病原菌的生物活性初步研究[J].植物保护,2005,31(1):28-31.YANG Congjun,MENG Zhaoli,GUO Jing,et al.A Preliminary Study on Fungistasis of the Extracts from Tomato Stems and Leaves[J].Plant Protection,2005,31(1):28-31.
[9] 周本宏,周静,梁艺小,等.石榴皮鞣质对肾纤维化大鼠内源性代谢物的影响 [J].中国医院药学杂志,2014,34(23):2009-2013.ZHOU Benhong,ZHOU Jing,et al.Effects of Tannins in Pomegranate on Endogenous Metabolites in Rats with Renal Fibrosis[J].Chinese Journal of Hospital Pharmacy,2014,34(23):2009-2013.
[10] 郭晓萍,尹苗,陈希文,等.石榴皮鞣质的提取及体外抑菌活性[J].江苏农业科学,2011,39(3):403-405.GUO Xiaoping,YIN Miao,et al.Extraction and Antibacterial Activity of Pomegranate Tannins[J].Jiangsu Agricultural Sciences,2011,39(3):403-405.
[11]Haase K,Wantzen K M.Analysis and decomposition of condensedtannins in tree leaves[J].Environ Chem Lett,2008,6(2):71-75.
[12] 邢晶晶,曹婷婷,杨帆,等.鞣质类化合物研究的进展情况[J].黑龙江医药,2011,24(5):776-780.XING Jinjin,CAO Tingting,et al.Advances in the Research on Compound Tannins[J].Heilongjiang Medicine Journal,2011,24(5):776-780.
[13] 吴玲芳.藏药余甘子鞣质部位体内成分分析[D].北京:北京中医药大学,2014.
[14] Naczk M,Shahidi F.Extraction and analysis of phenolics in food[J].Chromatogr A,2004,1054(1/2):95-111.
[15] 刘刚,孙磊,乔善义.鞣质的分离和分析方法研究进展[J].国际药学研究杂志,2013,40(2):172-176,202.LIU Gong,SONG Lei,QIAO Shanyi.Research Progress in Separation and Analysis Method of Tannin[J].Journal of International Pharmaceutical Research,2013,40(2):172-176,202.
[16] 樊珍珍,热娜·卡斯木,王晓梅,等.正交试验优选罗布麻叶中总鞣质提取工艺[J].中国实验方剂学杂志,2013,19(7):13-16.GONG Zhenzhen,et al.Extraction Process of Total Tannin of Apocynum Venetum Optimized by Orthogonal Test[J].Chinese Journal of Experimental Traditional Medical Formulae,2013,19(7):13-16.
[17] 郑明昱,郑玲玲,温丽颖.老鹳草鞣质超声循环提取工艺研究[J].中国实验方剂学杂志,2010,16(12):7.ZHEN Minyu,ZHEN Linlin,WEN Linyin.Study on Ultrasonic Extraction Circulation Technologies of Herba Geranium Tannins[J].Chinese Journal of Experimental Traditional Medical Formulae,2010,16(12):7.
[18] 秦亮,郭延生,胡俊杰,等.正交试验法优选甘肃沙枣总鞣质的最佳提取工艺[J].湖北农业科学,2010,49(6):1447-1449.QIN Liang,GUO Yansheng,HU Junjie.Optimized Extraction Process by Orthogonal Test of Total Tannin of Elaeagnus Angustifolia in Gansu[J].Hubei Agricultural Sciences,2010,49(6):1447-1449.

