含胺功能化碳纳米管的壳聚糖/β-甘油磷酸钠水凝胶膜的制备及性能评价
李佳,苏珊珊,张雅,方贺,陈文
(石河子大学药学院,石河子 832002)
近年来,随着基因工程的发展,蛋白质多肽类药物已实现大规模生产,因其不良反应少,易吸收等优点,广泛应用于临床。但该类药物易降解、变性、半衰期短、生物利用度低[1],常制备成冻干粉末制剂,用于注射给药,并需要多次给药,给患者带来了很大的痛苦。因此开展蛋白质多肽类药物缓释系统的研究具有重要意义。
Chenite等[2]首先报道了壳聚糖/β-甘油磷酸钠(chitosan/β-glycerophosphate,CS/β-GP) 可注射中性温敏凝胶体系,该体系在室温下呈液态,生理温度下凝胶。由于其具有良好的生物相容性,低的免疫原性,抗菌性及细胞亲和性,已广泛应用于组织工程[3-5]及蛋白质类药物传递系统[6-7]。近年来,有学者研究了CS/β-GP凝胶系统成膜后作为生物医用材料的可能性,表明该水凝胶膜生物相容性好,蛋白吸附能力强,但其力学性能较差,药物释放速度快[8-9],因此不能很好地满足临床需要。
多壁碳纳米管(multi-walled carbon nanotubes,MWCNTs)具有独特的力学性能、导电性及热稳定性,但不能很好的溶于水和有机溶剂中,易团聚。研究表明,将聚酰胺 -胺(polyamidoamine dendrimers,PAMAMA)接枝到MMWCNTs上得到的胺功能化碳纳米管具有分散性好、蛋白吸附能力强及细胞毒性低等优点[10-12]。本研究利用CS/β-GP水凝胶体系在37℃发生相变的特性,采用溶剂蒸发法[13]制备CS/β-GP水凝胶膜,利用MWCNTs-PAMAM复合物,增强CS/β-GP膜的机械强度,减慢其释药速率,从而构建一种新型缓释蛋白类药物的材料。
1 材料与方法
1.1 材料
VXC130型细胞破碎仪(美国SONICS公司);8400S型傅立叶红外光谱仪(日本岛津公司);SU8010型高分辨场发射扫描电镜(日本电子公司);ALPHA 1-2LD PLUS型真空冷冻干燥机(德国Christ公司);PHS-3C型精密pH计(上海精密科学仪器有限公司);INSTRON3366型拉力机(美国英斯特朗公司);DSA100型接触角仪(德国Kruss公司);Thermo3001型多功能酶标仪(美国Thermo公司);聚四氟乙烯模具(4×4 cm,济南岱罡生物工程有限公司);7301型测厚规(日本三丰精密仪器有限公司)。CS(Chitosan,分子量:100000-300000,批号:20120503,成都市科龙化工试剂厂);β-GP(β-glycerophosphate,纯度>97%,上海源叶生物科技有限公司);羧基化多壁碳纳米管(MWCNTs-COOH,直径 20-40 nm,长度<5 μm,纯度>97%,深圳纳米港科技有限公司);G 3.0PAMAM(美国 Sigma公司);1-乙基 -(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCL,北京索莱宝生物科技有限公司);N-羟基琥珀酰亚胺(NHS,北京索莱宝生物科技有限公司);BSA(Bovine Serum Albumin,纯度>98%,Sigma);BCA蛋白浓度试剂盒(Protein Assay Kit,批号:PC0020,北京索莱宝生物科技有限公司)。
1.2 方法
1.2.1 MWCNTs-PAMAM 复合物的制备[10]
称取EDC和NHS各100.0 mg,加入100.0 mL于细胞破碎仪中分散好的0.1 mg/mLMWCNTs-COOH水溶液中,超声 15 min,静置反应 2 h,13000 r/min离心15 min,蒸馏水清洗3-4次。离心后的产物重新分散于蒸馏水中,缓慢滴加适量PAMAM乙醇溶液,超声15 min,避光反应2 h,所得混合液离心分离,纯水透析72 h,双蒸水清洗 3-4次,55℃烘干备用,由热重分析得知MWCNTs-PAMAM复合物中PAMAM的接枝率为6.7%。
1.2.2 水凝胶膜的制备
称取CS 60.0 mg,加入5.0 mL 0.8%的冰乙酸,磁力搅拌 2 h。取 0.9 gβ-GP,溶于1.0 mL去离子水,逐滴加入到CS溶液中,搅拌 30.0 min,加入一定质量的MWCNTs-PAMAM复合物水溶液,搅拌均匀,静置2 h脱泡,测定pH,将混合液注入聚四氟乙烯模具中,水平置入37℃恒温培养箱中,干燥24 h成膜。同时制备空白膜(不加MWCNTs-PAM AM)。用测厚规测定各组膜的厚度。
含BSA复合膜的制备:将10.0 mgBSA溶于500 μL去离子水中,缓慢加入到上述含有MWCNTs-PA MAM的CS/β-GP溶液中,搅拌过夜,静置2 h脱泡,注入聚四氟乙烯模具中,水平置入37℃恒温培养箱中,干燥24 h,制得含0.625 mg/cm2BSA的载药膜。以不加MWCNTs-PAMAM含相同质量BSA的CS/β-GP膜为对照。
1.2.3 SEM表征
将膜于液氮中脆断,冷冻干燥后载于导电胶布上,喷金,SEM观察复合膜的断面及表面形貌。
1.2.4 FTIR表征
将膜干燥后研磨成粉末,进行溴化钾压片,测试分辨率 2 cm-1,扫描范围 4000-400 cm-1,同时采集纯CS、β-GP和MWCNTs-PAMAM 粉末的红外图谱作对照。
1.2.5 溶胀度测定
将膜裁成 1×1 cm大小,37℃干燥至恒重(W0),置于离心管中,加入10 mLpH7.4的PBS溶液,24 h后,擦去表面水分称重(W),计算溶胀比(Rs)。
Rs=[(W-W0)/W0]×100%。
1.2.6 力学性能测试
将膜裁成10×40 mm的长条,测定厚度。室温下采用万能电子试验机测量力学性能,有效长度为20 mm,拉伸速度设定为10 mm/min。
1.2.7 接触角测试
将膜裁成10×40 mm的长条,37℃干燥至恒重,固定于样品台上,蒸馏水作为测试液体,室温下测量液滴刚接触到膜表面的接触角。
1.2.8 降解性能考察
将膜裁成1×1 cm大小,37℃干燥至恒重(W0),置于离心管中,加入10 mLpH7.4的PBS溶液,于恒温水浴摇床中,37℃低速震荡(振荡频率60.0 r/min,振幅24.0 mm),一定时间取出,37℃干燥至恒重(W),计算失重率(WL),绘制时间 -失重率曲线。
WL=[(W0-W)/W0]×100%。
1.2.9 体外释放BSA试验及释药动力学方程拟合
将含有BSA的载药膜裁成1×1 cm大小,置于离心管中,加入10 mL pH 7.4的PBS溶液,于恒温水浴摇床中,37℃低速震荡(振荡频率60.0 r/min,振幅24.0 mm),每隔一段时间取出1 mL释放液,4℃保存,同时补充同温的1 mLPBS,用BCA试剂盒测定释放液中的蛋白浓度,计算BSA累积释放度,绘制释放时间-累积释放度曲线。
累积释放度=(BSA释放量/复合膜中BSA总量)×100%。
以含 0.5 mg/cm2MWCNTs-PAMAM的 CS/β-GP膜为例,应用Origin8.0软件将释放结果用常见的释放动力学模型进行拟合,寻找描述药物释放的最佳模型,初步探讨该复合膜的释药机制。
2 结果与分析
2.1 SEM表征
CS/β-GP膜与 MWCNTs-PAMAM/CS/β-GP膜的SEM表征(图 1),CS/β-GP 膜断面图(图 1a)显示出该膜具有较疏松的结构,但由于CS/β-GP溶液在挥干成膜后,CS分子与β-GP分子间的疏水作用变小或者消失,使得膜的网架结构出现了一定程度的塌陷,CS/β-GP膜的表面图(图1b)表明该膜表面较为光滑。MWCNTs-PAMAM/CS/β-GP膜断面结构(图 1c)较CS/β-GP膜致密,未见明显团聚体,MWCNTs-PA MAM/CS/β-GP膜表面(图 1d)较 CS/β-GP膜明显粗糙。

图1 CS/β-GP膜与 MWCNTs-PAMAM/CS/β-GP膜的SEM图Fig.1 SEMimages of CS/β-GP film and MWCNTs-PAMAM/CS/β-GP film
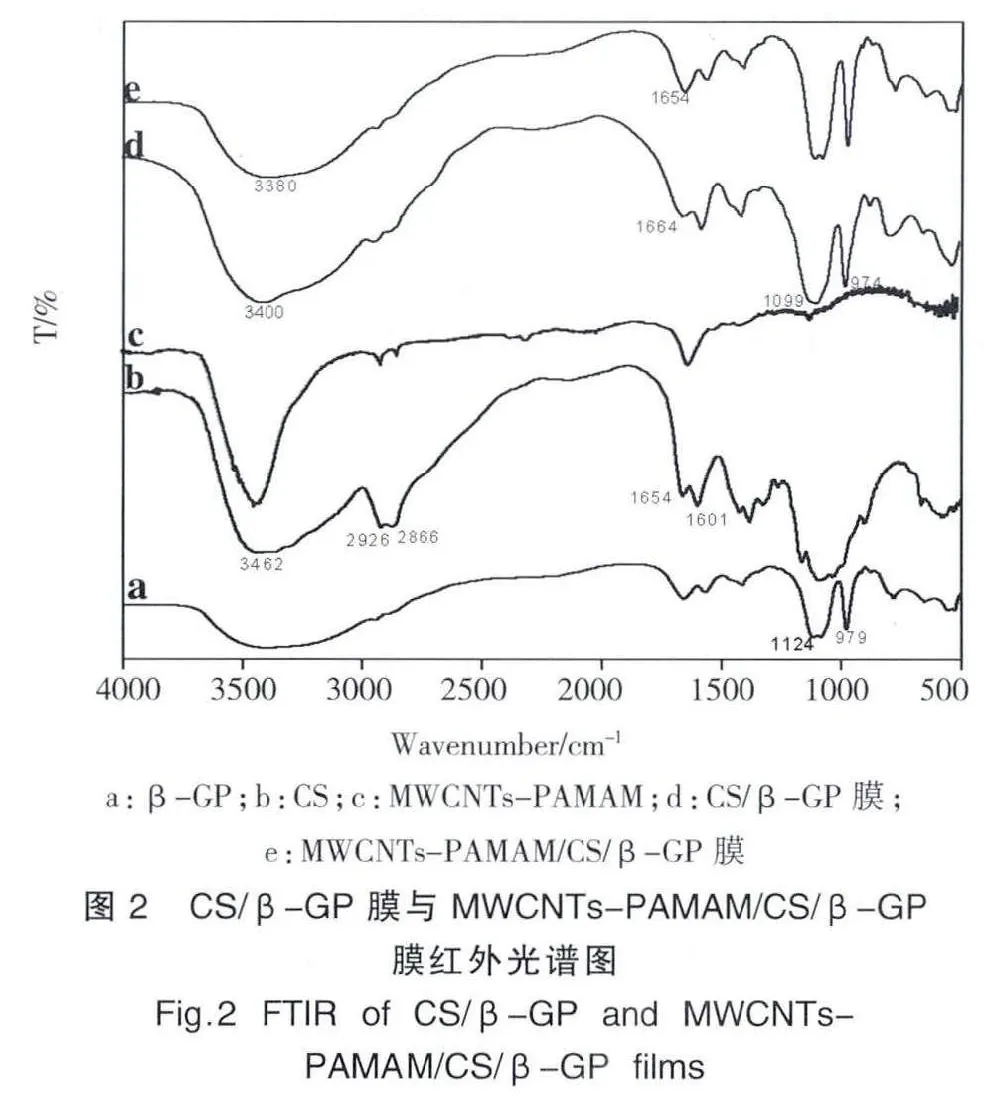
2.2 FTIR表征
膜的FTIR表征(图2),CS/β-GP膜的红外图谱中(图2 d),CS原位于3462 cm-1的羟基(-OH)与氨基(-NH2)重叠振动吸收峰发生了红移变为3400 cm-1,峰形变得平缓,说明重叠的CS的N-H基与β-GP的O-H基结合形成氢键作用。CS的-NH2位于1654 cm-1和1601 cm-1处的I,II的特征峰也发生了红移,暗示-NH2与磷酸根 (PO43-)之间形成离子键。同时无机相PO43-位于900-1200 cm-1处的伸缩振动吸收峰仍存在,说明体系中β-GP只起到中和H+作用。此外,CS的C-H位于2866-2926 cm-1处的对称吸收峰减弱,表明C-H与O-H基之间发生了静电作用。
MWCNTs-PAMAM/CS/β-GP复合膜的红外图谱(图2e)中含有CS/β-GP复合膜和MWCNTs-PAMAM复合物的特征吸收峰,与CS/β-GP膜红外光谱比较可知,位于3400 cm-1和1664 cm-1处的吸收峰随着MWCNTs-PAMAM的加入向低频方向移动,表明-NH2与加入的MWCNTs-PAMAM复合物形成了氢键,推测MWCNTs-PAMAM复合物可以影响膜的网络结构。
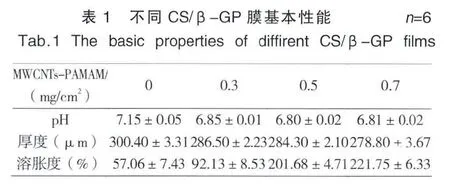
2.3 膜的基本性能
CS/β-GP溶液pH为7.15左右,接近生理pH,随着MWCNTs-PAMAM的加入,pH无明显变化,近中性的pH值可以保证蛋白质类药物活性不被破坏(表 1)。
干燥成膜后,含有MWCNTs-PAMAM水凝胶膜厚度较单纯CS/β-GP膜厚度有所下降,这是由于MWCNTs-PAMAM的加入导致复合膜三维网络结构变得结实密集,使得厚度下降,与SEM结果一致。CS/β-GP膜溶胀度仅为50%左右,加入MWCNTs-P AMAM后,溶胀度增大2~4倍,由于加入MWCNTs-PAMAM后,氢键作用增强,有助于增大膜的溶胀度,并且随着 MWCNTs-PAMAM参杂量的增加,溶胀度呈现升高的趋势。
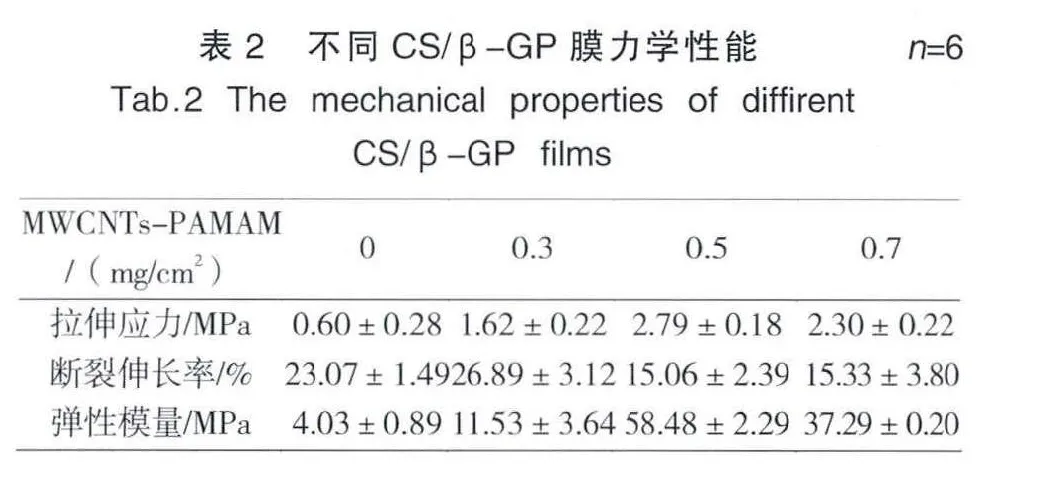
2.4 力学性能测试
膜的力学性能随MWCNTs-PAMAM掺杂量的变化(表2)。加入MWCNTs-PAMAM后,拉伸应力较CS/β-GP膜提高了2~3倍,但随着MWCNTs-PAMAM掺杂量的增加,拉伸应力并没有持续增加,当MWCNTPAMAM的掺杂量为0.7 mg/cm2时,增加量下降,由于MWCNTs长径比大,掺杂量大时,易团聚,受到外力作用易造成应力集中使膜断裂,使得拉伸应力下降。MWCNTs是一种高刚度的材料,因此,掺杂MWCNTs-PAMAM后,膜的弹性模量提高了2-14倍,但加入量为0.7 mg/cm2时,增加有所下降,由于在网状结构中,更多的MWCNTs团聚,使得复合膜弹性模量下降。相对于刚性作用,碳纳米管对复合膜的断裂伸长率贡献不大。
2.5 接触角测试
膜的接触角随MWCNTs-PAMAM掺杂量的变化(图3)。接触角小于90°即表明该材料亲水,因此CS/β-GP 膜(图 a1,a2)及 MWCNTs-PAMAM/CS/β-GP膜 (图 b1-d2)均具有一定的亲水性,由于CS及β-GP中均含有含氧官能团,有利于膜的亲水性,因此CS/β-GP膜具有较好的亲水性,接触角为71.38°±1.07°。当加入MWCNTs-PAMAM后,复合膜的水接触角分别为:63.65°±2.91°,63.15°±3.93°及 61.73°±2.17°,这是由于PAMAM外部具有大量亲水基团,有助于提高膜的亲水性能,因而接触角下降。
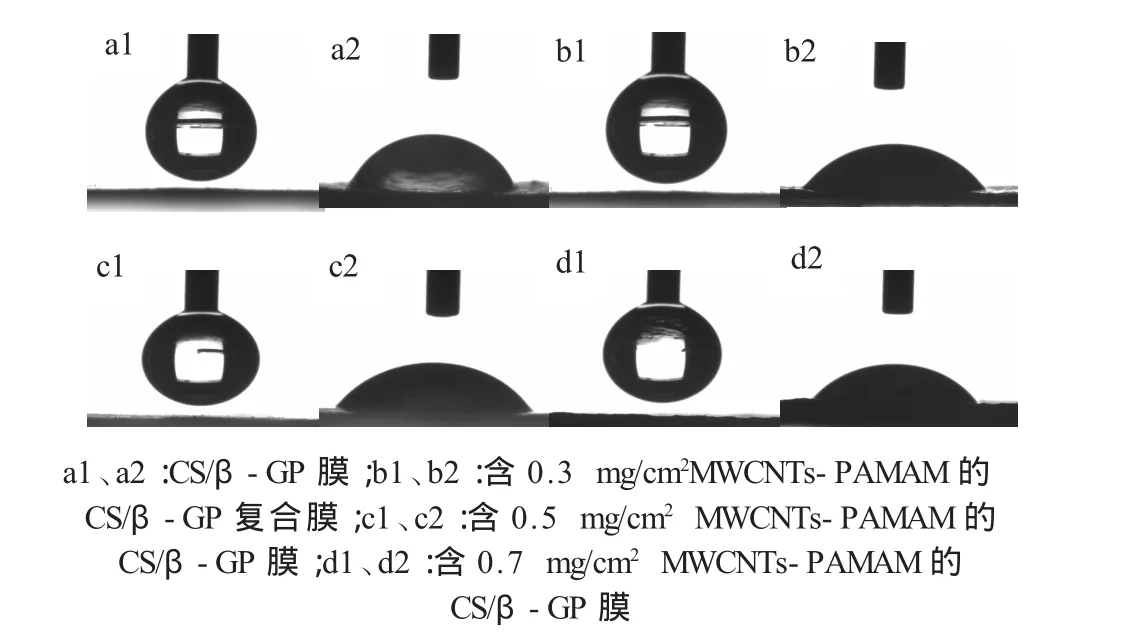
图3 不同CS/β-GP膜接触角测试 n=6 Fig.3 The contact angle test of diffirent CS/β-GP films
2.6 体外降解性能
膜的降解性能随MWCNTs-PAMAM掺杂量的变化(图4)。各组膜1 d内均出现明显失重,CS/β-GP膜失重率达62%,含MWCNTs-PAMAM的CS/β-GP膜达53%-58%,由于在溶剂挥发成膜过程中,大量起中和溶液中 H+作用的β-GP沉积在膜结构中,遇PBS溶解,引起膜的明显失重。第2 d开始,各组失重率均有所减慢逐渐趋于平缓,这是由于交联的CS链及与CS物理键合的β-GP维持膜的结构,在近中性环境中,CS几乎不溶解,因此,膜的失重变慢。20 d内,CS/β-GP膜失重率达 88%,掺杂有MWCNTs-PAMAM的CS/β-GP膜达78%-83%,由于掺杂MWCNTs-PAMAM后,膜结构致密,降解较CS/β-GP膜缓慢,并且MWCNTs-PAMAM掺杂量越高,交联程度越高,降解越慢。
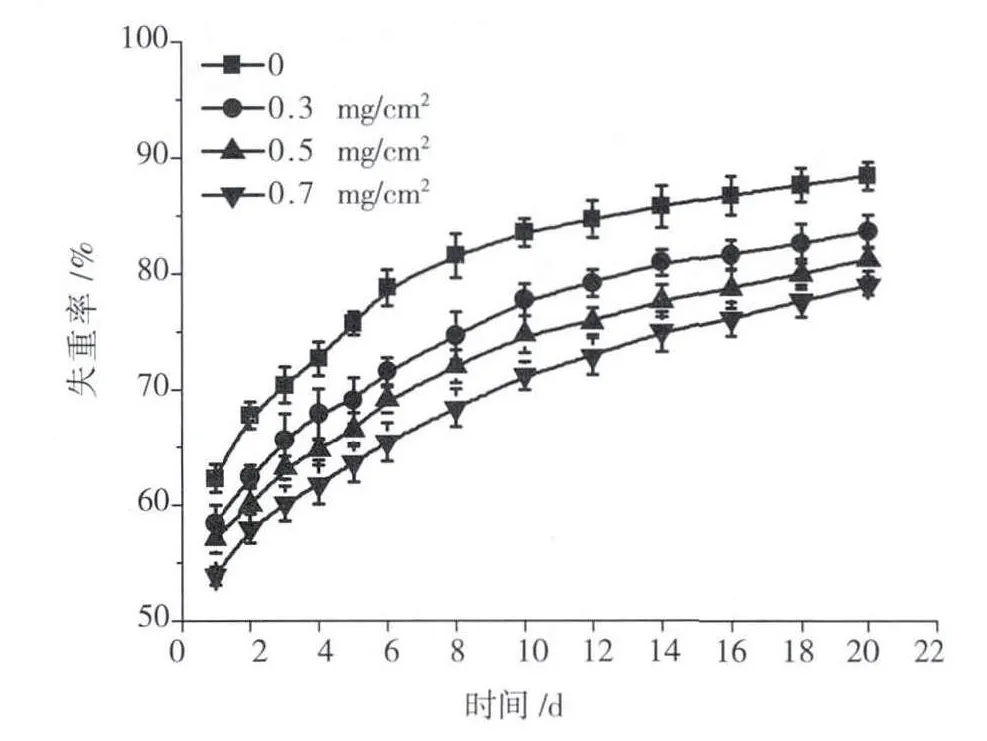
图4 掺杂不同质量MWCNTs-PAMAM的CS/β-GP膜体外降解曲线Fig.4 The degradation curves of CS/β-GP films containing diffirent quality of MWCNTs-PAMAM in vitro
2.7 体外释放BSA曲线
膜体外缓释BSA曲线随MWCNTs-PAMAM掺杂量的变化(图 5)。
各组膜在12 h内释放速率均较快,单纯CS/β-GP膜释放量为32%,含MWCNTs-PAMAM的复 合 膜 释 放 量 为 15%~24%。12~48 h内 含MWCNTs-PAMAM的 CS/β-GP膜释放速率有所减慢,累积释放度为31%~43%,而CS/β-GP膜达到55%,这是由于CS/β-GP膜网络支架中的β-GP溶解,更容易形成孔洞,造成BSA释放速度快。48 h后各组膜释放速率均明显减慢并逐渐趋于平缓,CS/β-GP膜16 d内BSA累积释放度达到 76%,而含MWCNTs-PAMAM的CS/β-GP膜BSA累积释放度为60%~68%,且随着MWCNTs-PAMAM复合物质量的增加,BSA的累积释放度减小。
由于MWCNTs-PAMAM的存在,药物分子不易从网络结构中释放出来,在一定程度上减轻了BSA的突释并减缓了其扩散释放。

图5 掺杂不同质量MWCNTs-PAMAM的CS/β-GP膜累积释放BSA曲线Fig.5 The cumulative released BSA curves of CS/β-GP films containing diffirent quality of MWCN Ts-PAMAM
2.8 释药模型的拟合
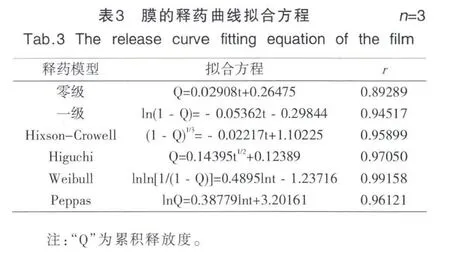
以含0.5 mg/cm2MWCNTs-PAMAM的水凝胶膜为例进行拟合,各模型拟合方程及拟合相似度见表3,其中Weibull方程的相关系数为 0.99158,为最优模型,即该膜以扩散及溶蚀为释药机制。
3 讨论
通过溶剂挥发法成功制备出含MWCNTs-PAMAM复合物的CS/β-GP水凝胶膜。结果表明,掺杂MWCNTs-PAMAM后,形成的膜表面粗糙,内部结构比较致密,这将有助于细胞的粘附和营养物质的交换,为该膜应用于组织工程方面提供了可能。MWCNTs本身具有增加复合材料力学强度的属性,因此掺杂MWCNTs-PAMAM可以显著增强CS/β-GP膜的力学性能。由于MWCNTs-PAMAM的加入填补了CS/β-GP水凝胶网络的孔隙,影响了凝胶结构,从而为药物的缓释提供了结构基础,同时MWCNTs-PAMAM本身具有强的蛋白吸附能力,在释放过程中,BSA不易解析,一定程度上减缓了BSA的释放,该膜的释药机制比较复杂,药物不仅可以从骨架中扩散出来,并且膜骨架本身也在降解。该水凝胶膜制备工艺简单,条件温和,为应用于植入型缓释蛋白质类药物方面提供了可能,本实验后期将进一步研究该材料的细胞毒性及生物相容性。
[1] Agarwal P,Rupenthal ID.Injectable implants for the sustained release of protein and peptide drugs[J].Drug discovery today,2013,18(7-8):337-349.
[2] Chenite A,Buschmann M,Wang D,et al.Novel injectable neutral solutions of chitosan form biodegradable gels in situ[J].Biomaterials,2000,21(21):2155-2161.
[3] Tahrir F G,Ganji F,Ahooyi T M.Injectable thermosensitivebased hydrogels for tissue engineering and drug delivery applications[J].Recent Patents on Drug Deliver,2015,9(2):107-120.
[4] Riva R,Ragelle H,Rieux A,et al.Chitosan and chitosan derivatives in drug delivery and tissue engineering[J].Chitosan for BiomaterialsⅡ,2011,244:19-44.
[5] Zhou H Y,Jiang L J,Cao P P,et al.Glycerophosphatebased chitosan thermosensitive hydrogels and their biomedical applications[J].Carbohydrate Polymers,2015,117:524-536.
[6] Khodaverdi E,Tafaghodi M,Ganji F,et al.In vitro insulin release from thermosensitive chitosan hydrogel[J].American Association of Pharmaceutical Scientists,2012,13(2):460-466.
[7] Kim S,Tsao H,Kang Y,et al.In vitro evaluation of an injectable chitosan gel for sustained local delivery of BMP-2 for osteoblastic differentiation[J].Journal of Biomedical Materials Research Part B,2011,99:380-390.
[8] 梁杰,崔军,许胜,等.新型壳聚糖基引导骨再生膜的蛋白缓释性能研究[J].中国口腔种植学杂志,2014,19(4):164-168.Liang J,Cui J,Xu S,et al.The studies of protein release properties of chitosanbased guided bone regeneration membranes[J].Chinese Journal of Oral Implantology,2014,19(4):164-168.
[9] Qing S Z,Qiu X J,Ke X,et al.Preparation and characteristics of novel porous hydrogel films based on chitosan and glycerophosphate[J].Carbohydrate Polymers,2009,76:410-416.
[10]Pan M F,Kong L J,Liu B,et al.Production of multiwalled carbon nanotube/poly(aminoa-mide)dendrimer hybrid and its application to piezoelectric immunosensing for metolcarb[J].Sensors and Actuators B,2013,188:949-956.
[11]Zhang B L,Chen Q,Tang H,et al.Characterization of and biomolecule immobilization on the biocompatible multiwalled carbon nanotubes generated by functionalization with polyamidoamine dendrimers[J].Colloids and Surface B,2010,80(1):18-25.
[12] 熊庆,任全霞,郭亚可,等.聚酰胺-胺功能化修饰多壁碳纳米管及作为神经生长因子载体的性能[J].中国医院药学杂志,2013,33(13):1023-1028.Xiong Q,Ren Q X,Guo Y K,et al.Function modifications of multiwalled carbon nanotubes with polyamidoamine dendrimer and the properties for nerve growth factor vectors[J].Chinese Journal of Hospital Pharmacy,2013,33(13):1023-1028.
[13]Zhao Q S,Ji Q X,Xing K,et al.Preparation and characteristics of novel porous hydrogel films based on chitosan and glycerophosphate[J].Carbohydrate Polymers,2009,76:410-416.

