IVF-ET 周期中胚胎培养基的氨基酸代谢水平与妊娠结局的相关性研究
谭小方,金华,徐丽,施蔚虹,丁家怡
(江苏省南通市妇幼保健院生殖中心,南通 226006)
体外受精-胚胎移植(IVF-ET)是目前治疗不育症的重要手段。虽然IVF 的受精率达到了60%以上,但临床妊娠率仍相对较低,只有30%~50%[1]。有研究认为,在IVF-ET 技术中评估胚胎活力所使用的形态学评分法的准确性有限,也是造成IVF-ET 低妊娠率和高多胎妊娠率的重要原因之一[2]。然而,有研究认为检测卵裂早期胚胎的氨基酸代谢水平可以提高胚胎活力评估的准确性,并认为受精后第3~5天胚胎氨基酸代谢水平更能反映胚胎活力[3]。本研究通过检测受精后第3天胚胎培养基中氨基酸的水平,探讨其与IVF-ET 妊娠结局的相关性。
资料与方法
一、临床资料
回顾性分析我院生殖中心2012年4月至2014年1月行IVF-ET 助孕的不育夫妇163对。所纳入的病例均在患者同意和我院生殖医学伦理委员会审议批准的前提下,以体外培养的胚胎及培养基为研究对象,检测了胚胎在受精后第3天的氨基酸水平。
纳入对象标准如下:(1)女方年龄≤35岁;(2)平时月经基本规律;(3)首次接受IVF-ET 助孕;(4)HCG 注射日子宫内膜厚度≥8mm;(5)男方精液常规检查基本正常。
排除标准:(1)种植失败1次以上者;(2)患有确诊的多囊卵巢综合征(PCOS)和子宫内膜异位症或子宫腺肌症;(3)促排卵过程中B 超或者子宫输卵管造影(HSG)见明显的输卵管积液或宫腔积液;(4)B超下内膜有明显异常回声光团。
共收集了163 个胚胎的卵裂液培养基检测结果。根据移植胚胎是否妊娠分成2组:A 组为移植妊娠组,共81例,年龄在25~34岁之间;B 组为移植未妊娠组,共86例,年龄在24~35岁之间。
二、患者治疗回顾
1.IVF-ET:采用常规长方案超促排卵,即对两组患者均使用促性腺激素释放激素激动剂(GnRHa,达菲林,博福-益普生,法国)进行垂体降调节,垂体降调节14d左右达到降调标准后使用促性腺激素(Gn)促排卵,并记录Gn用量;阴道超声检查监测卵泡发育情况,当有2个卵泡平均直径≥18mm 或3个卵泡平均直径≥17 mm 时,当晚肌注HCG 5 000~10 000U,36h后在阴道超声引导下取卵。卵母细胞经ECM 卵裂培养液(Sage,美国)洗涤后行常规IVF 或卵胞浆内单精子注射(ICSI)受精。取卵后72h(D3)后行胚胎移植,移植后给予黄体酮40mg/d(河南益康制药)肌注+地屈孕酮20mg bid口服行黄体支持。
2.胚胎形态学评分:采用Scott评分法对原核期评分;参照文献对卵裂期胚胎评分和分级(Gardner评分法)[1]:D3优质胚胎是指6~10细胞I级或8细胞Ⅱ级的胚胎。
3.妊娠结局判断:胚胎移植后第14 天,晨尿HCG 或血HCG 检验,阳性者为生化妊娠;移植后第4周,B超检查见孕囊者为临床妊娠。
4.培养液中氨基酸水平检测:在胚胎移植当日收集培养基163份,并将样本于-80 ℃长期保存;检测前在室温下解冻后进行高效液相色谱法(HPLC)检测培养基中20种游离氨基酸水平。
三、观察指标
D3胚胎培养液中20种游离氨基酸水平;两组患者年龄、降调天数、血清FSH 水平、不孕症时间、体重指数(BMI)、Gn给药时黄体生成素(LH)水平、Gn起始量、Gn天数、HCG 注射日的孕激素水平及子宫内膜厚度、获卵数、移植胚胎数、受精率、卵裂率、取卵后黄体酮用量等资料。
四、统计学方法
所有数据采用SPSS 19.0统计学软件进行统计分析。计量资料以(±s)表示,组间比较采用t检验;计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
结 果
一、两组患者一般情况比较
两组患者在年龄、基础FSH、BMI、不孕年限、持续降调时间等16项指标中,仅两组的Gn起始量差异有统计学意义(P<0.05),其他均无统计学差异(P 均>0.05)(表1)。
未妊娠组患者的年龄为(31.26±3.68)岁,略高于妊娠组患者的年龄(30.97±4.23)岁,未妊娠组患者在BMI、不孕时间、降调时间、Gn 起始量、Gn 天数、HCG 日雌激素水平、取卵数、取卵后黄体酮用量上要略高于妊娠组,但均无统计学差异(P>0.05)(表1)。
二、妊娠组与未妊娠组培养基中氨基酸水平比较
采用HPLC法对妊娠组和未妊娠组培养基中20种氨基酸水平进行分析,并取空白培养基作为对照。结果显示,妊娠组和未妊娠组中天冬氨酸、甘氨酸、谷氨酸、谷氨酰胺、丙氨酸水平均高于空白对照组(P<0.05),而丙氨酸-谷氨酰胺水平均低于空白对照组(P<0.05);妊娠组中天冬氨酸、谷氨酰胺和丙氨酸低于未妊娠组(P<0.05),但丙氨酸-谷氨酰胺水平高于未妊娠组(P<0.05)(表2)。
表1 两组患者一般情况比较(±s)
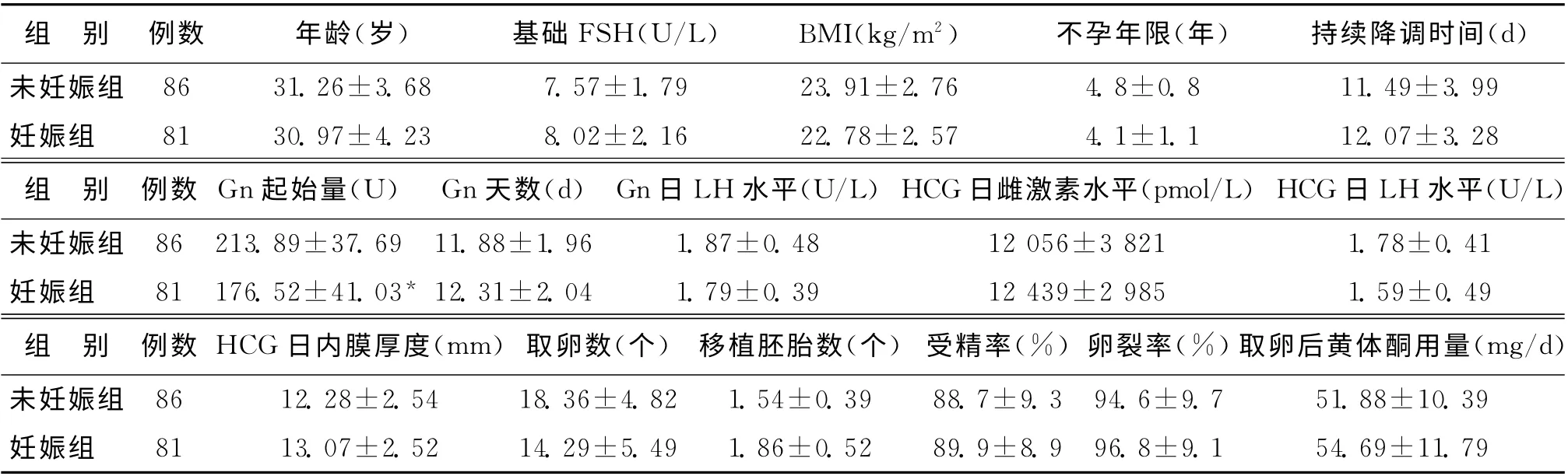
表1 两组患者一般情况比较(±s)
注:与未妊娠组比较,*P<0.05
组 别 例数 年龄(岁) 基础FSH(U/L) BMI(kg/m2) 不孕年限(年) 持续降调时间(d)未妊娠组 86 31.26±3.68 7.57±1.79 23.91±2.76 4.8±0.8 11.49±3.99妊娠组 81 30.97±4.23 8.02±2.16 22.78±2.57 4.1±1.1 12.07±3.2组 别 例数 Gn起始量(U) Gn天数(d) Gn日LH 水平(U/L)HCG日雌激素水平(pmol/L)HCG日LH 水平未妊娠组 86 213.89±37.69 11.88±1.96 1.87±0.48 12 056±3 821 1.78±0.4妊娠组 81 176.52±41.03* 12.31±2.04 1.79±0.39 12 439±2 985 1.59±0.4组 别 例数 HCG 日内膜厚度(mm)取卵数(个) 移植胚胎数(个) 受精率(%)卵裂率(%)取卵后黄体酮用量未妊娠组 86 12.28±2.54 18.36±4.82 1.54±0.39 88.7±9.3 94.6±9.7 51.88±10.39妊娠组 81 13.07±2.52 14.29±5.49 1.86±0.52 89.9±8.9 96.8±9.1 54.69±11.79
表2 二十种游离氨基酸在不同组胚胎培养液的表达水平(μmol/ml,±s)
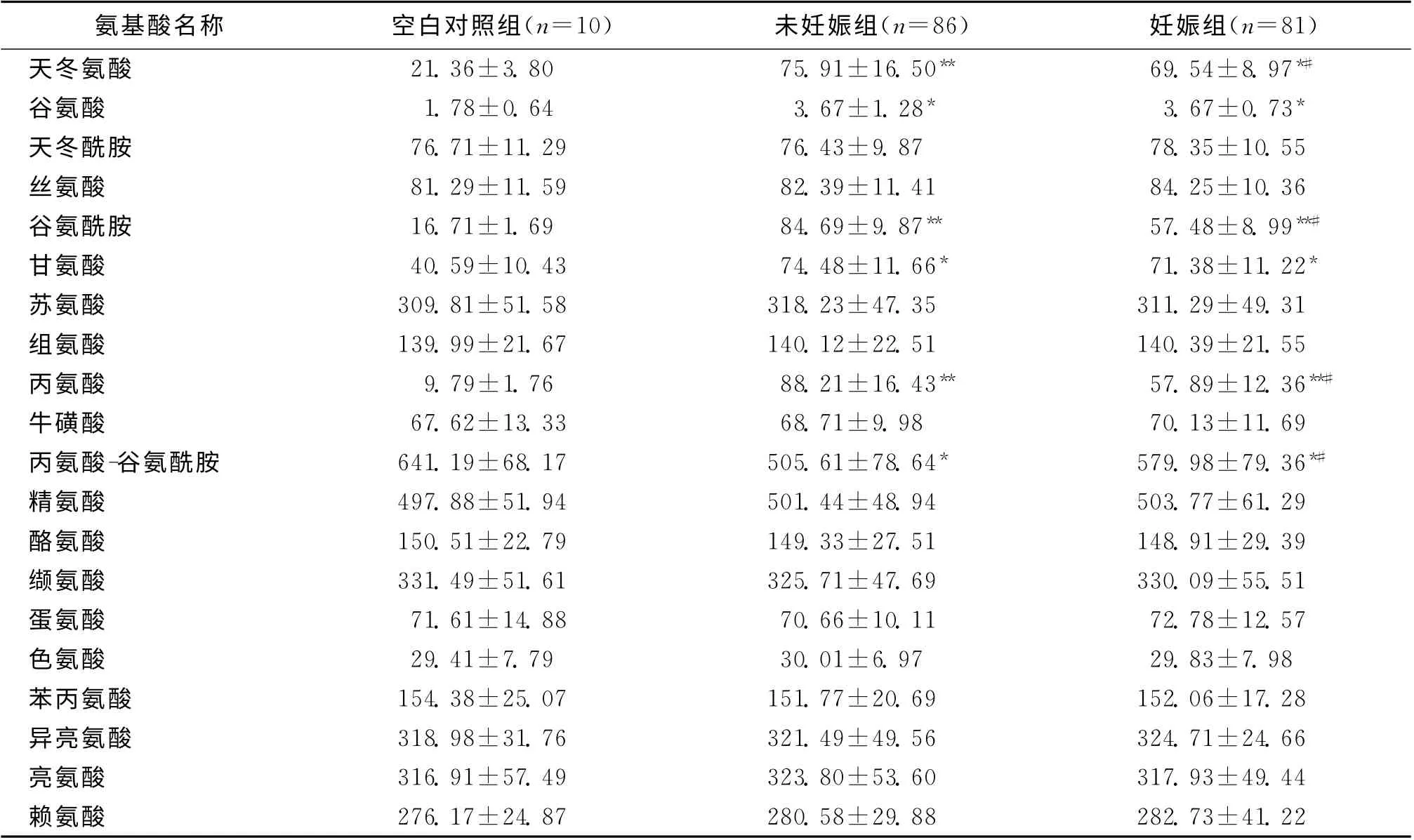
表2 二十种游离氨基酸在不同组胚胎培养液的表达水平(μmol/ml,±s)
注:与空白对组相比,*P<0.05,**P<0.01;与未妊娠组相比,#P<0.05
氨基酸名称 空白对照组(n=10) 未妊娠组(n=86) 妊娠组(n=81)天冬氨酸 21.36±3.80 75.91±16.50** 69.54±8.97*#谷氨酸 1.78±0.64 3.67±1.28* 3.67±0.73*天冬酰胺 76.71±11.29 76.43±9.87 78.35±10.55丝氨酸 81.29±11.59 82.39±11.41 84.25±10.36谷氨酰胺 16.71±1.69 84.69±9.87** 57.48±8.99**#甘氨酸 40.59±10.43 74.48±11.66* 71.38±11.22*苏氨酸 309.81±51.58 318.23±47.35 311.29±49.31组氨酸 139.99±21.67 140.12±22.51 140.39±21.55丙氨酸 9.79±1.76 88.21±16.43** 57.89±12.36**#牛磺酸 67.62±13.33 68.71±9.98 70.13±11.69丙氨酸-谷氨酰胺 641.19±68.17 505.61±78.64* 579.98±79.36*#精氨酸 497.88±51.94 501.44±48.94 503.77±61.29酪氨酸 150.51±22.79 149.33±27.51 148.91±29.39缬氨酸 331.49±51.61 325.71±47.69 330.09±55.51蛋氨酸 71.61±14.88 70.66±10.11 72.78±12.57色氨酸 29.41±7.79 30.01±6.97 29.83±7.98苯丙氨酸 154.38±25.07 151.77±20.69 152.06±17.28异亮氨酸 318.98±31.76 321.49±49.56 324.71±24.66亮氨酸 316.91±57.49 323.80±53.60 317.93±49.44赖氨酸276.17±24.87 280.58±29.88 282.73±41.22
三、Logestic回归分析培养基中氨基酸水平与IVF-ET 妊娠结局的关系
在单因素非条件Logistic回归分析培养基中氨基酸水平与IVF-ET 妊娠结局的关系发现,谷氨酰胺、丙氨酸和丙氨酸-谷氨酰胺与妊娠结局呈负相关性(表3);多因素Logistic回归分析中以IVF-ET 妊娠结局为因变量,以谷氨酰胺、丙氨酸为自变量进行相关性分析,结果发现,在取卵数和移植胚胎数校正后,谷氨酰胺、丙氨酸与妊娠结局仍然呈负相关性(表4)。

表3 单因素非条件Logistic回归分析培养基中氨基酸水平与IVF-ET 妊娠结局的关系
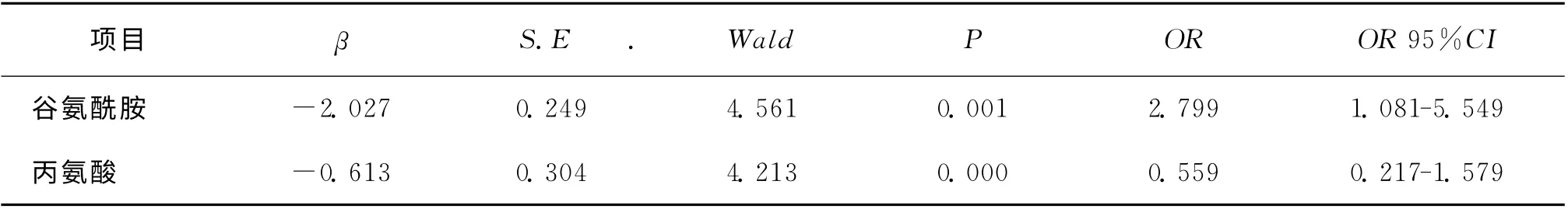
表4 多因素非条件Logistic回归分析培养基中氨基酸水平与IVF-ET 妊娠结局的关系
讨 论
人类辅助生殖技术(ART)对于临床不孕不育的治疗无疑是20世纪伟大的成就之一。研究报道显示,采用IVF-ET 妊娠率达到30%~50%左右。影响胚胎种植的因素是多方面的,而胚胎的质量是影响胚胎种植的最关键因素之一[4-6]。
氨基酸在卵母细胞成熟及早期胚胎中发挥重要的作用[7],参加一系列重要的生理过程。胚胎蛋白质合成与20种氨基酸有关。其中,谷氨酸通过氨基转移酶转化为谷氨酰胺,然后分解成α-酮戊二酸并通过柠檬酸循环形成三磷酸腺苷(ATP);谷氨酰胺还具有其他的功能包括为再次合成嘌呤和嘧啶提供碳源和氮源,作为还原剂来保护细胞免受氧化应激损伤,调节糖代谢;天冬氨酸通过苹果酸穿梭机制参与代谢调节,在乳酸代谢中发挥着重要的作用;精氨酸在一氧化氮合酶的作用下合成一氧化氮,从而参与胚胎的多种信号转导途径[8]。有研究显示,受精后2~3d内在形成完整胚胎与未形成完整胚胎的培养液中部分氨基酸有着显著差异[9];也有研究显示部分氨基酸对于IVF-ET 妊娠结局有着重要影响[10],氨基酸的种类以及含量在胚胎的染色体正常配对与异常配对、非整数倍染色体细胞中存在明显差异,此外线粒体的活性与部分氨基酸的水平呈正相关。
本研究显示,妊娠组和未妊娠组中天冬氨酸、谷氨酸、谷氨酰胺、丙氨酸水平均高于空白对照组,而妊娠组天冬氨酸、谷氨酰胺和丙氨酸水平与未妊娠组有显著性差异(P<0.05),这一结果同以往的研究报道基本一致。在邓彬等[3]的研究中,未妊娠组与妊娠组存在差异的主要为谷氨酰胺、丙氨酸,而本研究显示除了上述两个指标以外,天冬氨酸水平两组也显示出有统计学差异。但本研究所收集的观测指标在受精后第3d,比邓彬所收集对象早2d。以往有研究显示受精后1~2d胚胎培养液中天冬氨酸、甘氨酸、亮氨酸与妊娠结局有很大关系[10];也有研究显示,在形成桑椹胚以及早期胚胎形成阶段,培养液中谷氨酰胺起着重要的作用[11]。这些研究结果说明,在胚胎形成早期可能有更多的氨基酸参与其形成和发展。
氨基酸参与胚胎发育的多种重要生理过程,在胚胎发育过程中发挥重要作用,氨基酸代谢水平可在一定程度上反映胚胎的发育潜能。随着胚胎序贯培养基的发展,人们逐渐认识到氨基酸代谢在人类早期胚胎发育过程中具有重要的作用。研究显示,IVF的妊娠结局与胚胎培养基中的甘氨酸、亮氨酸和天冬氨酸的水平变化有关,且氨基酸水平的变化与胚胎的形态学级别、胚胎的种植潜能有关,发现它可以被视为胚胎移植临床妊娠率和活产率的一个独立的预测因子[13-14]。本研究留取受精后第3 天(D3)胚胎培养基进行氨基酸代谢水平的检测,同以往的文献报道[3,10]在时间上略有提前,旨在更早发现在体外受精过程中氨基酸的代谢情况。有研究显示,胚胎从解冻开始的0.5h内氨基酸水平就处于不断的变换当中[15],在受精后尽早检测胚胎培养液中氨基酸的水平,尤其是采集大样本量建立IVFET 早期胚胎培养液中氨基酸可控水平是值得研究的。
虽然科学技术在不断创新和进步,但是临床研究显示,ART 技术在提高妊娠率方面还有诸多问题亟待解决,如社会压力导致妇女将妊娠期推迟,而年龄是影响妊娠和IVF-ET 种植率的主要原因[4,12]。在本研究中,我们也考虑是否上述原因会影响胚胎培养液中氨基酸的水平。本研究发现妊娠组较非妊娠组女方略显年轻,但在Logistic回归显示该因素对妊娠结局无显著影响。另外,未妊娠组较妊娠组的不孕年限略长,Gn用量、HCG 日LH 值也略高,虽然无统计学差异,也可能提示不孕年限的增长会增加IVF-ET 的失败率。但通过Logistic回归分析排除了这类干扰因素,显示氨基酸水平是影响妊娠结果的关键因素,至少在本研究中可以说明这一点。
目前,国内对于IVF-ET 早期胚胎培养液中氨基酸水平变化的研究报道较少,尤其是IVF-ET 早期胚胎发育中氨基酸对胚胎的形成以及妊娠结局的影响及影响机制还有待更多地研究。结合本文结果以及文献报道,我们认为,胚胎早期发育阶段部分氨基酸(谷氨酰胺、丙氨酸)代谢水平的明显变化与妊娠结局有一定的关系,但是氨基酸的水平变化到底影响妊娠哪一环节还有待进一步研究。
[1] Zhu J,Lian Y,Li M,et al.Does IVF cleavage stage embryo quality affect pregnancy complications and neonatal outcomes in singleton gestations after double embryo transfers?[J].J Assist Reprod Genet,2014,31:1635-1641.
[2] Milki AA.Accuracy of day 3criteria for selecting the best embryos[J].Fertil Steril,2002,77:1191-1195.
[3] 邓彬,李予,王文军,等.胚胎培养液氨基酸浓度与体外受精胚胎移植妊娠结局的关系[J].中山大学学报(医学科学版),2013,34:900-905.
[4] 罗燕群,刘风华,易艳红,等.年龄、移植胚胎数量、质量与临床妊娠率的关系[J].生殖医学杂志,2014,23;361-366.
[5] 宋成,万才云,鲍忠剑,等.姐妹胚胎体外囊胚形成能力对体外受精-胚胎移植临床结局的预测作用研究[J].生殖医学杂志,2014,23:367-371.
[6] Hill MJ,Richter KS,Heitmann RJ,et al.Number of supernumerary vitrified blastocysts is positively correlated with implantation and live birth in single-blastocyst embryo transfers[J].Fertil Steril,2013,99:1631-1636.
[7] 黄品秀,李蓉,林洪波,等.抗氧化剂半胱氨酸对小鼠卵母细胞体外成熟及发育潜能的影响[J].生殖医学杂志,2012,21:252-257.
[8] 赵璇,郑慧媛,赵凌宇,等.N-硝基-L-精氨酸对人胚胎神经干细胞增殖的作用[J].陕西医学杂志,2011,40:1581-1584.
[9] Brison DR,Houghton FD,Falconer D,et al.Identification of viable embryos in IVF by non-invasive measurement of amino acid turnover[J].Hum Reprod,2004,19:2319-2324.
[10] Picton HM,Elder K,Houghton FD,et al.Association between amino acid turnover and chromosome aneuploidy during human preimplantation embryo development in vitro[J].Mol Hum Reprod,2010,16:557-569.
[11] Devreker F,Winston RM,Hardy K.Glutamine improves human preimplantation development in vitro[J].Fertil Steril,1998,69:293-299.
[12] 李萍,丁露,沙艳伟,等.影响IVF-ET 妊娠结局的相关因素分析[J].中国妇幼保健,2013,28:2246-2248.
[13] Houghton FD,Hawkhead JA,Humpherson PG,et al.Noninvasive amino acid turnover predicts human embryo developmental capacity [J]. Hum Reprod,2002,17:999-1005.
[14] Stokes PJ,Hawkhead JA,Fawthrop RK,et al.Metabolism of human embryos following cryopreservation:implications for the safety and selection of embryos for transfer in clinical IVF[J].Hum Reprod,2007,22:829-835.
[15] 唐杰,方丛,李婷婷,等.人早期胚胎解冻后氨基酸代谢变化的研究[J].新医学,2011,42:377-382.

