绝经后妇女激素治疗对乳腺密度的影响
石赛珠,梁玉杰,李勐
(浙江省乐清市人民医院,乐清 325600)
围绝经期与绝经后妇女激素治疗(MHT)是治疗围绝经期综合征最为有效的方法,对远期绝经相关疾病的预防和控制也有益处[1-2]。但随着近年来乳腺癌发病率逐渐增加,MHT 对乳腺的影响逐渐引起医生与患者的共同关注。乳腺组织密度增加被认为是乳腺癌发病的独立高危因素[3],乳腺钼靶摄片检查可以判断乳腺组织密度的差异,是目前较为常用的乳腺癌的筛查手段之一。本研究对绝经后妇女给予不同激素治疗方案,通过定期乳腺钼靶摄片检查和随访,比较治疗前后乳腺组织密度的变化情况,探讨不同治疗方案对乳腺组织密度的影响程度。
资料与方法
一、研究对象
选取2012年5月至2013年8月在我院妇科门诊因围绝经期综合征就诊的绝经后妇女96例为研究对象,纳入标准:年龄<60岁,绝经>1年;依据中华医学会妇产科学分会绝经学组2012年发布的“绝经期管理与激素补充治疗临床应用指南”,有MHT指征、无MHT 禁忌症;经阴道超声检查,子宫内膜厚度<5cm;乳腺钼靶检查排除乳腺癌;1年内未进行过MHT 治疗;无严重慢性疾病,无雌激素依赖性肿瘤病史。研究方案经医院伦理委员会通过,受试患者签署知情同意书。
二、分组与治疗
患者按就诊先后顺序,经计算机生成的随机表进行分组。A 组采用戊酸雌二醇片(拜耳,德国)1mg+地屈孕酮(雅培,荷兰)片10 mg,1 次/d;B组给予戊酸雌二醇片1mg+醋酸甲羟孕酮片(浙江仙琚)4mg,1次/d;C 组给予口服替勃龙片(7-甲基异炔诺酮,南京欧加农)2.5 mg,1 次/d。3 组均连续服用药物6个月。
三、观察项目
3组患者治疗前后分别以量表形式进行围绝经期综合征Kupperman评分;患者自行记录服药期间阴道出血或乳房胀痛的发生情况;用药前和药物治疗结束后,分别进行双侧乳腺组织钼靶摄片,根据乳腺影像报告资料系统(BI-RADS)进行乳腺密度评分[4-5]:乳房几乎全部为脂肪组织(腺体成份<25%)记1分;乳房脂肪组织中存在散在的纤维腺组织(腺体成份约25%~50%)记2 分;乳房致密度不均匀或隐约呈现小的团块状(腺体成份约51%~75%)记3分;乳房极度致密,可能使摄片质量敏感性降低(腺体成份>75%)记4分。患者进入研究时记录身高、体重、产次,计算体重指数(BMI);治疗前后分别进行经阴道超声检查。
四、统计方法
使用SPSS 19.0 统计软件行统计分析。Kupperman评分及患者一般情况的数据处理采用χ2检验及t检验,检验水准α=0.05。乳腺密度的数据分析采用非参数秩和检验。P<0.05为差异有统计学意义。
结 果
一、一般情况
本研究共纳入研究对象96例,年龄48~59岁,平均年龄(52.05±3.61)岁,平均绝经时间(2.47±1.29)年。按照随机原则进行分组,其中A 组32例,B组30例,C 组34例。3组患者年龄、BMI、产次、治疗期间阴道流血发生率等均无统计学差异(P>0.05)。治疗前后,各组间经阴道超声测量的子宫内膜厚度无统计学差异(P>0.05)。
二、Kupperman评分情况
A 组治疗前后的Kupperman 评分分别为(17.79±2.11)、(3.03±1.29)分,B 组治疗前后分别为(17.44±2.75)、(3.23±1.82)分,C 组治疗前后分别为(17.19±2.97)、(3.87±2.17)分,3 组患者治疗后的围绝经期症状评分均比治疗前均有明显改善(P<0.01),治疗后3组患者围绝经期症状评分比较,差异无统计学意义(P>0.05)。
三、乳腺钼靶检查评分
3组患者治疗前后的乳腺密度评分比较详见表1。经非参数秩和检验,治疗前3组患者的乳腺密度评分相比较,差异无统计学意义(P>0.05);A 组与C组治疗前、后乳腺密度评分比较亦无统计学差异(P>0.05);B 组治疗后的乳腺密度评分比治疗前增高,差异有统计学意义(P<0.05);治疗后B 组乳腺密度评分高于A 组、C 组,差异有统计学意义(P<0.05)。治疗后A 组乳腺密度评分与C 组比较,无显著性差异(P>0.05)(表1)。
表1 3组患者用药前后乳腺密度评分比较(±s)
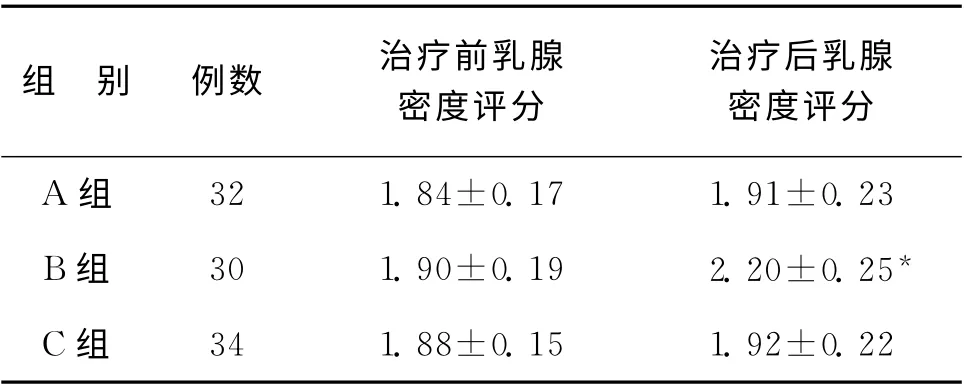
表1 3组患者用药前后乳腺密度评分比较(±s)
注:与治疗前及A、C组治疗后比较,*P<0.05
组 别 例数 治疗前乳腺密度评分治疗后乳腺密度评分A 组32 1.84±0.17 1.91±0.23 B组 30 1.90±0.19 2.20±0.25*C组34 1.88±0.15 1.92±0.22
四、乳腺胀痛发生情况
3组患者治疗后乳腺胀痛的发生率比较,B 组高于A 组与C 组,差异有统计学意义(P<0.05)(表2)。

表2 3组患者药物治疗后乳腺胀痛发生情况比较[n(%)]
讨 论
MHT 能有效缓解妇女围绝经期综合征症状,改善患者生活质量。如在绝经早期即开始治疗,可能对降低绝经后骨质疏松症及心血管疾病等远期并发症的发生率有利[6]。但是雌激素+孕激素的连续联合MHT 方案,可能增加乳腺组织密度及罹患乳腺癌的潜在风险[7-9]。因此,探索不同治疗方案对乳腺密度的影响可能更有利于减少患者的顾虑,有助于临床个体化选择适合长期治疗的药物。
替勃龙(7-甲基异炔诺酮)是一种具有组织特异性的药物。研究表明,替勃龙在体内代谢后,分别产生3α羟基衍生物、3β羟基衍生物和Δ4异构体。前两者对雌激素受体具有亲和力,后者对孕激素和雄激素受体具有亲和力,分布在不同器官,产生组织特异性活性,对绝经后妇女的更年期症状、骨质疏松、认知功能下降、性功能减退等有明显地改善作用。有研究报道称替勃龙与雌孕激素联合方案的不同之处在于,替勃龙的3β羟基衍生物在乳腺组织中对硫酸酯酶具有较强地抑制作用,可有效降低乳腺组织局部的雌二醇水平,故对乳腺的刺激相对较小[10]。本研究结果显示,经替勃龙治疗6个月后,患者的乳腺密度评分无明显改变,乳腺胀痛的发生率亦较低,与上述研究结果一致,提示替勃龙与其它两种联合给药方案比较,在乳腺胀痛发生率及对乳腺组织密度的影响方面具有一定优势。
雌激素+孕激素连续联合治疗是临床MHT 常用的治疗方案。戊酸雌二醇经肝脏代谢后转化为雌二醇;联合使用孕激素主要是为了对抗子宫内膜增生,使子宫内膜萎缩。妇女健康行动(WHI)是一项在美国进行的大规模、多中心、随机对照的临床研究,其研究结果提示,单纯使用雌激素治疗与雌孕激素联合治疗相比,并不增加乳腺癌的发病风险[11-12]。也有研究报道,不同雌孕激素联合治疗对乳腺的影响与孕激素的种类相关[13]。醋酸甲羟孕酮作为一种人工合成的孕激素,对乳腺组织具有一定的刺激作用。已有研究证实使用醋酸甲羟孕酮的激素治疗方案,与乳腺组织密度增加具有相关性[14]。天然孕激素对乳腺组织的影响可能最小。地屈孕酮在肝脏代谢后的转化物与天然黄体酮结构类似,可能具有更安全的应用价值。本研究纳入的研究对象为具有明显围绝经期综合征症状的门诊患者,为了迅速控制症状、方便获得药物,及提高患者依从性等,参照国内之前文献报道[15-16],采用前述的剂量方案进行治疗。在确保辐射剂量安全的前提下,参照国外乳腺密度短期随访的文献[17-18],设置6个月随访期,且为了集中说明问题,对已形成一致观点的子宫内膜厚度及雌孕激素治疗的不良反应不再赘述。研究结果显示,使用地屈孕酮的A 组与使用甲羟孕酮的B 组相比,地屈孕酮对患者乳腺密度的影响相对较小。最近有学者尝试使用低剂量的雌二醇+地屈孕酮方案进行治疗,认为低剂量在控制临床症状方面也可以取得满意效果[19],但尚未有文献对低剂量雌孕激素联合方案对乳腺组织密度的影响及其它潜在的不良反应作出评价。此外,有文献报道,患者停用激素治疗,乳腺组织密度会有所降低[17],因此外源性激素治疗对乳腺组织密度的长期影响及临床意义尚有待进一步探索。
综上所述,3 种不同的MHT 治疗方案均能明显减轻围绝经期综合征症状,其中替勃龙方案及雌激素+地屈孕酮方案对乳腺密度的影响相对较小。因此,建议临床应用MHT 进行围绝经期综合征治疗时要详细把握临床指征,尽量选择天然药物,坚持个体化、最低剂量、定期监测、定期评估的用药原则。
[1] 孙爱军.解读《国际绝经协会(IMS)关于绝经后激素治疗的最新建议》[J].生殖医学杂志,2008,17:294-298.
[2] 刘晓瑷,陈伟珍,金毓翠.围绝经期及绝经后妇女卵泡刺激素、黄体生成素和雌二醇的变化[J].生殖医学杂志,2000,9:300-301.
[3] Boyd NF,Martin LJ,Bronskill M,et al.Breast tissue composition and susceptibility to breast cancer[J].J Natl Cancer Inst,2010,102:1224-1237.
[4] Ooms EA,Zonderland HM,Eijkemans MJ,et al.Mammography:interobserver variability in breast density assessment[J].Breast,2007,16:568-576.
[5] Ciatto S,Houssami N,Apruzzese A,et al.Categorizing breast mammographic density:intra-and interobserver reproducibility of BI-RADS density categories[J].Breast,2005,14:269-275.
[6] de Villiers TJ,Gass ML,Haines CJ,et al.Global consensus statement on menopausal hormone therapy[J].Climacteric,2013,16:203-204.
[7] McTiernan A,Chlebowski RT,Martin C,et al.Conjugated equine estrogen influence on mammographic density in postmenopausal women in a substudy of the women’s health initiative randomized trial[J].J Clin Oncol,2009,27:6135-6143.
[8] McTiernan A,Martin CF,Peck JD,et al.Estrogen-plusprogestin use and mammographic density in postmenopausal women:Women’s Health Initiative randomized trial[J].J Natl Cancer Inst,2005,97:1366-1376.
[9] Chlebowski RT,Hendrix SL,Langer RD,et al.Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women:the Women’s Health Initiative Randomized Trial[J].JAMA,2003,289:3243-3253.
[10] Desreux J,Kloosterboer H,Noël A,et al.Effects of tibolone on sulfatase pathway of estrogens metabolism and on growth of MCF-7human breast tumors implanted in ovariectomized nude mice[J].Gynecol Obstet Invest,2007,63:31-38.
[11] Rossouw JE,Anderson GL,Prentice RL,et al.Risks and benefits of estrogen plus progestin in healthy postmenopausal women:principal results From the Women’s Health Initiative randomized controlled trial[J].JAMA,2002,288:321-333.
[12] Stefanick ML,Anderson GL,Margolis KL,et al.Effects of conjugated equine estrogens on breast cancer and mammography screening in postmenopausal women with hysterectomy[J].JAMA,2006,295:1647-1657.
[13] Cordina-Duverger E,Truong T,Anger A,et al.Risk of breast cancer by type of menopausal hormone therapy:a case-control study among post-menopausal women in France[J].PLoS One,8:e78016.
[14] Lee EJ,Ingles SA,Van Den Berg D,et al.Progestogen levels,progesterone receptor gene polymorphisms,and mammographic density changes: results from the Postmenopausal Estrogen/Progestin Interventions Mammographic Density Study[J].Menopause,2012,19:302-310.
[15] 林琳,万晓慧,丁岩.激素替代疗法对绝经后妇女乳腺的影响[J].新疆医科大学学报,2006,29:724-729.
[16] Kwok S,Charlton-Menys V,Pemberton P,et al.Effects of dydrogesterone and norethisterone,in combination with oestradiol,on lipoproteins and inflammatory markers in postmenopausal women[J].Maturitas,2006,53:439-446.
[17] Lowry SJ,Aiello Bowles EJ,Anderson ML,et al.Predictors of breast density change after hormone therapy cessation:results from a randomized trial[J].Cancer Epidemiol Biomarkers Prev,2011,20:2309-2312.
[18] Eilertsen AL,Karssemeijer N,Skaane P,et al.Differential impact of conventional and low-dose oral hormone therapy,tibolone and raloxifene on mammographic breast density,assessed by an automated quantitative method[J].BJOG,2008,115:773-779.
[19] Stevenson JC,Panay N,Pexman-Fieth C.Oral estradiol and dydrogesterone combination therapy in postmenopausal women:review of efficacy and safety[J].Maturitas,2013,76:10-21.

