天冬氨酸酶的催化特性及应用进展
李 冉,贾振华,宋 聪,张 翔,黄媛媛
(河北省科学院生物研究所,河北 石家庄 050051)
天冬氨酸酶(aspartase,Asp),也称天冬氨酸氨裂合酶(E.C.4.3.1.1),广泛存在于大肠杆菌(Escherichiacoli)、荧光假单胞菌(Pseudomonasfluorescens)、枯草芽孢杆菌(Bacillussubtilis)、芽孢杆菌YM55-1(Bacillussp.YM55-1)等细菌中,在微生物氮代谢中发挥着重要作用[1-8]。天冬氨酸酶也是一种重要的生物催化剂,可用于L-天冬氨酸、β-丙氨酸、L-精氨酸、L-天冬氨酸衍生物的合成[9-11]。本文将围绕天冬氨酸酶的结构、理化性质、催化机理及其在生物催化中的应用综述其研究进展。
1 天冬氨酸酶的结构与理化性质
1.1 天冬氨酸酶的结构
天冬氨酸酶最早被发现于细菌中,大肠杆菌天冬氨酸酶(AspA)蛋白大小约200 kDa,以同源四聚体形式存在,由4个51 kDa的相同亚基组成,每个亚基包含3个结构域,其C-末端由2个螺旋-转角-螺旋模体(helix-turn-helix motif)组成,模体的相对方向约为90°;中心结构域由5个长的α-螺旋组成,占亚单位总残基的一半以上;N-末端结构域由1个短的双链反平行β折叠和5个α-螺旋组成[12,13]。
AspA与芽孢杆菌YM55-1天冬氨酸酶(AspB)、延胡索酸酶C(fumarase C,FumC)、腺苷酸琥珀酸裂解酶(adenylosuccinate lyase,ADL)、精氨酸琥珀酸裂解酶(argininosuccinate lyase,ARL)属于天冬氨酸酶/富马酸酶超家族,均含有三段高度保守的氨基酸序列(XXSXNDXXXT、GXTXXQXAXP、GSSXXPXKXN)(图1),其中一段保守序列(GSSXXPXKXN)所构成的一个特殊的环(SS环),被证明是与底物结合的关键位点和活性中心[14-19]。
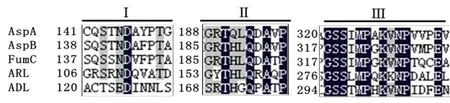
图1 天冬氨酸酶/富马酸酶超家族保守氨基酸序列比对
1.2 天冬氨酸酶的理化性质
大肠杆菌AspA对L-天冬氨酸有很强的底物专一性,需要Mg2+、Mn2+等金属离子作为激活剂,在碱性条件下具有催化活性,在55 ℃和pH8.0条件下酶活性最强,但热稳定性差,在55 ℃条件下30 min会失去酶活性[6,20,21]。中间气单胞菌(Aeromonasmedia)AspA的最适pH为8.0~8.5,最适温暖为35 ℃,在45 ℃以下酶活性稳定,需要Mg2+离子作为激活剂[22]。AspA是细菌在复杂培养基中以及厌氧、酸性和缺铁离子条件下生长所必需的[23]。肠道细菌假结核耶尔森菌(Yersiniapseudotuberculosis)的蛋白质组学和 lacz 融合分析表明,在酸性条件下,其AspA表达量增加,添加天冬氨酸可以提高野生型菌株在酸性环境的存活率,但不能提高敲除AspA 基因的突变体菌株的存活率,表明天冬氨酸酶能够催化天冬氨酸产生氨,来增加菌株在酸性环境中的存活率[24]。
芽孢杆菌YM55-1天冬氨酸酶(AspB)是第一个被发现的具有热稳定性的天冬氨酸酶[4]。AspB在盐酸胍存在下,有更强的热稳定性,在65 ℃和pH8.0的条件下酶活性最强[4]。与大肠杆菌AspA相比,AspB有较高的对映体选择性、广泛的底物特异性,在碱性环境中不需要底物变构和金属离子的激活就具有催化活性,因此,AspB作为氨基酸合成的生物催化剂而备受关注。
2 天冬氨酸酶的催化机理
天冬氨酸酶的催化反应遵循酸碱反应机理如图2所示。酶活性位点的碱性离子首先从底物的C3原子中提取氢离子,形成的碳负离子稳定的中间体,然后中间体崩解后底物的C—N键或C—O键断裂,产生富马酸盐和相应的次级产物。C—N键或C—O键断裂是反应的限速步骤,由酸促进,为离去基团(NH3)提供质子以形成铵离子[25-30]。
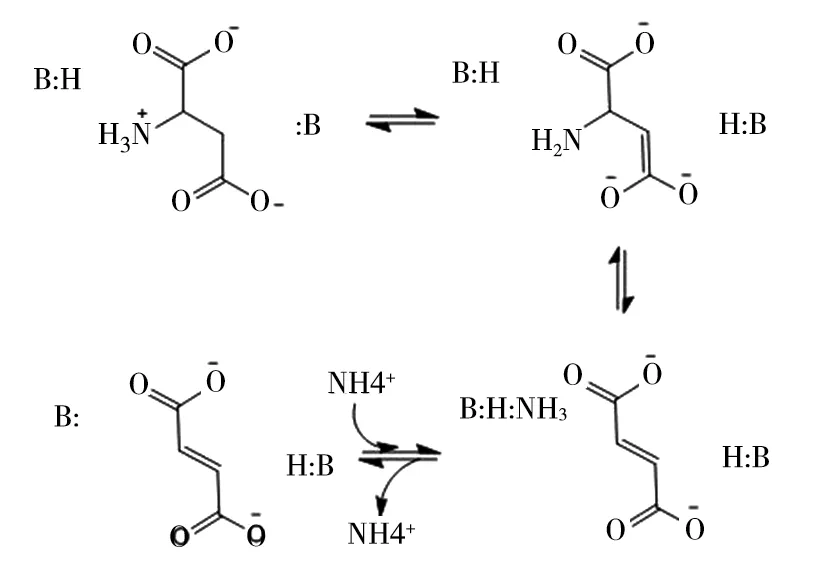
图2 天冬氨酸酶的催化反应机制[28]
动力学研究表明,AspA在碱性pH条件下的脱胺反应表现出非米氏动力学,在反应达到动力学稳态之前有一个停滞期,由此能够推出AspA受到变构活化。在催化反应时,L-天冬氨酸和Mg2+会首先结合到不同于活性位点的单独激活剂结合位点,因此,L-天冬氨酸既作为底物,又作为AspA的激活剂[28]。许多研究涉及定点突变、化学修饰和基于机理的失活来鉴定AspA的重要催化残基,有研究者推测第一个激活剂结合位点位于Cys430附近[16],也有研究者通过比较AspA和富马酸酶的蛋白晶体结构,推测第二个激活剂结合位点可能是位于短螺旋段的Gln129和Asn138[29],但是,至今没有AspA与底物或产物复合物的晶体结构被解析,以确定激活剂结合位点的位置。
AspB酶的催化活性不需要受到变构作用激活,Fibriansah等人[31]成功地解析了AspB与L-天冬氨酸复合物的晶体结构,提供了天冬氨酸酶的底物结合活性位点的第一个详细视图。结果表明,AspB蛋白的Thr101、Ser140、Thr141和Ser319残基与底物的β-羧酸基团之间形成氢键,使底物形成高烯醇化物样(aci-羧酸盐样)构象。同时,SS环的构象也发生变化,由开放构象变为闭合构象,这种构象变化提供了额外的底物结合,并在催化过程中保护底物不受溶剂的影响。SS环的闭合将Ser318靠近C3质子的位置以实现质子提取,将SS环的Ser318突变为Ala318会导致AspB活性完全丧失,表明Ser318对AspB的酶活性至关重要[31]。
3 天冬氨酸酶在生物催化中的应用
3.1 天冬氨酸酶用于合成L-天冬氨酸
L-天冬氨酸是合成人工甜味剂阿斯巴甜的重要起始化合物,也可作为氨解毒剂、肝机能促进剂、疲劳恢复剂等医药品和添加剂用于各种清凉饮料的生产,在医药、食品和化工领域应用广泛。目前已发现多种具有天冬氨酸催化活性的菌株。Yukawa等人[32]在从短杆菌(Brevibacteriumgenus)中筛选到具有天冬氨酸酶活性的突变株,天冬氨酸酶的最适pH和最适温度分别为9.3和54℃,需要Ca2+作为激活剂,在氨水碱性条件下能将10%的富马酸转化为天冬氨酸。Suzuki等人[33]从土壤中分离出一株具有高天冬氨酸酶活性的嗜热脂肪芽孢杆菌(Bacillusstearothermophilus),在65 ℃、pH9.5时能将800 mM富马酸和氨离子转化为L-天冬氨酸,转化效率为85%。Patel等人[34]发现铜绿色假单胞菌(Pseudomonasaeruginosa)中的AspA可将1 M富马酸转化生成0.39 mM L-天冬氨酸。Takahisa等人[35]在嗜冷性希瓦氏藻(Shewanellalivingstonensis)中表达大肠杆菌天冬氨酸酶AspA,在50 ℃处理后可使富马酸转化为L-天冬氨酸而不形成 L-苹果酸,解决了在大肠杆菌中合成L-天冬氨酸会产生副产物L-苹果酸的问题。Liu等人[36]构建了含顺反式异构酶(MaiA)和天冬氨酸酶(AspA)的双酶系统的大肠杆菌工程菌,以顺丁烯二酸为原料合成 L-天冬氨酸的方法,得到 L-天冬氨酸产量为419.8 g/L,转化率为98.4%。
固定化天冬氨酸酶能够提高酶的温度稳定性,具有便于回收、可重复利用等优点,能够有效降低生产成本。1973年,Chibata等人[37]利用聚丙烯酰胺、角叉菜胶将AspA及含有AspA的大肠杆菌菌体制成固定化酶和固定化细胞,提高了连续生产L-天冬氨酸的能力。Sato等人[38]用交叉菜胶固定含AspA的大肠杆菌细胞,与可溶性天冬氨酸酶相比,酶促反应的Km值提高了5倍,最适pH由9.5降为8.5,最适温度提高了5~10 ℃,具有更高的热稳定性。Cárdenas-Fernández等人[39]利用不同材料固定化芽孢杆菌AspB,可重复利用5次,酶活性及转化效率均在90%以上。Ram等人[40]将中间气单胞菌(A.mediaNFB-5)中的AspA在大肠杆菌中过表达,结果表明均质化固定化渗透性重组细胞(566 mg/g 湿细胞)比渗透性重组细胞(154 mg/g 湿细胞)产生更多的 L-天冬氨酸。Takahisa等人[35]利用海藻酸钠固定化嗜冷性希瓦氏藻(S.livingstonensis)可重复使用9次,并且天冬氨酸产率高。
3.2 天冬氨酸酶合成L-天冬氨酸衍生物
L-天冬氨酸衍生物可作为手性中间体用于药物的合成,利用天冬氨酸酶合成L-天冬氨酸衍生物是重要途径,但因天冬氨酸酶有很强底物特异性,对广谱化合物没有活性,因此,通过定向改造天冬氨酸酶扩大其底物催化范围,从而获得种类丰富的天冬氨酸衍生物成为研究的方向。Yumoto等人[41]对AspA进行定点突变,将Lys327突变为Asn327,使AspA能够催化L-天冬氨酸-α-酰胺(β-天冬酰胺)的脱氨基反应,但反应效率很低。Asano等人[42]筛选到一株AspA两位点突变(C462T、A981T)菌株能够催化富马酸单酰胺和氨合成L-天冬氨酸-α-半醛。LI等人[43]利用生物信息学手段将AspB的活性位点突变为Cys187、Ile321、Leu324、Ala326,突变后的菌株能够催化300g/L 巴豆酸完全转化为R-3-氨基丁酸。
在天冬氨酸酶反应中加入亲核试剂也是一种降低其底物特异性,扩大底物催化范围的方法,Emery[44]发现羟胺可以作为一种替代亲核试剂促进AspA的催化反应。Weiner等人[45]在 AspB的催化反应中以羟胺作为亲核试剂,再向富马酸盐中分别加入甲氧基胺、联氨和甲胺,能够分别产生L-羟基天冬氨酸、L-N-甲氧基天冬氨酸、L-2-肼基琥珀酸和L-N-甲基天冬氨酸。在这几种衍生物中,L-羟基天冬氨酸由于稳定性较差不易被分离,L-N-甲氧基天冬氨酸、L-2-肼基琥珀酸和L-N-甲基天冬氨酸均很稳定且易于分离[45]。
3.3 天冬氨酸酶合成β-丙氨酸
β-丙氨酸是一种重要的中间体,在食品、饲料添加剂、医药、高分子材料等领域有着广泛的应用,以L-天冬氨酸酶和L-天冬氨酸脱羧酶为关键酶合成β-丙氨酸的研究较多。高宇等人[46]利用大肠杆菌AspA和谷氨酸棒杆菌(Corynebacteriumglutamicum)α-脱羧酶panD,以富马酸和氨水为底物合成β-丙氨酸(9.8 g/L)。Qian等人[47]将L-天冬氨酸脱羧酶(panD)的位点突变体后提高了催化稳定性,与 L-天冬氨酸酶(AspA)偶联,以富马酸为底物合成β-丙氨酸,产率为118.6 g/L,转化率大于99%。Wang等人[48]采用三酶级联法,将大肠杆菌AspA、枯草杆菌(B.subtilis)L-天冬氨酸脱羧酶基因BSADC和赤拟谷盗虫(Triboliumcastaneum)L-天冬氨酸脱羧酶基因TCADC共表达,实现了从富马酸到β-丙氨酸的一锅合成法,能够得到200.3 g/L的β-丙氨酸,转化率为90.0%。Ko等人[49]利用组成型启动子表达AspA和panD强化了β-丙氨酸合成途径,并利用该途径实现了在大肠杆菌中由葡萄糖合成丙烯酸的新生物合成途径。α-丙氨酸是β-丙氨酸的同分异构体,Liu等人[50]克隆了抗辐射不动杆菌(Acinetobacterradioresistens)的天冬氨酸-4-脱羧酶基因ArASD,其突变体(N35D)具有更高的催化效率和稳定性,与大肠杆菌AspA构建双酶体系催化富马酸合成α-丙氨酸,转化率达97.1%。
4 结论与展望
对天冬氨酸酶的研究已有几十年,关于它的酶学特性有了充分的研究,其催化机理也已被阐明。从嗜热微生物中分离和鉴定出的天冬氨酸酶为工业化应用提供了可能,但因其底物特异性,限制了可催化底物的范围。因此,利用定点突变等方法对酶基因进行改造来获得更广泛的可催化底物范围、更稳定的酶活和更高产的菌种成为研究的方向。天冬氨酸酶用于合成L-天冬氨酸及其衍生物、β-丙氨酸、L-精氨酸等已有较多研究,但还未实现工业化生产,相信随着现代生物技术的不断发展,以及市场需求的不断增加,天冬氨酸酶的规模化应用将会实现。

